Udo Bonnet, Castrop-Rauxel/Essen
Mit großem Interesse habe ich die Übersichtsarbeit von Lenz et al. in PPT 2023;30(4) [34] mit Fokus auf Risiken und Nutzen von Pregabalin gelesen und möchte die darin erwähnte Aufforderung zu diesbezüglich mehr Forschung, jedoch erweitert auf alle Gabapentinoide, mit diesem Artikel unterstützen. In Deutschland umfassen die Gabapentinoide (GPT) zusätzlich zu Pregabalin auch Gabapentin und es gibt gute Hinweise darauf, dass auch das nicht verschreibungsfähige „Nahrungsergänzungsmittel“ Phenibut dazugehört (Abb. 1; Tab. 1). In der Sorge, dass die Substanzklasse der Gabapentinoide zunehmend in Misskredit gerät, da deren Schadens- bzw. Suchtpotenzial überbewertet und deren Nutzen deshalb nicht weiter beachtet bzw. weiter erforscht wird, möchte ich hier einige ergänzende Informationen präsentieren und Anmerkungen machen.
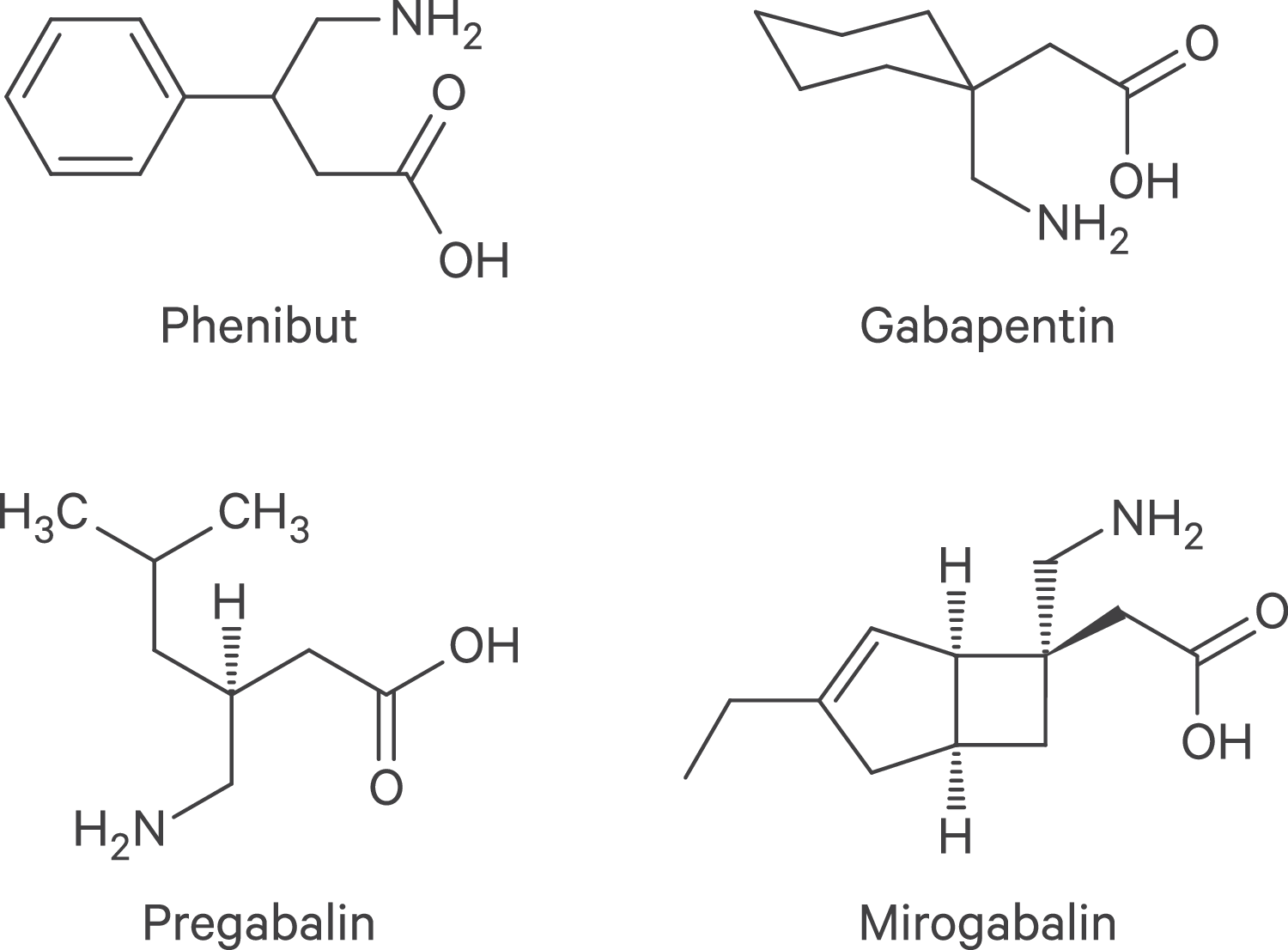
Abb. 1. Gabapentinoide (GPT)
Tab. 1. Liste der zugelassenen Gabapentinoide (GPT) nach Ländern* [7 ,11, 14, 19, 32, 33]
|
Gabapentinoid |
Erstzulassung |
Länder und Indikationen |
tmax |
Bioverfügbarkeit |
t½ |
KD |
|
Phenibut |
1965 |
Länder der ehemaligen Sowjetunion: Nootropikum, Alkoholentzugssymptome, verschiedene neurotische Symptome, Anxiolyse, Insomnie, Beruhigung/Sedierung, Muskelrelaxation. Analgesie, Epilepsie |
3–4 h |
ca. 65 % |
5–6 h |
21 ± 7 μM (schwächste Bindung von allen GPT) [32, 33] |
|
Gabapentin |
1994 |
Die meisten Länder: fokale Epilepsie mit und ohne sekundäre Generalisierung, neuropathische Schmerzen (diabetische Neuropathie, Post-Zoster-Neuralgie, Phantomschmerzen) |
3–4 h |
Dosisabhängig, intestinaler Sättigungsmechanismus |
5–6 h |
0,05 ± 0,01 μM [32, 33] |
|
Pregabalin |
2004 |
Die meisten Länder: fokale Epilepsie mit und ohne sekundäre Generalisierung, neuropathische Schmerzen (diabetische Neuropathie, Post-Zoster-Neuralgie, Phantomschmerzen) Europa: generalisierte Angststörung USA: Fibromyalgie |
≤ 1 h |
> 90 % |
6–7 h |
Ähnlich wie bei Gabapentin, dissoziiert aber langsamer als Gabapentin von den α2δ1- und α2δ-2-Untereinheiten der Voltage gated calcium channels (VGCC) [15] |
|
Gabapentin-Encarbil (Extended-Relase Prodrug von Gabapentin) |
2016 |
USA: primäre Restless Legs, Post-Zoster-Neuralgie Japan: primäre Restless Legs |
5–8 h |
60 % (nüchtern) bis 80 % (beim Essen eingenommen) |
5–8,5 h |
Wie Gabapentin |
|
Mirogabalin |
2019 |
Japan: neuropathische Schmerzen (diabetische Neuropathie, Post-Zoster-Neuralgie) |
1 h |
> 85 % |
2–5 h |
Ähnlich wie Gabapentin, dissoziiert aber noch langsamer als Pregabalin von den α2δ1- Untereinheiten (längste Bindung von allen GPT hier und dadurch theoretisch stärkste analgestische Potenz von allen GPT) [15, 20, 12] |
*vorbehaltlich individueller Regelungen in anderen Ländern
tmax: Zeit von der oralen Einnahme bis zum Erreichen der maximalen Konzentration im Blut; t1/2: Eliminationshalbwertszeit: KD: Dissoziationskonstanten bei α2δ-1/2-Untereinheiten
Definition der Substanzklasse
Pharmakologisch werden GPT durch ihre Eigenschaft definiert, an die Alpha-2-delta(α2δ)-Untereinheiten von präsynaptischen, spannungsabhängigen Calciumkanälen (Voltage-gated calcium channel: VGCC) zu binden (Infokasten 1). Dadurch wird die VGCC-vermittelte Exozytose von Neurotransmittern aus ihren Vesikeln in den synaptischen Spalt behindert. Da die Ausschüttung der Neurotransmitter hauptsächlich von der neuronalen Aktivität des präsynaptischen Neurons (und auch von der Dichte aktivierter VGCC in der Präsynapse) abhängt, entsteht dadurch eine Filterung der Informationsweiterleitung; bei exzitatorischen Synapsen wirkt sich das als Bremsung der neuronalen Aktivität im postsynaptischen Neuron aus [7, 14, 20].
Infokasten 1. Bindung von Gabapentinoiden an α2δ-Untereinheiten
Gabapentinoide binden an die α2δ-1- und α2δ-2-Transkripte. Das α2δ-1-Transkript wird primär in der Präsynapse von (meistens glutamatergen) exzitatorischen Synapsen, z. B. bei Spinalganglien-(DRG[dorsal root ganglion]-)Neuronen, exprimiert. Das α2δ-2-Transkript findet sich dagegen eher bei (meistens GABAergen) inhibitorischen Synapsen [20].
Wanderung der α2δ-Untereinheiten und neuroplastische Sensitisierung – Desensitisierung
In spinalen Neuronen wurde gefunden, dass α2δ-Untereinheiten intrazellulär von deren Entstehungsort (endoplasmatisches Retikulum/Golgi-Apparat) über Transportvesikel oder Recycling-Endosomen zu einem präsynaptischen VGCC-Komplex wandern (Trafficking). Durch ihr Andocken stabilisieren die α2δ-Untereinheiten den VGCC-Komplex und fördern dadurch dessen Aktivität („auxiliäre“ α2δ-Untereinheiten) [20], was zur aktivitätsabhängigen Ausschüttung von Neurotransmittern führt. Speziell können die α2δ-Proteine auf diesem Wege auch bei glutamatergen NMDA(N-Methyl-D-aspartat)-Rezeptoren andocken und dadurch (nach intrazellulärem – transmembranösem – transsynaptischem Trafficking) exzitatorische Synapsen (postsynaptisch) noch empfindlicher für neuronale Inputs machen (Sensitisierung) (Infokasten 2) [9, 16, 26]. GPT wären in diesem Kontext also Desensitisierer an exzitatorischen Synapsen (und damit auch von deren neuroplastischer Langzeit-Potenzierung [LTP]), ähnlich wie beispielsweise auch für Ketamin [27] beschrieben.
Infokasten 2. Sensitisierung
Sensitisierung – auch als Sensitivierung oder Sensibilisierung bezeichnet – beschreibt einen neuroassoziativen Lernvorgang, bei dem die wiederholte Anwendung eines Stimulus zu einer progressiven Verstärkung der Antwort führt (Erhöhung der Reaktionsbereitschaft bzw. Senkung der Reaktionsschwelle).
Hyperalgesie, „Wanting“, Entzugssymptome, besondere Neigung von Opiatabhängigen zur GPT-Einnahme und Atemdepression
GPT können offenbar klinische Phänomene abschwächen, die auf der Hypersensitisierung verschiedener (oft monoaminerger – hier insbesondere exzitatorischer und opioiderger) Rezeptoren/Netzwerke zu beruhen scheinen. Im Übrigen kann Hypersensitisierung auch als ein Mechanismus der Chronifizierung von Beschwerden verstanden werden. Die Rolle der CACNA2D1-Gene, die α2δ-1- und α2δ-2-Proteine kodieren [20], dürfte hier ein interessantes Forschungsfeld eröffnen. So ist zum Beispiel denkbar, dass der Expressionslevel dieser Proteine, den (kritischen) Sensitisierungs- oder oxidativen Stresszustand einer Synapse anzeigt. Inzwischen sind für CACNA2D1-Gene Assoziationen mit einigen zur Chronifizierung neigenden schweren neuropsychiatrischen Störungen wie Epilepsie, Autismus, Depression, bipolare Störung und Schizophrenie gefunden worden [1].
Als Beispiele für „mildere Hypersensitisierungs-Syndrome“ könnten gelten:
- Periphere und zentrale Sensitisierung chronischer Schmerzen (Hyperalgesie),
- Opioid-induzierte Hyperalgesie (auch Motiv für die Selbstbehandlung von Opiatabhängigen mit GPT),
- Entzugssymptome (u. a. Cannabis-, Alkohol- und Opiat-Entzugssymptome; auch Motiv für die Selbstbehandlung von Suchterkrankungen mit GPT)
- Somatoforme bzw. funktionelle Störungen, chronischer Pruritus und im Tierexperiment auch biologische Korrelate der Suchtentwicklung, sog. „behavioral sensitization“ im Belohnungssystem („Wanting“; [9]).
- Generalisierte Angststörung und Depersonalisationserleben (mentales Fatigue?)
Auch wenn gut kontrollierte Studien zum Einsatz von GPT bei diesen „milderen Hypersensitisierungs-Syndromen“ kaum durchgeführt wurden (Ausnahmen: generalisierte Angststörung, chronische neuropathische Schmerzen [29, 39, 44] und Alkoholentzugssymptome [2, 18]), weist der oft kritisierte [28] und häufige Off-Label-Einsatz von GPT auch bei Opioid-induzierter Hyperalgesie, Entzugssymptomen und somatoformen Störungen etc. auch nach eigener Beobachtung auf eine gewisse Wirksamkeit hin. Selbst eine gesetzliche Regulierung der Verschreibung von Pregabalin und Gabapentin z. B. in England hat das diesbezügliche Verschreibungsverhalten der Hausärzte bisher kaum beeinflusst [30].
Aktuell wird besonders für µ-Opioid-Rezeptoren (MOR) die unter längerfristiger Dauerstimulation beobachtete „oppositionelle Toleranzentwicklung“ (Infokasten 3) als ein zentraler Mechanismus für Entzugssymptome sowie für die Opioid-induzierte Hyperalgesie diskutiert [6, 45]. Beide, sowohl die Opioid-bezogenen Entzugssymptome als auch die Opioid-induzierte Hyperalgesie, werden durch GPT und wohl auch Ketamin klinisch deutlich abgeschwächt [6, 40, 45]. Die Konsequenzen sind ein relatives „Einsparen“ von Opioiden, da eine gegenregulierende Dosissteigerung nicht mehr notwendig ist, und Anti-Hyperalgesie. Im Tierexperiment gibt es sogar erste Hinweise auf eine GPT-vermittelte Umkehr der Toleranz (reversed tolerance) [35]. Ein solcher Mechanismus (Abschwächung bzw. Umkehr der opiat-induzierten Toleranz gegen Atemdepression) würde die vermutete – aber präklinisch [24] wie klinisch [23, 44] noch nicht ausreichend validierte – vermehrte Inzidenz von Atemdepressionen und die damit verbundene Zunahme von Todesfällen bei solchen Opiatabhängigen erklären können, die gleichzeitig höhere GPT-Dosen konsumieren [35]. Ein diesbezügliches Problem scheint eher in Ländern mit einer „Opioid epidemic“ wie in Nordamerika, aber bisher nicht in Deutschland zu existieren [3].
Infokasten 3. Oppositionelle Toleranzentwicklung
Mit zunehmender Änderung der „Beanspruchung“ neuronaler Systeme inklusive zellmembranständiger oder transmembranöser Neurotransmitter-Rezeptoren kommt es zu Änderungen in der Plastizität dieser Systeme. In der Regel resultieren dynamische Anpassungsprozesse im Sinne der Homöostase/Allostase. Ein solcher Anpassungsprozess ist die oppositionelle Toleranz. Hier werden zelluläre/synaptische Gegenregulationsmechanismen aktiviert, die beispielsweise auf der Rezeptorebene bei zunehmender Stimulation zur Abnahme von deren Empfindlichkeit (Desensitisierung) und Down-Regulation (Abnahme ihrer Dichte auf der Zellmembran, ihrer Insertion, ihres Trafficking, ihrer Synthese und schließlich Abnahme der Transkription ihrer Komponenten sowie Zunahme ihrer Abbau/Recycling-Mechanismen) und ggf. zu Verschiebungen von synaptisch nach extrasynaptisch führen. Diese Gegenregulation können stimulations-, milieu- bzw. kontext-, system- und rezeptorabhängig zu mehr oder weniger ausgeprägten/dauernden „überschießenden“ Reaktionen führen, wenn die Stimulation schnell abnimmt oder – bei längeren („chronischen“) Aktivierungen – nicht zunimmt. Solche „überschießenden“ Reaktionen resultieren im Kern daraus, dass das betroffene „desensitisierte“ und „herunterregulierte“ Rezeptorsystem nicht mehr wie vorher funktioniert und im homöostatischen/allostatischen Sinne „Gegenspieler/Opponenten“ (z. B. bzgl. der neuronalen Aktivität: bei betroffenen inhibitorischen Elementen die exzitatorischen Mechanismen) relativ überaktiv agieren oder sogar „hypersensitiv“ geworden bzw. „heraufreguliert“ worden sind, bis sich die Homöostase/Allostase unter diesen Bedingungen erneut einstellt. Die Mikroglia soll bei diesen Anpassungen eine besondere Rolle spielen. Die oppositionelle Toleranz gilt als ein basaler Mechanismus, der die Ausprägung von Entzugssymptomen auf der Verhaltensebene mitbestimmt [51–54].
GABA-mimetische Wirkung, „Liking“, Sedierung, Entzugssymptome und Abdosierungsschema
Eine weitere, noch zu wenig beforschte Wirkung von GPT ist ihre Fähigkeit, dosisabhängig die extrasynaptische („ambiente“) extrazelluläre GABA-Konzentration im Hirngewebe zu erhöhen [9]. Es gibt frühe Hinweise auf eine aktivitätsabhängige GPT-vermittelte Zunahme der intrazellulären GABA-Synthese und Umkehr der Richtung des GABA-Transporters („GABA transporter reversal“) mit dem Resultat der Erhöhung der ambienten GABA-Konzentration [4, 43]. Ein Einfluss von GPT über Zytokine könnte auch beteiligt sein [31]. Darüber hinaus ist vor kurzem eine GPT-vermittelte Steigerung der Expression spezieller extrasynaptischer GABAA-Rezeptoren, die charakteristischerweise Delta-Untereinheiten enthalten, beschrieben worden [49]. Solche extrasynaptischen GABA-Rezeptoren haben definitionsgemäß keinen relevanten Einfluss mehr auf die oft „phasische“ synaptische Plastizität (z. B. die Langzeit-Depression [LTD] – mit Blick auf GABA); sie sollen eher in übergeordnete Funktionen von Neuronen-Verbänden involviert sein [17], die einen „tonischen“ Einfluss auf die Regulation der neuronalen Erregbarkeit/Plastizität, der Stimmung, des Schlafs, der Kognition und von Schmerzen (ebenfalls Anti-Hyperalgesie) haben [42, 43, 48].
Damit gehören GPT, obwohl sie nicht direkt an GABA-Rezeptoren binden können, tatsächlich auch zur Substanzklasse der GABA-Mimetika [6], die sich klinisch durch dosisabhängige Stimulierung, Euphorisierung/Angstlösung („Liking“) und Sedierung – aber auch rasche diesbezügliche Toleranzentwicklung – auszeichnen, im Übrigen alles Motive für eine eigenmächtige Dosissteigerung von GPT, nicht nur bei Opiatabhängigen [9]. Andere typische GABA-mimetische Phänomene sind Entzugssymptome, die Alkohol- und Benzodiazepin-Entzugssymptomen ähnlich sind – inklusive epileptischer Anfälle und Delirien, die für GPT inzwischen zuverlässig dokumentiert wurden [9]. Deshalb wird zum Beispiel in den aktuellen deutschen S3-Leitlinien zur Behandlung der Medikamentenabhängigkeit eine sukzessive Dosisreduktion beim Absetzen von regelmäßig eingenommenen GPT empfohlen [41]. Ein ambulantes Abdosierungs-Schema wird zum Beispiel von der Bundesärztekammer [13] oder bei [9] skizziert. Sowohl GPT selbst als auch Benzodiazepine und Propofol (GABA-Mimetikum der Intensivmedizin) sind wirksam gegen leichte bis extreme Entzugssymptome [9].
Phenibut
Überraschenderweise existiert mit Phenibut ein im Internet unkompliziert zu erwerbendes „Nahrungsergänzungsmittel“, das kürzlich auch als GPT identifiziert wurde [32]. Phenibut hat eine lange Tradition als russisches Arzneimittel, das in Ländern der ehemaligen Sowjetunion seit Ende der 60er-Jahre gegen einige „neurotische“ (heute eher definiert als somatoforme) Beschwerden und Entzugssymptome eingesetzt wird [33]. Pharmakologisch bindet Phenibut jedoch deutlich schwächer (Dissoziationskonstante KD = 21 ± 7 μM) an die auxiliären α2δ-Untereinheiten als Gabapentin (KD = 0,05 ± 0,01 μM) (Tab. 1) [32, 33], dem bisher diesbezüglich schwächsten im klinischen Einsatz befindlichen GPT. Eine präzise klinisch-pharmakologische Einschätzung des Risikopotenzials von Phenibut im Vergleich mit Gabapentin und Pregabalin steht noch aus.
Gefährdungspotenzial von GPT und besondere Herausforderungen
Bisher gehören GPT zu den sichersten und am besten tolerierbaren Psychopharmaka [14], trotz sich häufender Berichte über GPT-bezogene Abhängigkeit und Atemdepression (meistens bei Opiatabhängigen und polyvalent Substanzabhängigen) [7, 9]. Legt man die weltweit sehr hohe Verschreibungszahl (Pregabalin ist mittlerweile ein „Blockbuster“) und den nicht nur in Deutschland1 verbreiteten nichtmedizinischen Konsum von GPT [25] zugrunde, dann relativieren sich diese Berichte schnell [38]. Am Ende der letzten Dekade schätzten deutsche Suchtmediziner das Schadenspotenzial von GPT im Vergleich zu anderen psychotropen Substanzen noch eher niedrig ein (Abb. 2; [8]).
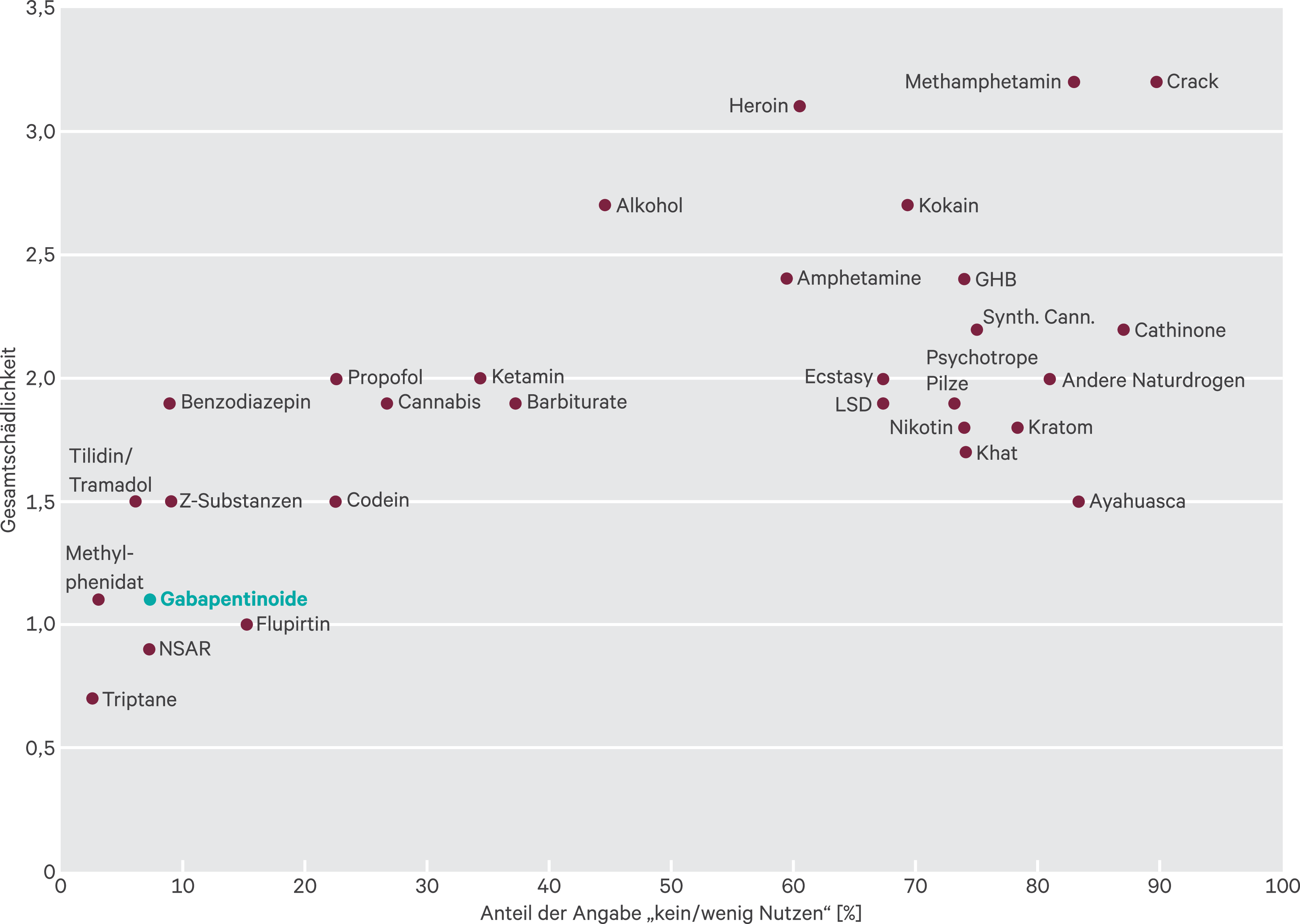
Abb. 2. Einschätzung von 101 deutschen Suchtmedizinern bezüglich der durchschnittlichen Gesamtschädlichkeit einer Substanz in Relation zu ihrem durchschnittlichen Nutzen (Kategorie: „kein/wenig Nutzen“). Optisch grenzen sich zwei Gruppen ab: im linken unteren Quadranten die verschreibungsfähigen Medikamente und im oberen rechten Quadranten die nicht verschreibungsfähigen Drogen [8]. Die hier gezeigte Einschätzung dürfte deutlich anders ausfallen in Ländern, die sich mit einer Opioid-Epidemie auseinandersetzen müssen, wie z. B. den USA, wo GPT ein höheres Schadenspotenzial bez. Abhängigkeit und Atemdepressionen zugeschrieben wird [3, 5, 22]. GHB: Gamma-Hydroxybuttersäure; LSD: Lysergsäurediethylamid; NSAR: nichtsteroidale Antiphlogistika
Allerdings besteht eine besondere Herausforderung darin, die Opiatabhängigen in Opiatsubstitutionsbehandlungen oder in Justizvollzugsanstalten am GPT-Konsum zu hindern, der nicht selten, um Rezepte zu erhalten, mit vermehrten Krankheitssimulationen (z. B. chronische Schmerz- und Angsterkrankungen), aber insbesondere auch Intoxikationserscheinungen durch Überdosierung (oft Sedierung, Dysarthrie, Gangstörung) einhergeht [7, 36].
Um das tatsächliche Gefährdungspotenzial von GPT zu bestimmen, sind ausreichend große, prospektive epidemiologische und gut kontrollierte klinische Studien erforderlich, die aktuell noch nicht existieren. Deshalb kann auch die Alternativ-Hypothese noch nicht widerlegt werden, dass GPT eher einen günstigen Einfluss auf Opiatabhängige und polyvalent Substanzabhängige haben, indem sie dabei helfen, Opioide und andere gefährlichere Sedativa wie Benzodiazepine einzusparen (anti-adverse-selection hypothesis). Bei Todesfällen im Kontext von Opiaten und Sedativa würden sie im Urin dann eher als „bystander“ gefunden, d. h. ohne relevanten Kausalitätsanspruch [5, 7].
Eigene Erfahrungen und Empfehlungen
Seit Mitte der 90er-Jahre habe ich gute Erfahrungen gemacht mit der gezielten und gut kontrollierten, in der Regel vorübergehenden Verordnung von GPT bei verschiedenen psychiatrischen Störungen, chronischen Schmerzerkrankungen und Suchterkrankungen. Dabei kann ich mich auch während der oft monate- und jahrelangen ambulanten Kontrollen an keinen Fall erinnern, bei dem durch GPT eine psychische Abhängigkeit oder Atemdepression ausgelöst worden wäre. In der Regel wurden GPT gut vertragen, gelegentlich wurde eine Tagesmüdigkeit bzw. bedenkliche Konzentrationsstörung, Reaktionszeitminderung, Denkverlangsamung, Dysarthrie, Wortfindungsstörung, leichte Gedächtnisstörung, Schwindel, Gangunsicherheit bzw. Stürze oder periphere Ödeme (meistens übergewichtige Männer mit alkoholbezogener Polyneuropathie oder übergewichtige ältere Frauen) beschrieben. Nach Dosisreduktion bzw. ausschleichendem Absetzen waren diese Beschwerden jedes Mal reversibel. Bei geriatrischen Patienten [7] gilt auch bei GPT „start low“ (initial 100 mg Gapapentin, oder 25 mg Pregabalin) „and go slow“. Eine eigenmächtige Dosissteigerung in supratherapeutische Bereiche passierte selten, dann charakteristischerweise in der Risikopopulation (s. u.). Darüber hinaus kann ich mich an keinen Patienten erinnern, der sich primär zur elektiven Entgiftung von GPT ambulant oder stationär in der Klinik (ca. 500 elektive Entgiftungsbehandlungen pro Jahr) vorstellte. Das soll nicht ausschließen, dass solche Fälle existieren [21, 47], dann aber wohl eher selten. Vermieden habe ich in der Regel die ambulante Verordnung von GPT bei Risikopopulationen (Opiatsubstituierten, polyvalent Substanzabhängigen, Häftlingen). Wenn es wegen einer behandlungsrelevanten Komorbidität, zu deren Behandlung GPT zugelassen waren, nicht zu vermeiden war, wurde die GPT-Verordnung besonders engmaschig kontrolliert: in den ersten zwei bis drei Monaten alle ein bis zwei Wochen. Bei ersten Hinweisen auf einen Fehlgebrauch (unangemessene Zunahme der Rezeptwünsche oder Berichte über Dosissteigerung und Intoxikationen) wurde die GPT-Behandlung sofort ausschleichend beendet (Versuch einer risikoadaptierten, präzisionsbasierten Medizin). Unbedingt sollte es zur Psychoedukation von Patienten in der GPT-Behandlung gehören, darüber zu informieren, dass GPT (i) stimulieren, euphorisieren und sedieren können, jedoch (ii) mit rascher Toleranzentwicklung. Eine beispielsweise daraus resultierende (iii) eigenmächtige Dosissteigerung in supratherapeutische Bereiche kann zum Koma und zur Atemdepression führen, insbesondere, wenn andere Sedativa und Opiate zusätzlich konsumiert werden (synergistische Wirkung, [37]). Ein unmittelbares Absetzen von GPT ist oft mit (iv) deutlichen Entzugssymptomen verbunden. Dies gilt mittlerweile aber fast für alle häufig verschriebenen Psychopharmaka, auch Antidepressiva und Antipsychotika [10, 12], wobei hier im Gegensatz zu GPT (und Benzodiazepinen) epileptische Anfälle und Delirien eher sehr selten sind.
Ausblick
Neben dem tatsächlichen Ausmaß von psychischen Abhängigkeitserkrankungen und Atemdepressionen im Zusammenhang mit GPT sollten prospektive Studien klären, ob GPT bei psychiatrischen Störungen und chronischen Schmerzen eine Toleranzentwicklung zeigen. In meiner ambulanten Behandlung entstand jedoch nicht selten nach ein paar Wochen bis Monaten dieser Eindruck, was entweder zu einer vorsichtigen Abdosierung oder fluktuierenden Dosisänderung führte.
Interessenkonflikt
Es besteht kein Interessenkonflikt in Bezug auf diesen Artikel.
1 In der EU werden im Bereich der verschreibungsfähigen Medikamente aktuell am häufigsten Opiate missbraucht – gefolgt von Benzodiazepinen, GPT und Antidepressiva [15].
Literatur
1. Ablinger C, Geisler SM, Stanika RI, Klein CT, Obermair GJ. Neuronal α2δ proteins and brain disorders. Pflugers Arch. 2020;472:845–63.
2. Anton RF, Latham P, Voronin K, Book S, et al. Efficacy of gabapentin for the treatment of alcohol use disorder in patients with alcohol withdrawal symptoms: A randomized clinical trial. JAMA Intern Med. 2020;180:728–36.
3. Bonnet U, Auwärter V, Scherbaum N. Gabapentinoid – related deaths: An alarming global trend or just a special challenge within the long tail of the giant opioid epidemic? Lancet Reg Health Am 2022;11:100309.
4. Bonnet U, Banger M, Leweke FM, Maschke M, et al. Treatment of alcohol withdrawal syndrome with gabapentin. Pharmacopsychiatry 1999;32:107–9.
5. Bonnet U, McAnally H. Gabapentinoids: condemned without sufficient evidence? Lancet Reg Health Eur 2023;28:100629.
6. Bonnet U, McAnally HB. How prevalent and severe is addiction on GABA-mimetic drugs in an elderly German general hospital population? Focus on gabapentinoids, benzodiazepines and z-hypnotic drugs. Hum Psychopharmacol 2022;37:e2822.
7. Bonnet U, Scherbaum N. Über das Abhängigkeitspotential von Gabapentinoiden (On the risk of dependence on gabapentinoids). Fortschr Neurol Psychiatr 2018;86:82–105.
8. Bonnet U, Specka M, Soyka M, Alberti T, et al. Ranking the harm of psychoactive drugs including prescription analgesics to users and others – A perspective of German addiction medicine experts. Front Psychiatry. 2020;11:592199.
9. Bonnet U. Gabapentinoide: entwichen aus der Büchse der Pandora? DNP – Die Neurologie & Psychiatrie 2022;23:32–8.
10. Brandt L, Bschor T, Henssler J, Müller M, et al. Antipsychotic withdrawal symptoms: A systematic review and meta-analysis. Front Psychiatry 2020;11:569912.
11. Brown K, Mendell J, Ohwada S, Hsu C, et al. Tolerability, pharmacokinetics and pharmacodynamics of mirogabalin in healthy subjects: Results from phase 1 studies. Pharmacol Res Perspect 2018;23;6:e00418.
12. Bschor T, Bonnet U, Pitzer M, Baethge C, et al. Absetzen von Antidepressiva – Absetzsymptome und Rebound-Effekte: Übersicht und praktische Empfehlungen (Stopping antidepressants: withdrawal symptoms and rebound effects: Review and practical recommendations). Nervenarzt. 2022;93:93–101.
13. Bundesärztekammer 2022. https://www.bundesaerztekammer.de/themen/aerzte/public-health/suchtmedizin/medikamentenabhaengigkeit/gabapentinoide; (Zugriff am 01.08.2023).
14. Calandre EP, Rico-Villademoros F, Slim M. Alpha2delta ligands, gabapentin, pregabalin and mirogabalin: a review of their clinical pharmacology and therapeutic use. Expert Rev Neurother 2016;16:1263–77.
15. Carmona Araújo A, João Casal R, Goulão J, Martins AP. Misuse of psychoactive medicines and its consequences in the European Union – a scoping review, J Subst Use 2023 (Epub ahead of print), DOI: 10.1080/14659891.2023.2213325.
16. Chen J, Li L, Chen SR, Chen H, et al. The α2δ-1-NMDA receptor complex is critically involved in neuropathic pain development and gabapentin. Therapeutic Actions Cell Rep 2018;22:2307–23.
17. Cheng VY, Bonin RP, Chiu MW, Newell JG, et al. Gabapentin increases a tonic inhibitory conductance in hippocampal pyramidal neurons. Anesthesiology 2006;105:325–33.
18. Cheng YC, Huang YC, Huang WL. Gabapentinoids for treatment of alcohol use disorder: A systematic review and meta-analysis. Hum Psychopharmacol 2020;35:1–11.
19. Deeks ED. Mirogabalin: First global approval. Drugs. 2019;79:463–68.
20. Dolphin AC. Voltage-gated calcium channels and their auxiliary subunits: physiology and pathophysiology and pharmacology. J Physiol 2016;594:5369–90.
21. Driot D, Jouanjus E, Oustric S, Dupouy J, et al. Patterns of gabapentin and pregabalin use and misuse: Results of a population-based cohort study in France. Br J Clin Pharmacol 2019;85:1260–9.
22. Evoy KE, Sadrameli S, Contreras J, Covvey JR, et al. Abuse and misuse of pregabalin and gabapentin: A systematic review update. Drugs 2021;81:125–56.
23. Fernández-Liz E, Barceló-Colomer ME, Gómez-Ganda L, Varon-Galcera C, et al. Prevalence of gabapentinoids and central nervous system depressant drugs, and their association with risk factors for respiratory depression in primary care patients. Clin Drug Investig 2022;42:417–26.
24. Flynn SM, France CP. Effects of gabapentinoids on heroin-induced ventilatory depression and reversal by naloxone. ACS Pharmacol Transl Sci 2023;6:519–25.
25. Fonseca F, Lenahan W, Dart RC, Papaseit E, et al. Non-medical use of prescription gabapentinoids (gabapentin and pregabalin) in five European countries. Front Psychiatry 2021;12:676224.
26. Geisler S, Schöpf CL, Obermair GJ. Emerging evidence for specific neuronal functions of auxiliary calcium channel α₂δ subunits. Gen Physiol Biophys 2015;34:105–18.
27. Glasgow NG, Povysheva NV, Azofeifa AM, Johnson JW. Memantine and ketamine differentially altar NMDA receptor desensitization. J Neurosci 2017;37:9686–9704.
28. Goodman CW, Brett AS. A clinical overview of off-label use of gabapentinoid drugs. JAMA Intern Med 2019;179:695–701.
29. Gurba KN, Chaudhry R, Haroutounian S. Central neuropathic pain syndromes: current and emerging pharmacological strategies. CNS Drugs. 2022;36:483–516.
30. Kamerman P. Rescheduling gabapentinoids had negligible effects on prescribing behaviour by general practitioners in England. Pharmacoepidemiol Drug Saf 2023;32:924–32.
31. Kremer M, Salvat E, Muller A, Yalcin I, Barrot M. Antidepressants and gabapentinoids in neuropathic pain: Mechanistic insights. Neuroscience 2016;338:183–206.
32. Kupats E, Vrublevska J, Zvejniece B, Vavers E, et al. Safety and tolerability of the anxiolytic and nootropic drug phenibut: A systematic review of clinical trials and case reports. Pharmacopsychiatry 2020;53:201–8.
33. Lapin I. Phenibut (beta-phenyl-GABA): a tranquilizer and nootropic drug. CNS Drug Rev 2001;7:471–81.
34. Lenz AJ; Philipsen A, Rohner R. Pregabalin in der klinisch-psychiatrischen Versorgung. Psychopharmakotherapie 2023;30:109–22.
35. Lyndon A, Audrey S, Wells C, Burnell ES, et al. Risk to heroin users of polydrug use of pregabalin or gabapentin. Addiction 2017;112:1580–9.
36. Marcot, D, Castelan Camargo HC, Prégabaline sous la loupe carcérale. Réflexions sur une problématique émergente. L’Encéphale 2023;49:199–201.
37. McAnally H, Bonnet U, Kaye AD. Gabapentinoid benefit and risk stratification: mechanisms over myth. Pain Ther 2020;9:441–52.
38. McAnally HB, Bonnet U. Response to comment on “Gabapentinoid benefit and risk stratification: Mechanisms over myth”. Pain Ther. 2021;10:757–62.
39. Meaadi J, Obara I, Eldabe S, Nazar H. The safety and efficacy of gabapentinoids in the management of neuropathic pain: a systematic review with meta-analysis of randomised controlled trials. Int J Clin Pharm 2023;45:556–65.
40. Mizobuchi Y, Miyano K, Manabe S, Uezono E, et al. Ketamine improves desensitization of µ-opioid receptors induced by repeated treatment with fentanyl but not with morphine. Biomolecules 2022;12:426.
41. Offner K, Bonnet U, Hermle LE, Bumb JM, et al. Kapitel 3.4. Gabapentinoide. In: Deutsche Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde (DGPPN), Deutsche Gesellschaft für Suchtforschung und Suchttherapie (DG-Sucht). S3-Leitlinie Medikamentenbezogene Störungen – 1. Auflage. Version 01. 2020. 038–025l_S3_Medikamtenbezogene-Stoerungen_2021–01 (Zugriff am 31.07.2023).
42. Perez-Sanchez J, Lorenzo LE, Lecker I, Zurek AA, et al. α5GABAA receptors mediate tonic inhibition in the spinal cord dorsal horn and contribute to the resolution of hyperalgesia. J Neurosci Res 2017;95:1307–18.
43. Richerson GB, Wu Y. Role of the GABA transporter in epilepsy. Adv Exp Med Biol 2004;548:76–91.
44. Savelloni J, Gunter H, Lee KC, Hsu C, et al. Risk of respiratory depression with opioids and concomitant gabapentinoids. J Pain Res 2017;10:2635–41.
45. Stoicea N, Russell D, Weidner G, Durda M, et al. Opioid-induced hyperalgesia in chronic pain patients and the mitigating effects of gabapentin. Front Pharmacol 2015;6:104.
46. Szok D, Tajti J, Nyári A, Vécsei L. Therapeutic approaches for peripheral and central neuropathic pain. Behav Neurol 2019;2019:8685954.
47. Tambon M, Ponté C, Jouanjus E, Fouilhé N, et al. French Addictovigilance Network (FAN). Gabapentinoid abuse in france: Evidence on health consequences and new points of vigilance. Front Psychiatry 2021;12:639780.
48. Walker MC, Semyanov A. Regulation of excitability by extrasynaptic GABAA receptors. Results Probl Cell Differ 2008;44:29–48.
49. Yu J, Wang DS, Bonin RP, Penna A, et al. Gabapentin increases expression of δ subunit-containing GABAA receptors. EBioMedicine 2019;42:203–13.
50. Jacob TC, Moss SJ, Jurd R. GABAA receptor trafficking and its role in the dynamic modulation of neuronal inhibition. Nat Rev Neurosci. 2008;9(5):331–43.
51. Terunuma M, Pangalos MN, Moss SJ. Functional modulation of GABAB receptors by protein kinases and receptor trafficking. Adv Pharmacol. 2010;58:113–22.
52. Andrews PW, Kornstein SG, Halberstadt LJ, Gardner CO, Neale MC. Blue again: perturbational effects of antidepressants suggest monoaminergic homeostasis in major depression. Front Psychol. 2011;2:159.
53. Cahill CM, Walwyn W, Taylor AMW, Pradhan AAA, Evans CJ. Allostatic mechanisms of opioid tolerance beyond desensitization and downregulation. Trends Pharmacol Sci. 2016;37(11):963–76.
54. Koob GF. Drug addiction: Hyperkatifeia/negative reinforcement as a framework for medications development. Pharmacol Rev. 2021;73(1):163–201.
Univ.-Prof. (apl) Dr. med. Udo Bonnet, Klinik für Seelische Gesundheit, Evangelisches Krankenhaus Castrop-Rauxel (Akademisches Lehrkrankenhaus der Universität Duisburg-Essen), Castrop-Rauxel & LVR-Klinikum Essen, Klinik für Psychiatrie und Psychotherapie, Medizinische Fakultät, Universität Duisburg-Essen, Essen; Anschrift: Udo Bonnet, EVK Castrop-Rauxel, Grutholzalle 21, 44577 Castrop-Rauxel, E-Mail: udo.bonnet@uni-due.de
Gabapentinoids – desensitizers and GABA mimetics. Mechanisms, hypotheses and challenges regarding a clinically not yet sufficiently developed well-tolerated substance class
Gabapentinoids are increasingly discussed with regard to their damaging and addictive potential, respectively. This carries the risk of losing sight of their benefits. Further detailed studies are necessary in order to evaluate the risk-benefit profile. This article provides a short review of the state of knowledge and open questions for research.
Key words: Gabapentinoids, phenibut, desensitisation, hyperalgesia, withdrawal symptoms, respiratory depression
Psychopharmakotherapie 2023; 30(06):199-205
