Johannes Heck*, Hannover, Benjamin Krichevsky*, Hannover/Kiel, Olaf Krause, Hannover, Matthias Goebeler, Würzburg, Dirk O. Stichtenoth, Stefan Bleich, Hannover, Renate Grohmann, München, Dominik Dabbert, Bremen, Sermin Toto und Johanna Seifert, Hannover
Über 300 verschiedene Medikamente, darunter zahlreiche Psychopharmaka, können die Lichtempfindlichkeit der Haut erhöhen [30]. Arzneimittelbedingte Photosensibilisierungen treten klinisch als Photosensitivitätsreaktionen (PSR) in Erscheinung und sind für bis zu 8 % aller kutanen unerwünschten Arzneimittelwirkungen (UAW) verantwortlich [41]. Damit ein Medikament eine PSR hervorrufen kann, müssen im Wesentlichen drei Bedingungen erfüllt sein: (1) die Reaktion tritt nur im Zusammenhang mit ultravioletter (UV) oder sichtbarer Strahlung auf, (2) das Medikament oder einer seiner Metaboliten muss zum Zeitpunkt der Bestrahlung in der Haut präsent sein und (3) der Wirkstoff und/oder sein(e) Metabolit(en) müssen in der Lage sein, sichtbare oder UV-Strahlung zu absorbieren. UV-A-Strahlung (Wellenlänge 315 bis 400 nm), welche tiefer in die Haut eindringt als UV-B-Strahlung (Wellenlänge 280 bis 315 nm), ist der häufigste Auslöser von PSR. Pathophysiologisch lassen sich arzneimittelinduzierte Photodermatosen in phototoxische und photoallergische Reaktionen differenzieren (Tab. 1) [6].
Tab. 1. Kriterien zur Unterscheidung zwischen arzneimittelbedingter Phototoxizität und Photoallergie (nach [6, 44])
|
Kriterium |
Phototoxizität |
Photoallergie |
|
Inzidenz |
Hoch |
Niedrig |
|
Pathophysiologie |
Direkte Zell- bzw. Gewebeschädigung |
Typ-IV-Hypersensitivitätsreaktion |
|
Erforderliche Medikamentendosis |
Übliche bis hohe Dosis |
Geringe Dosis |
|
Erforderliche Strahlendosis |
Hoch |
Gering |
|
Beginn nach Lichtexposition |
< 24 Stunden |
≥ 24 Stunden |
|
Vorangegangene Sensibilisierung erforderlich |
Nein |
Ja |
|
Klinisches Bild |
Ausgeprägter Sonnenbrand |
Ekzem |
|
Lokalisation |
Beschränkt auf lichtexponierte Körperpartien |
Ausbreitung auf unbelichtete Körperpartien möglich |
|
Begrenzung der Hautläsionen |
Eher scharf |
Eher unscharf |
|
Dynamik der Hautläsionen |
Decrescendo |
Crescendo |
|
Pigmentveränderungen/postinflammatorische Hyperpigmentierungen |
Häufig |
Selten |
Phototoxische Reaktionen kommen deutlich häufiger vor als photoallergische und treten Minuten bis Stunden nach Sonnenlichtexposition in Form eines massiven Sonnenbrands auf (Abb. 1). Sie bleiben üblicherweise auf sonnenexponierte Körperpartien beschränkt und sind abhängig von der Dosis des auslösenden Medikaments und dem Ausmaß der Bestrahlung. Phototoxische Reaktionen können bereits bei erstmaliger Einnahme eines Medikaments auftreten [30].
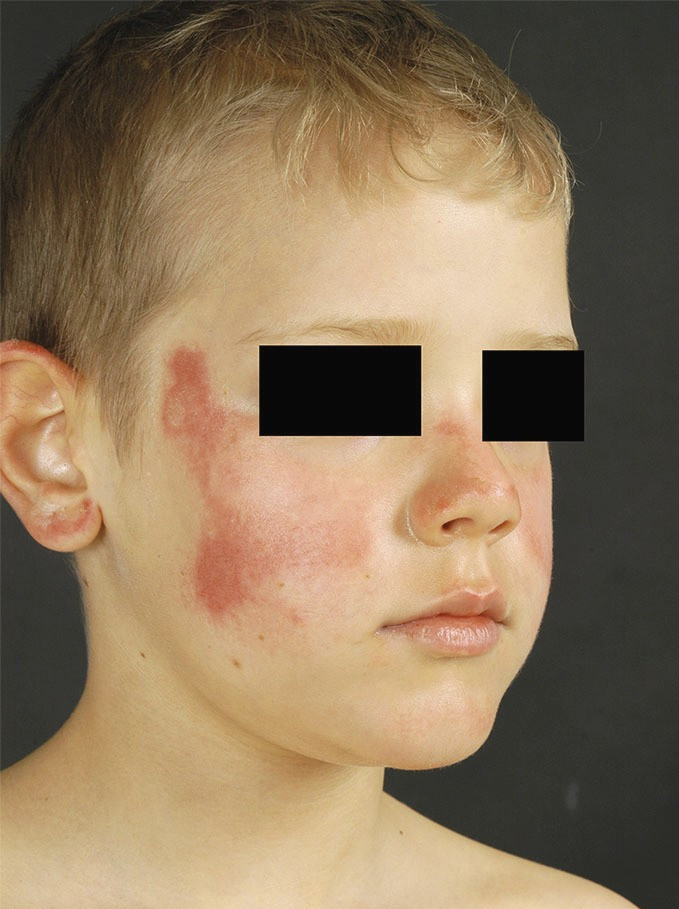
Abb. 1. 11-jähriger Junge mit einer phototoxischen Reaktion im Gesicht, die sich zwei Wochen nach dem Beginn der Einnahme von Doxycyclin entwickelte [Foto: Goebeler]
Photoallergische Reaktionen erfordern demgegenüber eine vorherige Sensibilisierung. Hierbei wird das ursächliche Medikament infolge einer UV-Einwirkung zum Hapten bzw. Antigen und ruft bei genetisch prädisponierten Personen im Falle nachfolgender Sonnenexpositionen eine immunologische Reaktion im Sinne einer Typ-IV-Allergie hervor. Photoallergische Reaktionen treten ≥ 24 Stunden nach Bestrahlung in Form eines Ekzems auf und können sich auf unbelichtete Körperpartien ausdehnen. Kreuzreaktionen mit chemisch verwandten Wirkstoffen sind möglich [30].
Eine Differenzierung zwischen phototoxischen und photoallergischen Reaktionen kann mittels Anamnese, körperlicher Untersuchung, spezieller Diagnostik (systemische Photoprovokation, Photopatch-Test) sowie gegebenenfalls durch eine Probebiopsie und histopathologische Untersuchung erfolgen. Eine eindeutige Unterscheidung der beiden Reaktionsmuster auf Photosensibilisatoren ist nicht immer möglich. Erschwerend kommt hinzu, dass viele Medikamente sowohl phototoxische als auch photoallergische Reaktionen hervorrufen können. Allerdings hat die Differenzierung in Phototoxizität versus Photoallergie bei den meisten betroffenen Patienten keine oder nur geringe Auswirkungen auf die Art der Behandlung [6, 30].
Seltenere Manifestationsformen der Photosensibilisierung sind lichenoide Eruptionen, Pseudoporphyrie, Onycholyse (Ablösung von Finger- bzw. Fußnägeln aus dem Nagelbett), Erythema multiforme, Hyperpigmentierung und Teleangiektasien. PSR können für betroffene Patienten nicht nur kosmetisch sehr belastend sein, sie stellen auch einen Risikofaktor für die Entwicklung kutaner Malignome (Basalzellkarzinom, kutanes Plattenepithelkarzinom und Melanom) dar [6, 22, 48]. Daher ist das Bewusstsein für und die Anwendung geeigneter Präventionsmaßnahmen zur Vermeidung arzneimittelbedingter PSR ein wichtiger Aspekt der Patientenversorgung.
Diagnostik
Die meisten arzneimittelinduzierten Photosensibilisierungen können klinisch mittels gezielter Fragestellung, ausführlicher Anamnese und körperlicher Untersuchung in Kenntnis der wichtigsten photosensibilisierenden Medikamente bzw. Medikamentengruppen, diagnostiziert werden. Apparative oder gar invasive Untersuchungen sind in der Regel zur Diagnosestellung nicht erforderlich.
Der Untersucher sollte besondere Aufmerksamkeit auf die Medikamentenanamnese richten – insbesondere auf die Berücksichtigung des zeitlichen Zusammenhangs zwischen der Einnahme neuer Medikamente sowie der Latenzzeit zwischen UV-Exposition und dem Auftreten der Reaktion. Im Rahmen der körperlichen Untersuchung ist vor allem auf das Verteilungsmuster der Hautläsionen zu achten. PSR präsentieren sich in der Regel an sonnenexponierten Körperpartien wie dem Gesicht (Abb. 1), im Dekolleté-Bereich, an den Handrücken sowie an den Streckseiten der Unterarme. Verschont bleiben hingegen „schattige“, das heißt vor Sonneneinstrahlung relativ geschützte Körperareale wie die Intertrigines, die Genitalregion, die oberen Augenlider, der Bereich des „Kinnschattens“ (submentale Region) sowie die Ohrmuschelrückseiten. Systemische Erkrankungen, welche die Lichtempfindlichkeit der Haut erhöhen, wie zum Beispiel der Lupus erythematodes oder die Porphyrie, sollten in der Differenzialdiagnostik berücksichtigt werden.
Kann durch die Anamnese und die körperliche Untersuchung die Ursache einer Photosensibilisierung nicht geklärt werden oder steht die Diagnose selbst infrage, so können die systemische Photoprovokation oder der Photopatch-Test zum Einsatz kommen. Diese Testverfahren sollten allerdings nur von Allergologen in spezialisierten Einrichtungen durchgeführt werden, da für Durchführung und Befundinterpretation besondere Fachkenntnisse und technische Voraussetzungen erforderlich sind. Aus diesem Grund sollen an dieser Stelle nur die Grundzüge der beiden genannten Testverfahren erläutert werden.
Bei der systemischen Photoprovokation wird mithilfe einer künstlichen UV-A- oder UV-B-Strahlenquelle die minimale Erythem-Dosis (MED) für einen Patienten unter zwei Bedingungen bestimmt: während der Einnahme des verdächtigten Arzneimittels und nach Absetzen der Medikation. Die MED ist die niedrigste Strahlendosis, die auf einer exponierten Hautstelle ein gleichmäßiges Erythem hervorruft. Wenn die MED niedriger ist, während der Patient das Medikament einnimmt, spricht dies für eine arzneimittelbedingte Photosensibilisierung.
Mithilfe des Photopatch-Tests kann eine photoallergische Reaktion nachgewiesen werden. Es handelt sich um eine Sonderform des Epikutan-Tests, bei welchem die als Auslöser in Betracht kommenden Pharmaka, gelöst in Vaseline, je einmal auf der linken und auf der rechten Hälfte des Rückens aufgeklebt werden. Nach 24 Stunden wird die eine Hälfte mit einer UV-A- oder einer UV-B-Dosis unterhalb der MED bestrahlt, die andere Hälfte der Testreihe verbleibt unbelichtet. Die Testfelder werden nach 24, 48 und 72 Stunden auf Erythem-, Ödem- und Blasenbildung untersucht. Tritt eine Reaktion nur auf der bestrahlten Seite auf, so ist dies ein Hinweis auf eine photoallergische Reaktion. Sind die bestrahlte und die unbelichtete Seite gleichermaßen betroffen, so ist von einem allergischen Kontaktekzem auf den Wirkstoff auszugehen. Sind beide Seiten betroffen und fällt die Reaktion auf der bestrahlten Seite stärker aus, liegt der Verdacht auf eine photoaggravierte allergische Reaktion nahe.
Ergibt sich aus der Diagnostik der Nachweis bzw. der begründete Verdacht einer photoallergischen Reaktion, so sollte ein Allergiepass ausgestellt werden, in dem die zu meidenden Photoallergene aufgeführt sind.
Photosensibilisierung durch Psychopharmaka
Zahlreiche Psychopharmaka können die Lichtempfindlichkeit der Haut erhöhen und PSR hervorrufen. Hierzu zählen Antipsychotika, Antidepressiva, einige Benzodiazepine, Phasenprophylaktika und Phytopharmaka. Eine Übersicht der photosensibilisierenden Wirkstoffe innerhalb der jeweiligen Klassen bietet Tabelle 2. Die mit den Wirkstoffen assoziierten Reaktionsmuster werden im Folgenden im Detail dargestellt.
Tab. 2. Photosensibilisierende Psychopharmaka und Medikamente zur Behandlung somatischer Erkrankungen (Auswahl; nach [6, 30])
|
Wirkstoffklasse |
Wirkstoff |
Art der Photosensitivitätsreaktion |
Häufigkeit von Photosensitivitätsreaktionen gemäß Fachinformation# |
|
Antipsychotika |
Aripiprazol |
Nicht definiert |
Nicht bekannt |
|
Chlorpromazin* |
PT, PA |
– |
|
|
Clozapin |
Nicht definiert |
Nicht gelistet |
|
|
Flupentixol |
PA |
Gelegentlich |
|
|
Fluphenazin |
PT, PA |
Photosensibilität in der Fachinformation als Nebenwirkung beschrieben, ohne Nennung einer Häufigkeitsangabe |
|
|
Haloperidol |
PT |
Gelegentlich |
|
|
Olanzapin |
PA |
Gelegentlich |
|
|
Perazin |
PT, PA |
Photosensibilität in der Fachinformation als Nebenwirkung beschrieben, ohne Nennung einer Häufigkeitsangabe |
|
|
Perphenazin |
PT, PA |
Gelegentlich |
|
|
Promethazin |
PT, PA |
Phototoxische und photoallergische Reaktionen in der Fachinformation als Nebenwirkung beschrieben, ohne Nennung einer Häufigkeitsangabe |
|
|
Risperidon |
Nicht definiert |
Nicht gelistet |
|
|
Thioridazin |
PT, PA |
Selten |
|
|
Trifluoperazin* |
PT, PA |
– |
|
|
Antidepressiva |
Amitriptylin |
PA |
Selten |
|
Citalopram |
PT, PA |
Gelegentlich |
|
|
Clomipramin |
PA |
Häufig |
|
|
Desipramin* |
PT |
– |
|
|
Escitalopram |
PT |
Nicht gelistet |
|
|
Fluoxetin |
PT |
Selten |
|
|
Fluvoxamin |
PT, PA |
Selten |
|
|
Imipramin |
PT |
In Einzelfällen |
|
|
Paroxetin |
PT, PA |
Sehr selten |
|
|
Phenelzin* |
Nicht definiert |
– |
|
|
Protriptylin* |
PT |
– |
|
|
Sertralin |
PA |
Selten |
|
|
Venlafaxin |
PT |
Gelegentlich |
|
|
Benzodiazepine |
Alprazolam |
PT |
Nicht gelistet |
|
Chlordiazepoxid |
PA |
Nicht gelistet |
|
|
Clorazepat |
Nicht definiert |
Nicht gelistet |
|
|
Phasenprophylaktika |
Carbamazepin |
PA |
Sehr selten |
|
Lamotrigin |
PT |
Nicht gelistet |
|
|
Phytopharmaka |
Johanniskraut |
PT |
Nicht bekannt |
|
Tetracycline |
Doxycyclin |
PT |
Sehr häufig |
|
Minocyclin |
PT |
Nicht bekannt |
|
|
Tetracyclin |
PT |
Nicht bekannt |
|
|
Fluorchinolone |
Ciprofloxacin |
PT |
Selten |
|
Levofloxacin |
PT |
Nicht bekannt |
|
|
Cephalosporine |
Cefotaxim |
PT |
Nicht gelistet |
|
Ceftazidim |
PT |
Nicht gelistet |
|
|
Andere Antibiotika |
Cotrimoxazol (Trimethoprim–Sulfamethoxazol |
PT, PA |
Nicht bekannt |
|
Dapson |
PT |
Nicht bekannt |
|
|
Isoniazid |
PT |
Nicht gelistet |
|
|
Antimykotika |
Griseofulvin* |
PT |
Nicht bekannt |
|
Itraconazol |
PT |
Selten |
|
|
Terbinafin |
PT |
Gelegentlich |
|
|
Voriconazol |
PT |
Gelegentlich |
|
|
Nichtsteroidale Antirheumatika |
Celecoxib |
PT, PA |
Selten |
|
Diclofenac |
PA |
Sehr selten |
|
|
Ibuprofen |
PT |
Gelegentlich |
|
|
Naproxen |
PT |
Gelegentlich |
|
|
Piroxicam |
PA |
Gelegentlich |
|
|
Diuretika |
Hydrochlorothiazid |
PT, PA |
Gelegentlich |
|
Furosemid |
PT |
Gelegentlich |
|
|
Indapamid |
PT |
Sehr selten |
|
|
ACE-Hemmer |
Enalapril |
PA |
Selten |
|
Ramipril |
PA |
Sehr selten |
|
|
AT1-Antagonisten |
Candesartan |
Nicht definiert |
Nicht gelistet |
|
Valsartan |
PA |
Nicht gelistet |
|
|
Calciumkanalblocker |
Amlodipin |
PT |
Sehr selten |
|
Nifedipin |
PT |
Selten |
|
|
Diltiazem |
PT, PA |
Nicht bekannt |
|
|
Antiarrhythmika |
Amiodaron |
PT, PA |
Sehr häufig |
|
Dronedaron |
PT |
Gelegentlich |
|
|
HMG-CoA-Reduktase-Hemmer |
Atorvastatin |
PT |
Nicht gelistet |
|
Pravastatin |
Nicht definiert |
Selten |
|
|
Simvastatin |
PA |
Selten |
|
|
Onkologika |
Epirubicin |
Nicht definiert |
Gelegentlich |
|
Fluorouracil |
PT, PA |
Selten |
|
|
Imatinib |
PT |
Häufig |
|
|
Paclitaxel |
PA |
Nicht gelistet |
|
|
Vemurafenib |
PT |
Sehr häufig |
|
|
Andere |
Clopidogrel |
Nicht definiert |
Nicht gelistet |
|
Ethinylestradiol |
PT |
Nicht gelistet |
|
|
Ranitidin |
PT |
Nicht gelistet |
|
|
Sulfasalazin |
PT |
Häufig |
Sehr häufig: ≥ 10 % der behandelten Patienten; häufig: ≥ 1 % bis < 10 %; gelegentlich: ≥ 0,1 % bis < 1 %; selten: ≥ 0,01 % bis < 0,1 %; sehr selten: < 0,01 %; nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
ACE: Angiotensin-Konversionsenzym; AT1: Angiotensin-II-Rezeptor Subtyp 1; HMG-CoA-Reduktase: 3-Hydroxy-3-Methylglutaryl-Coenzym-A-Reduktase; PA: photoallergisch; PT: phototoxisch
# Die aktuell (Stand April 2021) gültigen Fachinformationen wurden über das Arzneimittelinformationssystem AiD Klinik® (Dosing GmbH, Heidelberg, Deutschland) bzw. über das Fachinformationsverzeichnis Deutschland (https://www.fachinfo.de/) abgerufen.
* In Deutschland nicht bzw. nicht mehr zugelassen (gemäß Roter Liste [38])
Photosensibilisierung durch Antipsychotika
Antipsychotika aus der Gruppe der Phenothiazine, insbesondere das in Deutschland nicht mehr erhältliche, älteste Phenothiazin Chlorpromazin, aber auch Thioridazin [30, 36, 39], Fluphenazin und Perphenazin [12, 30], sind starke Photosensibilisatoren. PSR auf Chlorpromazin imponieren in Form einer ausgeprägten Dermatitis solaris („Sonnenbrand“), lichenoider Reaktionen oder als bullöse Eruptionen [13, 28, 34] und treten bei 16 bis 25 % der behandelten Patienten auf. Insbesondere hohe Dosen von 400 mg/Tag erhöhen die Auftretenswahrscheinlichkeit einer PSR unter Chlorpromazin [19]. Eine hochdosierte Langzeittherapie mit Chlorpromazin oder Thioridazin kann schiefergraue bis violette Hyperpigmentierungen in sonnenexponierten Hautarealen hervorrufen [39]. Darüber hinaus führen die Fachinformationen der Phenothiazine Perazin [15] und Promethazin [16] PSR als mögliche UAW auf.
Flupentixol, welches den Phenothiazinen chemisch verwandt ist, wurde ebenfalls als Auslöser erhöhter Lichtempfindlichkeit beschrieben [8]. Des Weiteren wurde für Haloperidol ein Fall einer PSR berichtet [43]. Die Fachinformation von Zuclopenthixol weist explizit darauf hin, dass unter Einnahme des Medikaments direkte Sonneneinstrahlung vermieden werden soll [14].
Im Allgemeinen gelten Antipsychotika der zweiten Generation als weniger photosensibilisierend als Antipsychotika der ersten Generation [6]. Gleichwohl sind PSR unter Behandlung mit Clozapin [1, 20] und Risperidon [2] dokumentiert. Für Olanzapin wurde ein Fall einer Photoonycholyse berichtet, welche sich nach Umstellung auf Aripiprazol noch verschlimmerte [18].
Photosensibilisierung durch Antidepressiva
Trizyklische Antidepressiva – chemisch strukturverwandt mit den Phenothiazin-Antipsychotika – sind als Photosensibilisatoren beschrieben [6, 26, 29]. Unter Therapie mit Amitriptylin kann eine Hyperpigmentierung sonnenexponierter Körperpartien auftreten [19]. Photosensibilisierung ist die häufigste kutane UAW von Imipramin, welche sich in Form persistierender Erytheme [46] sowie blau-grauer Hyperpigmentierung nach Langzeitexposition äußern kann [4, 29]. Derartige Hyperpigmentierungen sind auch im Zusammenhang mit Desipramin beschrieben [31]. Clomipramin hingegen wurde als Auslöser einer photoallergischen Dermatitis verdächtigt [26]. Insgesamt treten PSR jedoch seltener unter trizyklischen Antidepressiva als unter Phenothiazin-Antipsychotika auf [19].
Selektive Serotonin-Wiederaufnahmehemmer gelten nicht als potente Photosensibilisatoren [30]. Jedoch wurden Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin und Sertralin als Auslöser erythematöser Reaktionen nach Lichtexposition beschrieben [11, 35, 37]. Citalopram kann Hyperpigmentierungen an sonnenexponierten Körperpartien hervorrufen [21]. Bei einem mit Paroxetin behandelten Patienten manifestierte sich ein Granuloma anulare im Zusammenhang mit Lichtexposition [3]. Darüber hinaus wurde Sertralin als Auslöser einer makulösen, erythematösen, photoallergischen Reaktion beschrieben [25] und unter Fluoxetin wurden PSR wie Erytheme und Blasenbildung berichtet [17, 33].
Unter Therapie mit dem Serotonin-Noradrenalin-Wiederaufnahmehemmer Venlafaxin traten Teleangiektasien in sonnenexponierten Arealen auf [45]; Phenelzin, ein (in Deutschland nicht zugelassener) Monoaminoxidase-Hemmer, wurde ebenfalls als Photosensibilisator beschrieben [9].
Photosensibilisierung durch Benzodiazepine
Unter Therapie mit Alprazolam wurden juckende Exantheme an sonnenexponierten Körperpartien berichtet [23, 33]. Chlordiazepoxid kann photoallergische ekzematöse Eruptionen hervorrufen [27], während unter der Einnahme von Clorazepat eine Photoonycholyse berichtet wurde [19]. Für Lorazepam liegen keine Berichte über Photosensibilisierung vor.
Photosensibilisierung durch Phasenprophylaktika
Carbamazepin kann PSR in Form von ekzematösen und lichenoiden Eruptionen auslösen [42]. Darüber hinaus wird in einer Kasuistik der außergewöhnliche Fall einer Patientin geschildert, die unter Therapie mit Carbamazepin Verbrennungen im Gesichtsbereich nach längerer Arbeit an einem Photokopiergerät erlitt [47].
Auch unter Einnahme von Lamotrigin wurden PSR beobachtet; auf diese UAW wurde vor kurzem von der Arzneimittelkommission der deutschen Ärzteschaft hingewiesen [5].
Bork beschreibt Photosensibilität als eine der sechs klinisch relevantesten kutanen UAW von Valproinsäure [7]. Demgegenüber wird in den Fachinformationen verschiedener Arzneimittelhersteller Photosensibilisierung nicht als UAW von Valproinsäure gelistet und auch eine Literaturrecherche auf PubMed konnte diesbezüglich keine Fallberichte identifizieren.
Für Lithium wurden nach unseren Recherchen bisher keine PSR berichtet.
Photosensibilisierung durch Phytopharmaka
Bereits in den 30er-Jahren des 20. Jahrhunderts geriet Johanniskraut durch das hierin enthaltene Hypericin in den Verdacht, ausgeprägte PSR auszulösen. Initial wurde dieses Phänomen bei Weidetieren, die große Mengen an Johanniskraut zu sich genommen hatten, beobachtet [32]. Die UAW scheint vor allem von der Dosis des Phytopharmakons abhängig zu sein und tritt unter therapeutischen Dosen von Johanniskraut in der Behandlung depressiver Störungen eher selten auf [40].
Photosensibilisierung durch Medikamente zur Behandlung somatischer Erkrankungen
Eine Vielzahl an Medikamenten, die zur Behandlung somatischer Erkrankungen eingesetzt werden, kann ebenfalls die Lichtempfindlichkeit der Haut erhöhen und PSR hervorrufen. Zu den klinisch bedeutsamsten photosensibilisierenden Wirkstoffgruppen zählen Antiinfektiva, nichtsteroidale Antirheumatika, Antihypertensiva, Diuretika, Antiarrhythmika sowie Onkologika [6, 30]. Einen Überblick über die nach Meinung der Autoren für den Klinik- bzw. Praxisalltag relevantesten photosensibilisierenden Wirkstoffe bietet Tabelle 2.
Prävention und Therapie
Arzneimittelinduzierte Lichtempfindlichkeit ist ein häufiges klinisches Problem. Ärztinnen und Ärzte sollten sich des photosensibilisierenden Potenzials der von ihnen verschriebenen Medikamente bewusst sein und Patienten über geeignete Sonnenschutzmaßnahmen wie die Vermeidung direkter Sonnenexposition, insbesondere während der sonnenreichsten Stunden des Tages (ca. 11 bis 16 Uhr), das Tragen bedeckender Kleidung und eines Hutes mit breiter Krempe sowie die regelmäßige Anwendung von Sonnenschutzmitteln mit UV-A- und UV-B-Schutz aufklären. Bei der Applikation von Sonnenschutzmitteln ist auf eine ausreichende Quantität zu achten, häufig wird von Patienten eine zu geringe Menge aufgetragen [6, 30]. Unter diesen Vorsichtsmaßnahmen ist eine vorsichtige Lichtexposition möglich. Als klinisches Beispiel sei ein 80-jähriger Herr genannt, welcher aufgrund von Vorhofflimmern Amiodaron einnimmt. Nach Aufklärung kann der Patient mit Sonnenhut und -creme weiterhin Golf spielen gehen.
Tritt bei einem Patienten unter Einnahme eines potenziell photosensibilisierenden Medikaments ein Hautausschlag auf, so sollte zunächst der zeitliche Zusammenhang zwischen der Einnahme der Medikation, der UV-Exposition und dem Auftreten der Reaktion eruiert werden. In der körperlichen Untersuchung sollte der Fokus vor allem auf das Verteilungsmuster der Läsionen gelegt werden. In den meisten Fällen lässt sich aus der Zusammenschau von (Medikamenten-)Anamnese und körperlicher Untersuchung bereits die Diagnose einer PSR stellen. Die wichtigste therapeutische Maßnahme bei arzneimittelinduzierter Photosensibilisierung ist das Absetzen des verursachenden Wirkstoffs. In der Regel klingt die Photosensibilisierung bereits kurze Zeit nach Absetzen des auslösenden Agens ab. In einigen Fällen bleibt die erhöhte Lichtempfindlichkeit allerdings trotz Absetzen der verursachenden Medikation über mehrere Monate bestehen, zum Beispiel bei Amiodaron aufgrund dessen langer Halbwertszeit.
PSR können topisch mit einem Glucocorticoid-Präparat behandelt werden, um die Abheilung zu beschleunigen. Bei ausgeprägten Reaktionen ist unter Umständen auch eine systemische (perorale oder intravenöse) Gabe von Glucocorticoiden wie (Methyl-)Prednisolon erforderlich. Bei juckenden oder schmerzhaften (brennenden, stechenden) Hautläsionen können H1-Rezeptorantagonisten (z. B. Desloratadin) bzw. Analgetika (z. B. Ibuprofen) Linderung verschaffen. Bis zur Abheilung ist eine weitere Sonnenexposition der betroffenen Körperpartien strikt zu meiden [6, 30].
Photosensitivitätsreaktionen in der Psychiatrie
Die genaue Inzidenz von PSR unter Psychopharmaka ist unbekannt, es scheint sich hierbei jedoch um eine eher seltene UAW zu handeln. In der AMSP-Datenbank (AMSP, Arzneimittelsicherheit in der Psychiatrie) sind seit 2006 insgesamt acht Fälle von schwerwiegenden phototoxischen/-allergischen Reaktionen dokumentiert, die unter stationären Bedingungen aufgetreten sind. Auslösende Medikamente waren in jeweils einem Fall Amitriptylin, Chlorprothixen, Haloperidol, Lamotrigin, Lavendelöl (Handelspräparat Lasea®), Perphenazin, Sertralin und Trimipramin. Womöglich suchen ambulante Patienten, die von einer PSR betroffen sind, zunächst eher einen Dermatologen als einen Psychiater auf, sodass ein „Underreporting“ entsprechender Reaktionen denkbar ist. Dennoch sollte auch seitens der behandelnden Psychiater ein Bewusstsein für das potenzielle Auftreten von PSR unter Psychopharmaka (und anderen Arzneimitteln) bestehen. Derartige Hautreaktionen können nicht nur unangenehm und schmerzhaft im Akutfall sein, sondern auch die Entstehung schwerer Hautschädigungen in der Zukunft begünstigen. Ein Zusammenhang zwischen der Einnahme photosensibilisierender Wirkstoffe und dem vermehrten Auftreten von Hautkrebs wurde nachgewiesen [10, 24]. Insbesondere bei Patienten mit Risikofaktoren wie heller Haut, roten oder blonden Haaren, Hautkrebs(vorstufen) in der Anamnese sowie erhöhter beruflicher oder privater Sonnenexposition [10] sollte das photosensibilisierende Potenzial von Arzneimitteln bedacht und hierüber explizit aufgeklärt werden – gerade in den Sommermonaten.
Take-Home Messages
- Zahlreiche Psychopharmaka können die Lichtempfindlichkeit der Haut erhöhen und Photosensitivitätsreaktionen hervorrufen. Hierzu gehören Antipsychotika, insbesondere der ersten Generation, trizyklische Antidepressiva, einige Benzodiazepine, Phasenprophylaktika und Johanniskraut.
- Bei Patienten mit heller Haut, roten oder blonden Haaren, Hautkrebs(vorstufen) in der Anamnese sowie erhöhter beruflicher oder privater Sonnenexposition sollten photosensibilisierende Wirkstoffe mit besonderer Vorsicht angewandt werden. Über die erforderliche Einhaltung von Sonnenschutzmaßnahmen sollte explizit aufgeklärt werden.
- Insbesondere in den Sommermonaten ist es sinnvoll, Patienten, die Psychopharmaka einnehmen, aktiv nach einer vermehrten Neigung zu Sonnenbränden zu befragen.
Interessenkonflikterklärung
Dr. Sermin Toto: Vortragshonorare Janssen-Cilag GmbH, Otsuka/Lundbeck und Servier, Advisory Board Otsuka und Janssen-Cilag GmbH.
Dr. Johanna Seifert: Teilnahme an einer Fortbildungsveranstaltung, welche von Otsuka/Lundbeck gesponsert wurde.
Alle anderen Autorinnen und Autoren erklären, dass kein Interessenkonflikt besteht.
Literatur
1. Al-Aojan S, Al-Khalifah A. Clozapine-induced phototoxicity: an unusual side effect of atypical antipsychotics. Case Rep Dermatol Med 2018;2018:9242515.
2. Almond DS, Rhodes LE, Pirmohamed M. Risperidone-induced photosensitivity. Postgrad Med J 1998;74:252–3.
3. Alvarez-Perez A, Gomez-Bernal S, Gutierrez-Gonzalez E, Rodriguez-Granados MT, et al. Granuloma annulare photoinduced by paroxetine. Photodermatol Photoimmunol Photomed 2012;28:47–9.
4. Angel TA, Stalkup JR, Hsu S. Photodistributed blue-gray pigmentation of the skin associated with long-term imipramine use. Int J Dermatol 2002;41:327–9.
5. Arzneimittelkommission der deutschen Ärzteschaft. Drug Safety Mail 2020–71. https://www.akdae.de/Arzneimittelsicherheit/DSM/Archiv/2020-71.html (Zugriff am 11.01.2021).
6. Blakely KM, Drucker AM, Rosen CF. Drug-induced photosensitivity – An update: culprit drugs, prevention and management. Drug Saf 2019;42:827–47.
7. Bork K. Unerwünschte Arzneimittelwirkungen von Valproinsäure an der Haut und den hautnahen Schleimhäuten. In: Krämer G, Laub MC (Hrsg.). Valproinsäure. Berlin, Heidelberg: Springer-Verlag, 1992:217–24.
8. Bourrain JL, Paillet C, Woodward C, Beani JC, et al. Diagnosis of photosensitivity to flupenthixol by photoprick testing. Photodermatol Photoimmunol Photomed 1997;13:159–61.
9. Case JD, Yusk JW, Callen JP. Photosensitive reaction to phenelzine: a case report. Photodermatol 1988;5:101–2.
10. de Vries E, Trakatelli M, Kalabalikis D, Ferrandiz L, et al. Known and potential new risk factors for skin cancer in European populations: a multicentre case-control study. Br J Dermatol 2012;167(Suppl 2):1–13.
11. Doffoel-Hantz V, Boulitrop-Morvan C, Sparsa A, Bonnetblanc JM, et al. Photosensitivity associated with selective serotonin reuptake inhibitors. Clin Exp Dermatol 2009;34:763.
12. Eberlein-König B, Bindl A, Przybilla B. Phototoxic properties of neuroleptic drugs. Dermatology 1997;194:131–5.
13. Epstein JH, Brunsting LA, Petersen MC, Schwarz BE. A study of photosensitivity occurring with chlorpromazine therapy. J Invest Dermatol 1957;28:329–38.
14. Fachinformation Ciatyl-Z® (Stand: 2013). Bayer Vital GmbH, Leverkusen, Deutschland.
15. Fachinformation Perazin-neuraxpharm® (Stand: 2012). neuraxpharm Arzneimittel GmbH, Langenfeld, Deutschland.
16. Fachinformation Promethazin-neuraxpharm® 100 mg (Stand: 2014). neuraxpharm Arzneimittel GmbH, Langenfeld, Deutschland.
17. Gaufberg E, Ellison JM. Photosensitivity reaction to fluoxetine. J Clin Psychiatry 1995;56:486.
18. Gregoriou S, Karagiorga T, Stratigos A, Volonakis K, et al. Photo-onycholysis caused by olanzapine and aripiprazole. J Clin Psychopharmacol 2008;28:219–20.
19. Harth Y, Rapoport M. Photosensitivity associated with antipsychotics, antidepressants and anxiolytics. Drug Saf 1996;14:252–9.
20. Howanitz E, Pardo M, Losonczy M. Photosensitivity to clozapine. J Clin Psychiatry 1995;56:589.
21. Inaloz HS, Kirtak N, Herken H, Ozgoztasi O, et al. Citalopram-induced photopigmentation. J Dermatol 2001;28:742–5.
22. Jensen AO, Thomsen HF, Engebjerg MC, Olesen AB, et al. Use of photosensitising diuretics and risk of skin cancer: a population-based case-control study. Br J Cancer 2008;99:1522–8.
23. Kanwar AJ, Gupta R, Das Mehta S, Kaur S. Photosensitivity due to alprazolam. Dermatologica 1990;181:75.
24. Kreutz R, Algharably EAH, Douros A. Reviewing the effects of thiazide and thiazide-like diuretics as photosensitizing drugs on the risk of skin cancer. J Hypertens 2019;37:1950–8.
25. Lin NC, Chou JY, Chen H, Chen VC. Sertraline-induced photoallergic reaction. J Clin Psychopharmacol 2009;29:95–6.
26. Ljunggren B, Bojs G. A case of photosensitivity and contact allergy to systemic tricyclic drugs with unusual features. Contact Dermatitis 1991;24:259–65.
27. Luton EF, Finchum RN. Photosensitivity reaction to chlordiazepoxide. Arch Dermatol 1965;91:362–3.
28. Matsuo I, Ozawa A, Niizuma K, Ohkido M. Lichenoid dermatitis due to chlorpromazine phototoxicity. Dermatologica 1979;159:46–9.
29. Ming ME, Bhawan J, Stefanato CM, McCalmont TH, et al. Imipramine-induced hyperpigmentation: four cases and a review of the literature. J Am Acad Dermatol 1999;40:159–66.
30. Monteiro AF, Rato M, Martins C. Drug-induced photosensitivity: Photoallergic and phototoxic reactions. Clin Dermatol 2016;34:571–81.
31. Narurkar V, Smoller BR, Hu CH, Bauer EA. Desipramine-induced blue-gray photosensitive pigmentation. Arch Dermatol 1993;129:474–6.
32. Pace N. The etiology of hypericism, a photosensitivity produced by St. John’s wort. Am J Physiol 1942;136:650–6.
33. Pazzagli L, Banfi R, Borselli G, Semmola MV. Photosensitivity reaction to fluoxetine and alprazolam. Pharm World Sci 1998;20:136.
34. Raffle EJ, MacLeod TM, Hutchinson F, Ballinger B. Letter: Chlorpromazine photosensitivity. Arch Dermatol 1975;111:1364–5.
35. Ram-Wolf C, Mahe E, Saiag P. Escitalopram photo-induced erythroderma. J Eur Acad Dermatol Venereol 2008;22:1015–7.
36. Röhrborn W, Bräuninger W. Thioridazine photoallergy. Contact Dermatitis 1987;17:241.
37. Röhrs S, Geiser F, Conrad R. Citalopram-induced subacute cutaneous lupus erythematosus – first case and review concerning photosensitivity in selective serotonin reuptake inhibitors. Gen Hosp Psychiatry 2012;34:541–5.
38. Rote Liste. https://www.rote-liste.de/ (Zugriff am 15.01.2021).
39. Satanove A, McIntosh JS. Phototoxic reactions induced by high doses of chlorpromazine and thioridazine. JAMA 1967;200:209–12.
40. Schauder S. Photosensibilisierung: Risikovergleich von Johanniskrautextrakten gegenüber synthetischen Arzneistoffen. Zeitschrift für Phytotherapie 2006;27(S1):V26.
41. Selvaag E. Clinical drug photosensitivity. A retrospective analysis of reports to the Norwegian Adverse Drug Reactions Committee from the years 1970–1994. Photodermatol Photoimmunol Photomed 1997;13:21–3.
42. Terui T, Tagami H. Eczematous drug eruption from carbamazepine: coexistence of contact and photocontact sensitivity. Contact Dermatitis 1989;20:260–4.
43. Thami GP, Kaur S, Kanwar AJ. Delayed reactivation of haloperidol induced photosensitive dermatitis by methotrexate. Postgrad Med J 2002;78:116–7.
44. Trautmann A, Kleine-Tebbe J. Fotodermatosen. In: Trautmann A, Kleine-Tebbe J (Hrsg.). Allergologie in Klinik und Praxis. 3. Auflage. Stuttgart: Thieme, 2017: 256–64.
45. Vaccaro M, Borgia F, Barbuzza O, Guarneri B. Photodistributed eruptive telangiectasia: an uncommon adverse drug reaction to venlafaxine. Br J Dermatol 2007;157:822–4.
46. Walter-Ryan WG, Kern EE, Shirriff JR, Thomas JM. Persistent photoaggravated cutaneous eruption induced by imipramine. JAMA 1985;254:357–8.
47. Ward DJ. Carbamazepine-induced facial burns caused by a photocopier. Burns Incl Therm Inj 1987;13:322–4.
48. Williams K, Mansh M, Chin-Hong P, Singer J, et al. Voriconazole-associated cutaneous malignancy: a literature review on photocarcinogenesis in organ transplant recipients. Clin Infect Dis 2014;58:997–1002.
* Johannes Heck und Benjamin Krichevsky haben zu gleichen Teilen zur Erstellung dieses Manuskripts beigetragen
Dr. med. Johannes Heck, Institut für Klinische Pharmakologie, Medizinische Hochschule Hannover, Carl-Neuberg-Straße 1, 30625 Hannover, E-Mail: heck.johannes@mh-hannover.de
Benjamin Krichevsky, Institut für Allgemeinmedizin, Medizinische Hochschule Hannover, Hannover, und Sanitätsdienst der Bundeswehr, Kiel
Priv.-Doz. Dr. Olaf Krause, Institut für Allgemeinmedizin, Medizinische Hochschule Hannover, Carl-Neuberg-Straße 1, 30625 Hannover
Prof. Dr. med. Matthias Goebeler, Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum Würzburg, Josef-Schneider-Straße 2/Haus D8, 97080 Würzburg
Prof. Dr. med. Dirk O. Stichtenoth, Institut für Klinische Pharmakologie, Medizinische Hochschule Hannover, Carl-Neuberg-Straße 1, 30625 Hannover, und Arzneimittelbeauftragter der Medizinischen Hochschule Hannover
Prof. Dr. med. Stefan Bleich, Dr. med. Sermin Toto, Dr. med. Johanna Seifert, Klinik für Psychiatrie, Sozialpsychiatrie und Psychotherapie, Medizinische Hochschule Hannover, Carl-Neuberg-Straße 1, 30625 Hannover
Dr. med. Renate Grohmann, Klinik für Psychiatrie und Psychotherapie, Ludwig-Maximilians-Universität München, Nussbaumstraße 7, 80336 München
Dr. Dominik Dabbert, Klinik für Psychiatrie und Psychotherapie, Klinikum Bremen-Ost, Züricher Straße 40, 28325 Bremen
Photosensitization induced by psychotropic drugs and other medicines
More than 300 different drugs are known to increase the photosensitivity of the skin. Drug-induced photosensitization is responsible for up to 8 % of cutaneous adverse drug reactions and thus represents a common clinical problem. Pathophysiologically, drug-induced photodermatoses can be differentiated into phototoxic and photoallergic reactions. In this review, psychotropic drugs with photosensitizing properties are presented. These primarily include antipsychotics from the phenothiazine group, tricyclic antidepressants, several benzodiazepines, mood stabilizers, and St. John's wort. Photosensitizing drugs for the treatment of somatic diseases are mainly found among the anti-infectives, non-steroidal anti-inflammatory drugs, antihypertensives, diuretics, antiarrhythmics, and oncologics. Patients should be informed about appropriate sun protection measures. The most important therapeutic measure in the event of a photosensitivity reaction is discontinuation of the causative agent in combination with anti-allergic and/or analgesic treatment.
Key words: photosensitization, psychotropic drugs, adverse drug reaction, pharmacotherapy safety
Psychopharmakotherapie 2021; 28(03):94-101
