Michael Rösler, Homburg/Saar, Roland Fischer, Iserlohn, Claudia Ose, Essen, und Wolfgang Retz, Mainz
Die Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) ist eine psychische Erkrankung, die mit erheblichen persönlichen und sozialen Beeinträchtigungen verbunden ist [17]. Mit einer Prävalenz von 4 bis 7 % im Kindesalter [31] zählt sie zu den häufigsten kinder- und jugendpsychiatrischen Störungen, die sich bei bis zu 65 % der Betroffenen bis ins Erwachsenenalter fortsetzt [11]. In Deutschland leiden 4,7 % der Erwachsenen an ADHS [9], die als typische Symptome Unaufmerksamkeit, Desorganisation, Impulsivität, Unruhe, Ablenkbarkeit, Stimmungsschwankungen oder mangelndes Planungsvermögen zeigen [11, 12]. Zur Therapie der ADHS empfehlen aktuelle Leitlinien ein multimodales Behandlungskonzept, das psychosoziale und pharmakotherapeutische Interventionen beinhaltet [3, 22]. In der Pharmakotherapie wird das Psychostimulans Methylphenidat (MPH) als Medikament erster Wahl empfohlen [3], dessen Wirksamkeit nicht nur bei Kindern, sondern auch bei Erwachsenen mit ADHS in einer Vielzahl von randomisierten, Placebo-kontrollierten Studien (RCT) nachgewiesen werden konnte [5, 7, 19, 25, 27–30, 32].
Randomisierte kontrollierte Behandlungsstudien mit hohem Evidenzgrad und geringem Risiko für systematische Fehler stellen den Goldstandard zur Untersuchung von Effizienz und Verträglichkeit eines Medikaments dar [14]. Präzise Ein- und Ausschlusskriterien stellen dabei eine homogene Studienpopulation zur besseren Vergleichbarkeit bezüglich demographischer Merkmale, Krankheitszustand sowie Begleiterkrankungen und Begleitmedikation sicher [16]. Da jedoch ADHS-Patienten in der täglichen Praxis oftmals Komorbiditäten aufweisen oder Begleitmedikationen einnehmen [1], wird die Übertragbarkeit dieser Studienergebnisse auf die klinische Versorgungsrealität häufig infrage gestellt.
Nichtinterventionelle Studien (NIS) hingegen überprüfen nichtselektiv die Wirksamkeit und Sicherheit eines Medikaments an einer sehr heterogenen Patientengruppe und erlauben so eine Bewertung unter realen Bedingungen, wie sie im Praxisalltag anzutreffen sind [26]. Aufgrund einer meist großen Patientenkohorte können auch seltene Nebenwirkungen erfasst werden. Bislang liegen jedoch nur wenige Daten zur Wirksamkeit und Verträglichkeit von MPH bei der Behandlung erwachsener ADHS-Patienten im Rahmen einer NIS vor.
Somit war es Ziel dieser NIS, weitere Erkenntnisse zur Anwendung, Wirksamkeit und Verträglichkeit von MPH bei Erwachsenen mit neu diagnostizierter ADHS unter Bedingungen der routinemäßigen Anwendung zu sammeln. Medikinet® adult mit dem modifiziert freigesetzten Wirkstoff MPH ist das erste in Deutschland zugelassene Arzneimittel zur Behandlung der ADHS bei Erwachsenen, dessen Wirksamkeit in den klinischen RCTs EMMA und QUMEA bereits belegt werden konnte [25, 27]. In der vorliegenden multizentrischen Kohortenstudie sollte nun in einer größeren und heterogenen Studienpopulation überprüft werden, inwieweit MPH Einfluss auf die ADHS-Symptomatik (Hyperaktivität, Impulsivität und Unaufmerksamkeit), aber auch auf emotionale Faktoren wie Stressempfinden und Stimmungsschwankungen hat.
Patienten und Methoden
Studiendesign
Es handelte sich um eine prospektive, nichtinterventionelle Studie gemäß § 4 Absatz 23 Satz 3 Arzneimittelgesetz (AMG), für deren Durchführung ein positives Votum der Ethik-Kommission bei der Ärztekammer des Saarlandes vorliegt. Eingeschlossen wurden Patienten mit neu diagnostizierter ADHS, die gemäß Therapieentscheidung des behandelnden Arztes für eine Therapie mit MPH infrage kamen. Als Grundlage zur Validierung der Diagnose ADHS gemäß DSM-IV wurde neben dem Screeningtest mit der Selbstbeurteilungsskala ASRS-V1.1 ein standardisiertes Interview (IDA, Integrierte Diagnose der ADHS im Erwachsenenalter) durchgeführt [18, 24].
Die Anwendung von MPH erfolgte im Rahmen der zugelassenen Indikation und entsprechend der Fachinformation [21], wobei die Patienten mittels sorgfältiger Dosistitration auf MPH eingestellt wurden. Die Beobachtungsdauer lag bei 12 bis 14 Wochen (Mittelwert 3,3 ± 1,6 Monate), mit einer Aufnahmeuntersuchung zu Beginn (Visite 1) und einer Abschlussuntersuchung (Visite 2) zum Ende des Beobachtungszeitraums. Erfasst wurden Vitalparameter, Ausprägung der ADHS-Kernsymptome sowie ADHS-assoziierter Symptombereiche (emotionale Dysregulation, Desorganisation, soziale Anpassung) mittels Wender-Reimherr-Selbstbeurteilung (WR-SB, Visite 1 und 2). Zusätzlich wurden Daten zur Anamnese, Diagnose und Therapie (Visite 1) sowie zur Zustandsänderung mittels der Skala für den Klinischen Gesamteindruck (CGI, Clinical Global Impression), Dosierung und Verträglichkeit (Visite 2) erhoben.
Primäres Zielkriterium war die Wirksamkeit bezüglich der klinischen Gesamteinschätzung (CGI) durch den Arzt. Sekundäre Zielkriterien waren die Patientenbeurteilung (WR-SB) sowie die Unbedenklichkeit, Verträglichkeit und Dosierung von MPH.
Untersuchungen zur Wirksamkeit
Die Wirksamkeit der Behandlung mit MPH wurde mittels CGI beurteilt, wobei die Einstufungen anhand der jeweils 7-stufigen Skalen „Skala der Symptomschwere“ (CGI-S, 1 = nicht krank, 7 = schwer krank), und „Skala der Symptomverbesserung“ (CGI-I, 1 = starke Verbesserung, 4 = keine Verbesserung, 7 = starke Verschlechterung) erfolgten.
Als primäres Maß der Wirksamkeit laut Patientenurteil diente der Wender-Reimherr-Selbstbeurteilungsfragebogen (WR-SB) [23], der in einer 5-Punkteskala neben den klassischen Kriterien Unaufmerksamkeit, Hyperaktivität und Impulsivität auch erwachsenentypische Symptome wie Desorganisation und emotionale Dysregulation sowie soziale Anpassungsprobleme berücksichtigt. Die Skala umfasst insgesamt 53 Items, mit denen 10 Merkmalsbereiche abgebildet werden. Alle Items sind auf einer 5-stufigen Likert-Skala von 1 („trifft überhaupt nicht auf mich zu“) bis 5 („trifft sehr gut auf mich zu“) zu bewerten, sodass Werte zwischen 53 (geringe Gesamtbeeinträchtigung) und 265 Punkten (hohe Gesamtbeeinträchtigung) erreicht werden können.
Als Responder wurden Patienten definiert, die eine sehr gute bis gute Verbesserung im CGI (CGI-I Stufe ≤ 2) oder eine Verringerung im WR-SB um ≥ 30 % erzielten.
Untersuchungen zur Sicherheit
Sicherheitsendpunkte waren Vitalfunktionen und die allgemeine Verträglichkeit. Bei beiden Visiten sowie nach Änderung der Dosierung von MPH wurden die Vitalparameter der Patienten (Blutdruck, Herzfrequenz, Gewicht, BMI sowie Appetit) dokumentiert. Zusätzlich wurden Alter, Geschlecht, Typ der ADHS, Begleiterkrankungen, Begleitmedikation und Therapiebeginn mit MPH erfasst. Alle während der Kohortenstudie auftretenden unerwünschten Arzneimittelwirkungen/Ereignisse (UAW/UE) sowie Verdachtsfälle von UAW/UE wurden in UE-Bögen dokumentiert und im schwerwiegenden Fall unmittelbar gemeldet.
Statistische Methoden und Auswertung
Die deskriptive Datenanalyse umfasste absolute, relative und adjustierte relative Häufigkeiten, Mehrfachangaben, Kreuztabellen, Mittelwertbildung mit Berechnung der Standardabweichung, des Medians und des größten und kleinsten Wertes. Der Wilcoxon-Vorzeichen-Rang-Test wurde zur inferenzstatistischen Prüfung der Veränderungen des Gesamt-Scores und der Subscores der WR-SB benutzt. Die statistische Auswertung erfolgte mittels des Programmsystems SASTM Version 9.4 auf einem PC unter Windows 7TM. Vor- und Begleitmedikationen wurden entsprechend WHO-ATC zusammengefasst. UAW/UE sowie Vor- und Begleiterkrankungen wurden entsprechend MedDRA Version 17.0 kodiert.
Ergebnisse
Patientencharakteristika
468 erwachsene ADHS-Patienten aus 126 Beobachtungszentren wurden durchschnittlich 3,3 Monate beobachtet. Das Alter der Patienten (davon 57,9 % männlich) betrug durchschnittlich 32,4 (± 10,8) Jahre, wobei der jüngste Patient 18, der älteste 71 Jahre alt war.
Am häufigsten diagnostizierten Ärzte eine kombinierte ADHS (209 Patienten, 44,7 %), des Weiteren bei 162 Patienten (34,6 %) ADHS vom unaufmerksamen Typ und bei 43 Patienten (9,2 %) ADHS vom hyperaktiv-impulsiven Typ. Begleiterkrankungen traten bei 52,6 % des Patientenkollektivs (246 Patienten) auf. Häufig litten die Patienten an psychiatrischen Erkrankungen (197 Patienten, 42,1 %), mit Depression als häufigste Komorbidität (129 Patienten, 27,6 %) (Tab. 1).
Tab. 1. Patientencharakteristika
|
Merkmal |
Anzahl der Patienten |
||
|
absolut |
in % |
||
|
Geschlecht (n = 468) |
Männlich |
271 |
57,9 |
|
Weiblich |
197 |
42,1 |
|
|
Alter (n = 462) |
Mittelwert |
32,49 Jahre |
|
|
Min–Max |
18–71 Jahre |
||
|
BMI (n = 460) |
Mittelwert |
24,95 kg/m2 |
|
|
Diagnose |
ADHS im Kindesalter |
11 |
2,4 |
|
Kombinierte ADHS |
209 |
44,7 |
|
|
ADHS – unaufmerksamer Typ |
162 |
34,6 |
|
|
ADHS – hyperaktiv-impulsiver Typ |
43 |
9,2 |
|
|
Keine Diagnose |
43 |
9,2 |
|
|
Begleiterkrankungen (n = 468, Inzidenz > 1,9 %) |
Gesamt |
246 |
52,6 |
|
Depression |
129 |
27,6 |
|
|
Angst |
17 |
3,6 |
|
|
Persönlichkeitsstörung |
15 |
3,2 |
|
|
Anpassungsstörung |
11 |
2,4 |
|
|
Soziale Phobie |
11 |
2,4 |
|
|
Hypothyreose |
10 |
2,1 |
|
|
Drogenmissbrauch |
9 |
1,9 |
|
|
Hypertonie |
9 |
1,9 |
|
|
Begleitmedikation |
Gesamt |
165 |
35,3 |
|
Antidepressiva |
113 |
24,2 |
|
|
Neuroleptika |
24 |
5,1 |
|
|
Schilddrüsentherapie |
16 |
3,4 |
|
|
Antiepileptika |
9 |
1,9 |
|
|
Mittel bei obstruktiven Atemwegserkrankungen |
8 |
1,7 |
|
|
Andere Mittel für das Nervensystem |
7 |
1,5 |
|
Begleitend wurden an Psychopharmaka vor allem Antidepressiva (113 Patienten, 24,2 %) und Neuroleptika (24 Patienten, 5,1 %) verordnet, im somatischen Bereich waren Schilddrüsentherapeutika (16 Patienten, 3,4 %) die am häufigsten verordneten Medikamente (Tab. 1). Insgesamt erhielten 165 Patienten (35,4 %) während der Studie eine medikamentöse Begleittherapie, bei 21,8 % der Kohorte (102 Patienten) wurden psychosoziale Begleittherapien durchgeführt.
Dosis
Insgesamt lagen von 411 Patienten Angaben zur ersten sowie zur letzten MPH-Dosis vor. Der Mittelwert für die erste Dosierung lag bei 18,4 (± 12,7, Median 10,0) mg/Tag und bei der letzten Gabe zu Beobachtungsende bei 35,8 (± 17,0, Median 40,0) mg/Tag. Zu beiden Zeitpunkten betrug die Minimaldosis 5,0 mg/Tag, die Maximaldosis 80,0 mg/Tag.
Wirksamkeit laut Arzt- und Patientenurteil
Zu Beginn der Untersuchung wurde der Schweregrad der Erkrankung gemäß CGI-S bei 62 Patienten (14,2 %) als extrem schwer oder schwer eingestuft (Abb. 1). 227 Patienten (52,1 %) waren nach dem Urteil des Arztes deutlich, 117 (26,8 %) mäßig und 25 (5,7 %) leicht krank. Bei Abschluss der Untersuchung war der Anteil der extrem schwer oder schwer Erkrankten um 64 %, der Anteil der deutlich kranken Patienten um 61 % reduziert. Somit verbesserte sich laut Arzturteil der Schweregrad der Erkrankung von der Aufnahme- zur Abschlussuntersuchung.
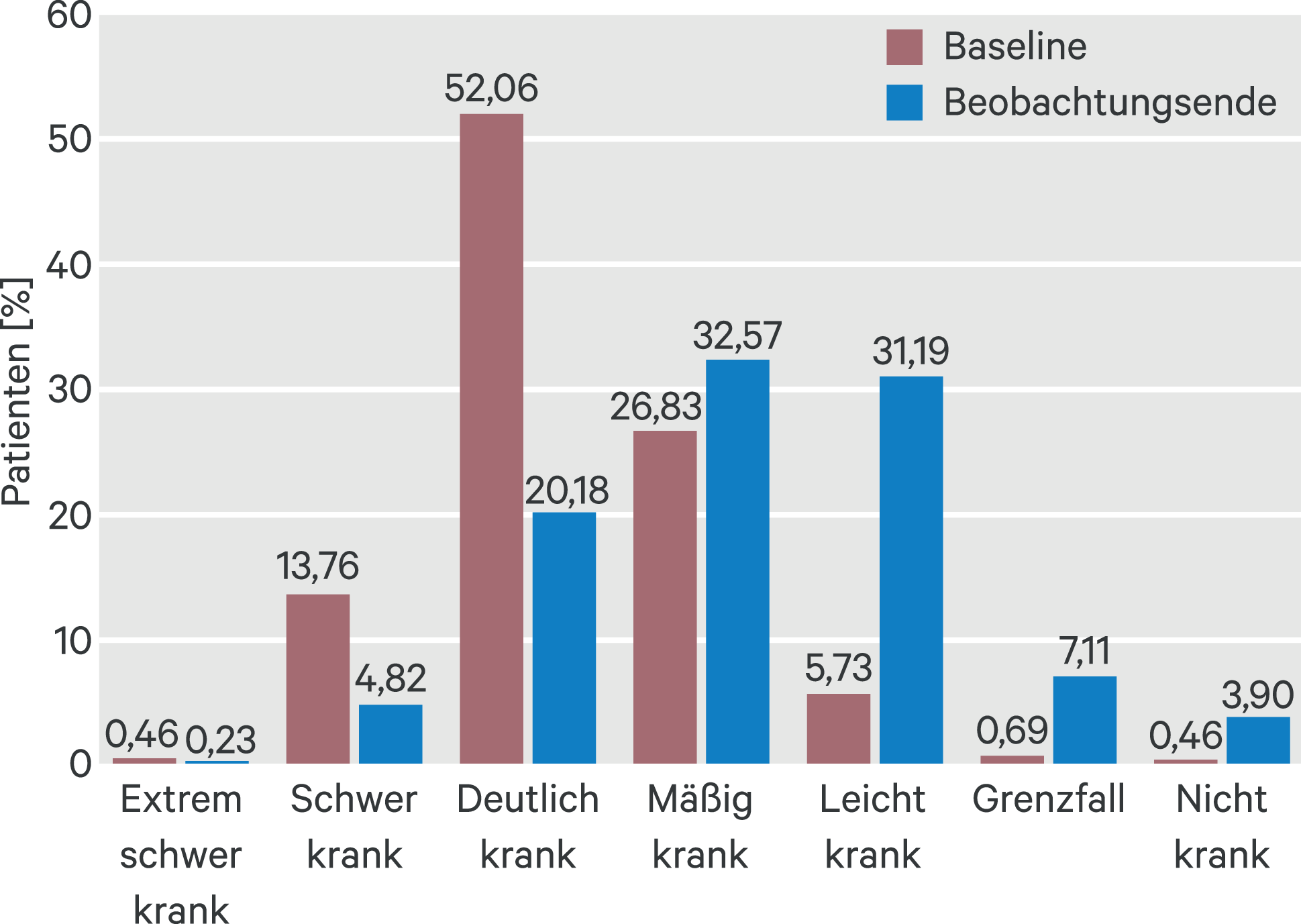
Abb. 1. Schweregrad der Erkrankung laut Arzturteil (CGI Severity Scale). Patienten wurden zu Beobachtungsbeginn (Baseline) und -ende in 7 Schweregrade (nicht krank bis extrem schwer krank) eingestuft. Dargestellt ist der jeweilige Anteil der Patienten in %. Laut Arzturteil verbesserte sich der Schweregrad der Erkrankung von der Aufnahme- zur Abschlussuntersuchung.
Laut Gesamteinschätzung der Ärzte mittels CGI-I konnten 74,5 % der Patientenkohorte (318 Patienten) als Responder eingestuft werden, wovon 83 Patienten (19,4 %) nach Behandlung in einem sehr viel besseren und 235 (55,0 %) in einem besseren Zustand waren (Abb. 2). Ein nur wenig verbesserter Zustand wurde bei 82 Patienten (19,2 %) registriert, während die Erkrankung bei 26 Patienten (6,1 %) unverändert und bei einem Patienten (0,23 %) verschlechtert war.
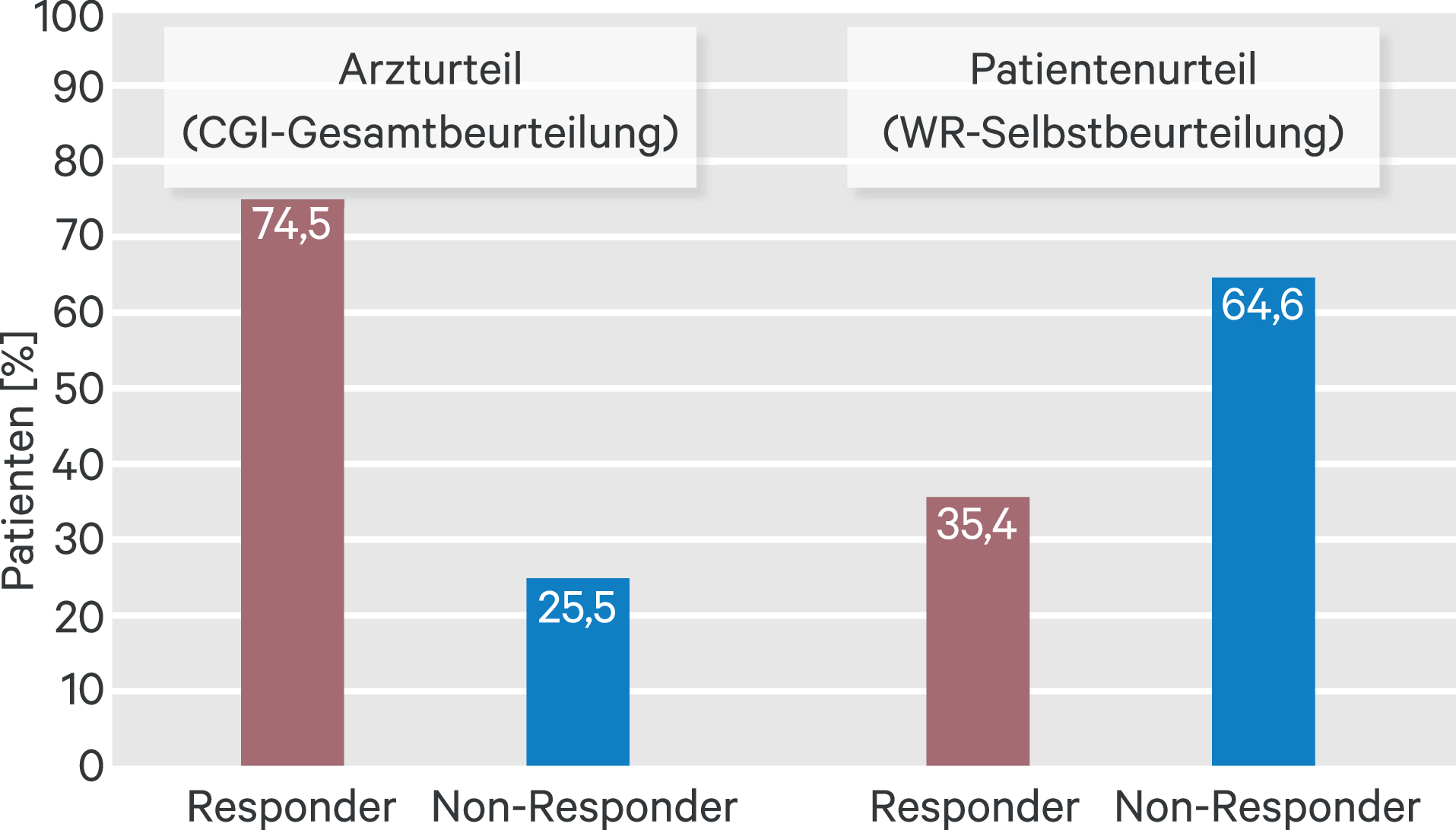
Abb. 2. Responder gemäß Arzt- und Patientenurteil. Dargestellt ist der Anteil der Patienten in %, die laut Ärztebeurteilung (mittels CGI) oder Patienten-Selbstbeurteilung (mittels WR-SB) als Therapie-Responder eingestuft wurden. Ärzte stuften einen größeren Anteil der Patienten als Responder ein im Vergleich zum Patientenurteil (75 % vs. 35 %).
Die therapeutische Wirksamkeit (CGI-Wirksamkeitsindex) wurde bei 171 Patienten (40,9 %) als sehr gut (umfassende Besserung, vollständige oder fast vollständige Remission aller Symptome), bei 176 (42,1 %) als mäßig (deutliche Besserung, teilweise Remission der Symptome), bei 60 (14,3 %) als gering (leichte Besserung, eine weitere Behandlung des Patienten ist dennoch nötig) und bei 11 Patienten (2,6 %) als unverändert oder schlechter eingestuft (Tab. 2).
Tab. 2. Wirksamkeitsindex. Dargestellt ist die therapeutische Wirksamkeit (sehr gut, mäßig, gering, unverändert/schlechter) im Verhältnis zu den unerwünschten Wirkungen (keine, nicht wesentlich, wesentlich, überwiegend) mit jeweils absoluten und relativen Patientenzahlen [4].
|
Therapeutische |
Unerwünschte Wirkungen |
|||||||||
|
Keine |
Nicht wesentlich |
Wesentlich |
Überwiegend |
Total |
||||||
|
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
|
|
Sehr gut |
156 |
37,32 |
14 |
3,35 |
1 |
0,24 |
0 |
0 |
171 |
40,91 |
|
Mäßig |
157 |
37,56 |
14 |
3,35 |
4 |
0,96 |
1 |
0,24 |
176 |
42,11 |
|
Gering |
52 |
12,44 |
6 |
1,44 |
1 |
0,24 |
1 |
0,24 |
60 |
14,35 |
|
Unverändert/schlechter |
8 |
1,91 |
0 |
0 |
3 |
0,72 |
0 |
0 |
11 |
2,63 |
|
Total |
373 |
89,23 |
34 |
8,13 |
9 |
2,15 |
2 |
0,48 |
418 |
100 |
Auch in der Patientenbeurteilung (WR-SB) zeigte sich eine statistisch signifikante (p < 0,001) Verbesserung der untersuchten Subscores von der Ausgangsuntersuchung bis zum Beobachtungsende (Abb. 3). So verringerte sich während der MPH-Therapie der Mittelwert des WR-SB-Gesamt-Scores um 50,1 (± 40,3) Punkte von 203,4 (± 37,6) Punkte auf 153,4 (± 40,2) Punkte. Die mittlere prozentuale Reduktion der Gesamtsumme lag dabei bei 23,5 % und wies auf eine Verbesserung der Symptomintensität der Erwachsenen-ADHS hin.
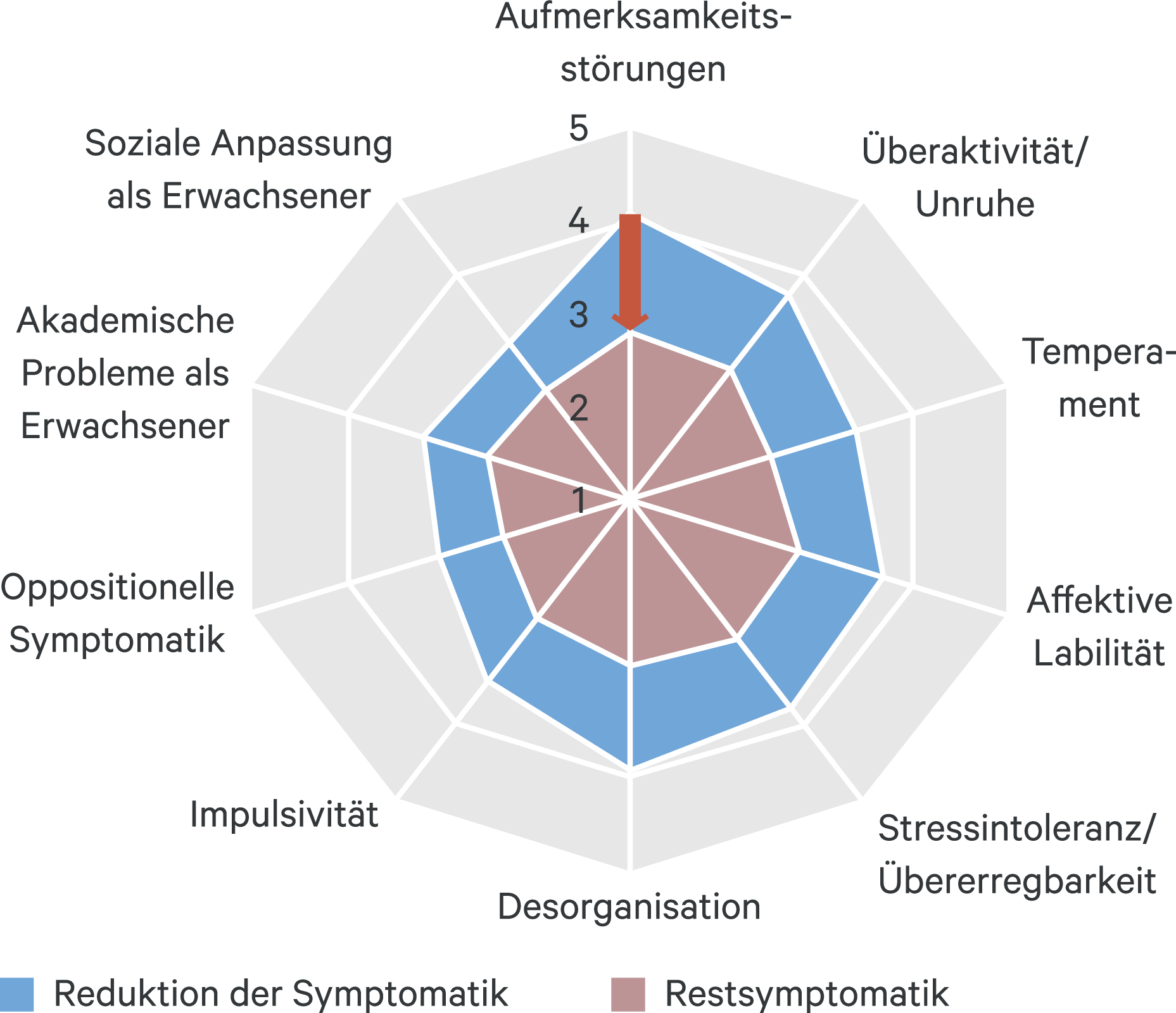
Abb. 3. Reduktion der Symptomatik unter Behandlung laut Patientenbeurteilung (WR-SB). Zehn Merkmalsbereiche wurden bei Beginn der Behandlung (blau) sowie die Restsymptomatik zu Behandlungsende (rot) mittels der 5-stufigen Likert-Skala von 1 („trifft überhaupt nicht auf mich zu“) bis 5 („trifft sehr gut auf mich zu“) bewertet (dargestellt sind jeweils die Mittelwerte). Unter MPH-Therapie zeigte sich eine signifikante Verbesserung der untersuchten Subscores und somit eine Verbesserung der Symptomintensität bei Erwachsenen mit ADHS.
Laut Patientenurteil waren 146 Patienten (35,4 %) Responder (Abb. 2). Die multivariate Analyse zeigte, dass das Ausmaß der Symptomreduktion wesentlich durch die Schwere der Erkrankung bei Untersuchungsbeginn bestimmt wurde. So war die Anzahl der Patienten, die als Responder eingestuft werden konnte, deutlich höher bei Patienten mit schweren oder sehr schweren Symptomen (Responderrate 50,8 %). Die größten signifikanten Verringerungen traten bei den Merkmalen Aufmerksamkeitsstörungen (–30,0 %), Desorganisation (–26,6 %), Überaktivität/Unruhe (–23,3 %) und Stressintoleranz/Übererregbarkeit (–23,0 %) auf.
Sicherheit – UE und Vitalwerte
Bei 417 Patienten (89,1 %) wurden keine unerwünschten Ereignisse (UE) dokumentiert. Bei 51 Patienten (10,9 %) wurden insgesamt 100 UE dokumentiert (zumeist ein bis zwei Ereignisse pro Patient). Am häufigsten traten verminderter Appetit und Kopfschmerz (bei jeweils 8 Patienten, 1,7 %), Unruhe (bei 5 Patienten, 1,1 %) sowie Ermüdung und Übelkeit (bei jeweils 4 Patienten, 0,9 %) auf (Tab. 3). Bei einem Patienten (0,23 %) wurde ein schwerwiegendes Ereignis (Polytoxikomanie-Rückfall) dokumentiert, wobei jedoch ein Zusammenhang mit der MPH-Behandlung als unwahrscheinlich erachtet wurde.
Tab. 3. Unerwünschte Ereignisse. Dargestellt sind Anzahl, Art und Häufigkeit der aufgetretenen unerwünschten Ereignisse mit absoluten und relativen Häufigkeiten.
|
Anzahl der UE |
Patienten |
|
|
Unerwünschte Ereignisse (UE) |
||
|
Keine UE |
0 |
417 (89,1 %) |
|
UE |
100 |
51 (10,9 %) |
|
Nicht-schwerwiegende UE |
99 |
50 (98,04 %) |
|
Schwerwiegende UE |
1 |
1 (1,96 %) |
|
Tödliche schwerwiegende UE |
0 |
0 |
|
Art der UE (MedDRA 17.0) n = 468, Inzidenz > 0,3 % |
||
|
Appetit vermindert |
8 (1,71 %) |
|
|
Kopfschmerz |
8 (1,71 %) |
|
|
Unruhe |
5 (1,07 %) |
|
|
Ermüdung |
4 (0,85 %) |
|
|
Übelkeit |
4 (0,85 %) |
|
|
Diarrhö |
3 (0,64 %) |
|
|
Hypertonie |
3 (0,64 %) |
|
|
Palpitationen |
3 (0,64 %) |
|
|
Schwindelgefühl |
3 (0,64 %) |
|
|
Dyssomnie |
2 (0,43 %) |
|
|
Herzfrequenz erhöht |
2 (0,43 %) |
|
|
Hyperhidrosis |
2 (0,43 %) |
|
|
Mundtrockenheit |
2 (0,43 %) |
|
|
Schmerzen Oberbauch |
2 (0,43 %) |
|
|
Tachykardie |
2 (0,43 %) |
|
Blutdruckmessungen zu Untersuchungsbeginn zeigten bei 68 Patienten (17,4 %) einen normalen Blutdruck, bei 240 Patienten (61,5 %) eine Prähypertonie, und bei 82 Patienten (21,0 %) eine Stadium 1 oder 2 Hypertonie (Einteilung gemäß JNC7-Schema [8]). Durchschnittlich lag der Blutdruck bei 124,3/78,9 (± 12,1/9,5) mm Hg. Eine Erhöhung von 1,1/0,5 (± 10,2/9,3) mm Hg am Ende der Behandlung war als medizinisch nicht bedeutsam anzusehen. Ebenso waren die geringen Veränderungen in der Herzfrequenz (73,2 [± 9,6] Schläge/min bei Visite 1 und 75,3 [± 9,9] Schläge/min bei Visite 2) sowie die Reduktion im BMI von 25,1 (± 4,7) kg/m2 auf 25,0 (± 5,5) kg/m2 medizinisch nicht relevant. Lediglich ein größerer Teil der Patienten äußerte, weniger Hunger zu haben.
Somit erwies sich MPH bei erwachsenen Patienten mit ADHS unter Praxisbedingungen als wirksamer und sicherer Wirkstoff.
Diskussion
ADHS ist im Erwachsenenalter oft mit weiteren psychischen Beeinträchtigungen wie Depressionen und Angststörungen assoziiert, erhöht unbehandelt das Risiko für Suchtmittelmissbrauch und führt oft zu zwischenmenschlichen und beruflichen Problemen [10]. Im Vergleich zu Kindern sind die therapeutischen Behandlungsmöglichkeiten für Erwachsene mit ADHS in Deutschland begrenzt. Seit dem 15. April 2011 ist Medikinet® adult in Deutschland als erstes Arzneimittel zur Behandlung der ADHS im Erwachsenenalter zugelassen [4]. Zwischenzeitlich sind noch weitere Methylphenidat-Präparate für die Behandlung von Erwachsenen mit ADHS verfügbar, ebenso der Noradrenalin-Wiederaufnahmehemmer Atomoxetin.
Die Wirksamkeit und Sicherheit von MPH bei erwachsenen ADHS Patienten ist in den zwei randomisierten, doppelblinden, Placebo-kontrollierten klinischen Studien EMMA [27] und QUMEA [25] bestätigt worden. Während in diesen kontrollierten Studien Patienten mit komorbiden psychiatrischen Störungen oder Begleitmedikation weitgehend ausgeschlossen waren, wurden in der vorliegenden Beobachtungsstudie auch Patienten mit psychischen Begleiterkrankungen und Einnahme diverser Psychopharmaka behandelt. Über die Hälfte aller Patienten (52,6 %) litten an für ADHS typischen Begleiterkrankungen. Dementsprechend wurde gut einem Drittel der Patienten (35,3 %) eine Begleitmedikation verschrieben. Die für diese Kohortenstudie über das gesamte Bundesgebiet rekrutierte Patientenpopulation spiegelt somit eine repräsentative Klientel für die Behandlung erwachsener ADHS Patienten mit MPH unter realen Praxisbedingungen wider.
Die Einnahme von MPH zeigte keine klinisch relevanten Auswirkungen auf Blutdruck, Herzfrequenz und Körpergewicht. Die geringen beobachteten Differenzen konnten – wie auch in den vorherigen RCTs – als medizinisch nicht relevant angesehen werden [25, 27]. Von den 100 im Beobachtungszeitraum aufgetretenen UE waren 99 nicht schwerwiegend und alle aufgetretenen UAW wurden bereits in der Fachinformation beschrieben [21]. Lediglich 6 Patienten schieden wegen des Auftretens unerwünschter Ereignisse aus der Studie aus. Im Vergleich dazu wurden in der QUMEA Studie mehr UE (151 UE bei 55 Patienten) registriert, in der EMMA-Studie mit einem Patientenkollektiv von 363 Patienten beendeten 31 Patienten die Studie wegen des Auftretens unerwünschter Ereignisse [25, 27]. Somit ist die Anzahl unerwünschter Ereignisse sowie die Anzahl an Patienten, die die Therapie vorzeitig abschlossen, bezogen auf das Gesamtpatientenkollektiv dieser Studie als gering und die Anwendung von MPH auch unter Routinebedingungen als verträglich und sicher anzusehen.
Eine aktuelle Studie zur Verordnungshäufigkeit von ADHS-Medikamenten zeigte, dass in der täglichen Praxis MPH in fast allen Altersgruppen die meistverordnete Substanz war, was den Leitlinienempfehlungen und der Zulassungssituation in Deutschland entspricht [2]. Auch andere Studien belegen den positiven Einfluss der MPH-Behandlung auf verschiedene Parameter: So reduziert MPH die Reaktivität in den Amygdalae und stellt somit eine vielversprechende Medikation zur Kontrolle der emotionalen Dysregulation dar, die als Teil des limbischen Systems eine wichtige Rolle bei der emotionalen Bewertung spielt [6]. Auch erzielt eine MPH-Behandlung eine verbesserte Gedächtnisfunktion, wenn auch die Gedächtnisleistung nicht vollständig normalisiert werden kann und zusätzlich psychotherapeutische Maßnahmen erfordert [13]. Des Weiteren ist die Einnahme von MPH mit einer signifikanten Linderung der ADHS-Symptomatik assoziiert, die mit einer Verbesserung im Verrichten täglicher Arbeiten und gesundheitsbezogener Lebensqualität einhergeht [28].
Auch in dieser Studie lag ein Fokus auf den Veränderungen der ADHS-Symptomatik inklusive sozialer Aspekte durch Einnahme von MPH. Laut Ärztebeurteilungen (CGI-Skala) war bei 74,5 % der Fälle der Zustand nach der MPH-Behandlung sehr viel oder viel besser, womit die Zustandsveränderung sogar stärker eingeschätzt wurde als in den klinischen Studien (50 % bei QUMEA, 61 % bei EMMA).
Die ärztlich bescheinigte therapeutische Wirksamkeit in Relation zu unerwünschten Wirkungen wurde unter realen Bedingungen bei 40,9 % der Patienten am Ende der Behandlung als sehr gut angegeben und war im Vergleich zur EMMA Studie (60,1 %) geringer. Dennoch hatten 89 % der Patienten nach Ende dieser Studie die Therapie fortgesetzt, was darauf schließen lässt, dass die aufgetretenen unerwünschten Wirkungen die Patienten nicht wesentlich beeinträchtigten.
Neben der Einschätzung des Arztes beurteilten auch die Patienten ihren Zustand vor und nach Behandlung, wobei auch soziale Faktoren wie zwischenmenschliche Probleme mit Arbeitgebern, Kollegen, Kindern und Partnern bewertet wurden. Hierbei handelt es sich um Begleitaspekte der ADHS, die für die Alltagsfunktionen und Lebensqualität von ADHS-Patienten von hoher Relevanz sind [15, 20]. Eine Behandlung mit MPH konnte Aspekte der sozialen Anpassung im Rahmen der Studienbehandlung deutlich verbessern. Zudem fand sich eine deutliche subjektive Verbesserung der Symptombelastung um 23,5 %. Allerdings schätzten sich nur 35,4 % der Patienten im Selbsturteil als Therapie-Responder ein. Eine im Vergleich zu Ärzten schlechter beurteilte therapeutische Response ist in der Praxis häufig anzutreffen. Zu bedenken ist, dass die Patienten in der vorliegenden NIS mit einer relativ geringen durchschnittlichen Tagesdosis von 35,8 mg MPH behandelt wurden. Aufgrund der für MPH beschriebenen Dosis-Wirkungs-Beziehung [30] spricht dies dafür, dass in der Praxis das therapeutische Potenzial von MPH nicht ausgeschöpft wird.
Diese Studie ist limitiert durch ihr nichtinterventionelles Design, das keine Rückschlüsse auf Kausalzusammenhänge zulässt. Dennoch gewährleistet die hier eingeschlossene Patientenanzahl statistisch relevante Ergebnisse und spiegelt einen umfassenden Querschnitt der klinischen Versorgungsrealität wider.
Schlussfolgerung
Auch unter Routinebedingungen verbessert sich der Schweregrad der ADHS-Erkrankung bei der Behandlung mit MPH. Diese Beobachtungsstudie konnte somit die bereits in den RCTs EMMA und QUMEA gezeigte positive Wirkung sowie die Sicherheit von MPH für die Behandlung Erwachsener mit ADHS in der täglichen Praxis bestätigen. Zusätzlich ergaben sich Hinweise, dass sich unter der Behandlung mit MPH unter Praxisbedingungen auch positive Veränderungen der Alltagsfunktionen erzielen lassen. Die geringere Responserate nach dem Patientenurteil sowie die deutlich niedrigere eingesetzte Tagesdosis unter Routinebedingungen von 40 mg/Tag im Median könnten ein Hinweis darauf sein, dass in Deutschland im Praxisalltag die Dosistitration zu früh beendet wird und nur suboptimale Tagesdosen für den individuellen Patienten erreicht werden. Eine noch sorgfältigere Titration könnte den auch mit niedriger Dosierung bereits nachgewiesenen hohen Nutzen von MPH im Praxisalltag weiter erhöhen.
Danksagung
Die sprachliche Bearbeitung des Manuskripts wurde unterstützt von Dr. Katrin Blumbach (med:unit GmbH, Köln).
Interessenkonflikterklärung
MR: Honorare für Beratung, Vorträge, Stellungnahmen und/oder Artikel von Medice
RF: Angestellter von Medice (Medizinischer Leiter des Prüfpräparats)
CO: Honorare für Vorträge (Poster), Unterstützung für Kongressbesuch und Forschungsbeihilfe (Drittmittel) für die Klinik von Medice
WR: Honorare für Beratung, Vorträge, Stellungnahmen und/oder Artikel sowie Forschungsbeihilfe (Drittmittel) für die Klinik von Medice
Literatur
1. Adler LA. Epidemiology, impairments, and differential diagnosis in adult ADHD: introduction. CNS Spectr 2008;13:4–5.
2. Bachmann CJ, Philipsen A, Hoffmann F. ADHD in Germany: Trends in Diagnosis and Pharmacotherapy. Dtsch Arztebl Int 2017;114:141–8.
3. Banaschewski T, Becker K, Döpfner M, Holtmann M, et al. Attention-Deficit/Hyperactivity Disorder. Dtsch Arztebl Int 2017;114:149–59.
4. BfArM. Öffentlicher Bewertungsbericht MEDIKINET ADULT, 2011. https://portal.dimdi.de/amispb/doc/2011/07/25/2163890/OBFMBD5B836E01C
C4AAA.rtf (Zugriff am 05.03.2019).
5. Biederman J, Mick E, Surman C, Doyle R, et al. A randomized, placebo-controlled trial of OROS methylphenidate in adults with attention-deficit/hyperactivity disorder. Biol Psychiatry 2006;59:829–35.
6. Bottelier MA, Schrantee A, Ferguson B, Tamminga HGH, et al. Age-dependent effects of acute methylphenidate on amygdala reactivity in stimulant treatment-naive patients with attention deficit/hyperactivity disorder. Psychiatry Res Neuroimaging 2017;269:36–42.
7. Bouffard R, Hechtman L, Minde K, Iaboni-Kassab F. The efficacy of 2 different dosages of methylphenidate in treating adults with attention-deficit hyperactivity disorder. Can J Psychiatry 2003;48:546–54.
8. Chobanian AV, Bakris GL, Black HR, Cushman WC, et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003;289:2560–72.
9. de Zwaan M, Gruss B, Müller A, Graap H, et al. The estimated prevalence and correlates of adult ADHD in a German community sample. Eur Arch Psychiatry Clin Neurosci 2012;262:79–86.
10. Erskine HE, Norman RE, Ferrari AJ, Chan GC, et al. Long-Term Outcomes of Attention-Deficit/Hyperactivity Disorder and Conduct Disorder: A Systematic Review and Meta-Analysis. J Am Acad Child Adolesc Psychiatry 2016;55:841–50.
11. Faraone SV, Biederman J, Mick E. The age-dependent decline of attention deficit hyperactivity disorder: a meta-analysis of follow-up studies. Psychol Med 2006;36:159–65.
12. Fields SA, Johnson WM, Hassig MB. Adult ADHD: Addressing a unique set of challenges. J Fam Pract 2017;66:68–74.
13. Fuermaier AB, Tucha L, Koerts J, Weisbrod M, et al. Effects of methylphenidate on memory functions of adults with ADHD. Appl Neuropsychol Adult 2017;24:199–211.
14. Harbour R, Miller J. A new system for grading recommendations in evidence based guidelines. BMJ 2001;323:334–6.
15. Harpin VA. The effect of ADHD on the life of an individual, their family, and community from preschool to adult life. Arch Dis Child 2005;90 Suppl 1:i2–7.
16. Kabisch M, Ruckes C, Seibert-Grafe M, Blettner M. Randomisierte kontrollierte Studien. Teil 17 der Serie zur Bewertung wissenschaftlicher Publikationen. Dtsch Arztebl Int 2011;108:663–8.
17. Katzman MA, Bilkey TS, Chokka PR, Fallu A, Klassen LJ. Adult ADHD and comorbid disorders: clinical implications of a dimensional approach. BMC Psychiatry 2017;17:302.
18. Kessler RC, Adler LA, Gruber MJ, Sarawate CA, et al. Validity of the World Health Organization Adult ADHD Self-Report Scale (ASRS) Screener in a representative sample of health plan members. Int J Methods Psychiatr Res 2007;16:52–65.
19. Kooij JJ, Burger H, Boonstra AM, Van der Linden PD, et al. Efficacy and safety of methylphenidate in 45 adults with attention-deficit/hyperactivity disorder. A randomized placebo-controlled double-blind cross-over trial. Psychol Med 2004;34:973–82.
20. Mannuzza S, Klein RG, Bessler A, Malloy P, LaPadula M. Adult outcome of hyperactive boys. Educational achievement, occupational rank, and psychiatric status. Arch Gen Psychiatry 1993;50:565–76.
21. Medice. Fachinformation Medikinet adult. Stand Januar 2017.
22. National Institute for Health and Care Excellence (NICE). Attention deficit hyperactivity disorder: diagnosis and management. NICE guideline [NG87]. https://www.nice.org.uk/guidance/ng87 (Zugriff am 05.03.2019).
23. Retz-Junginger P, Giesen L, Philipp-Wiegmann F, Rösler M, Retz W. Der Wender-Reimherr-Selbstbeurteilungsfragebogen zur adulten ADHS. Nervenarzt 2017;88:797–801.
24. Retz W, Retz-Junginger P, Römer K, Rösler M. Standardisierte Skalen zur strukturierten Diagnostik der ADHS im Erwachsenenalter. Fortschr Neurol Psychiatr 2013;81:381–9.
25. Retz W, Rösler M, Ose C, Scherag A, et al. Multiscale assessment of treatment efficacy in adults with ADHD: a randomized placebo-controlled, multi-centre study with extended-release methylphenidate. World J Biol Psychiatry 2012;13:48–59.
26. Röhrig B, du Prel JB, Wachtlin D, Blettner M. Studientypen in der medizinischen Forschung. Teil 3 der Serie zur Bewertung wissenschaftlicher Publikationen. Dtsch Arztebl Int 2009;106:262–8.
27. Rösler M, Fischer R, Ammer R, Ose C, Retz W. A randomised, placebo-controlled, 24-week, study of low-dose extended-release methylphenidate in adults with attention-deficit/hyperactivity disorder. Eur Arch Psychiatry Clin Neurosci 2009;259:120–9.
28. Rösler M, Ginsberg Y, Arngrim T, Adamou M, et al. Correlation of symptomatic improvements with functional improvements and patient-reported outcomes in adults with attention-deficit/hyperactivity disorder treated with OROS methylphenidate. World J Biol Psychiatry 2013;14:282–90.
29. Spencer T, Biederman J, Wilens T, Doyle R, et al. A large, double-blind, randomized clinical trial of methylphenidate in the treatment of adults with attention-deficit/hyperactivity disorder. Biol Psychiatry 2005;57:456–63.
30. Spencer T, Wilens T, Biederman J, Faraone SV, et al. A double-blind, crossover comparison of methylphenidate and placebo in adults with childhood-onset attention-deficit hyperactivity disorder. Arch Gen Psychiatry 1995;52:434–43.
31. Spencer TJ, Biederman J, Mick E. Attention-deficit/hyperactivity disorder: diagnosis, lifespan, comorbidities, and neurobiology. J Pediatr Psychol 2007;32:631–42.
32. Wender PH, Reimherr FW, Wood D, Ward M. A controlled study of methylphenidate in the treatment of attention deficit disorder, residual type, in adults. Am J Psychiatry 1985;142:547–52.
Prof. Dr. med. Michael Rösler, Institut für Gerichtliche Psychologie und Psychiatrie, Universitätsklinikum des Saarlandes, Kirrberger Straße, 66421 Homburg/Saar, E-Mail: Michael.Roesler@uks.eu
Dr. Roland Fischer, MEDICE Arzneimittel Pütter GmbH & Co. KG, Iserlohn, Deutschland
Dr. Claudia Ose, Institut für Medizinische Informatik, Biometrie und Epidemiologie, Zentrum für Klinische Studien Essen, Universitätsklinikum Essen, Essen, Deutschland
Univ.-Prof. Dr. med. Wolfgang Retz, Klinik für Psychiatrie und Psychotherapie, Universitätsmedizin Mainz, Mainz, Deutschland
Methylphenidate treatment of adult ADHD patients improves the degree of ADHD severity under routine conditions
Attention deficit hyperactivity disorder (ADHD) is associated with substantial personal and social impairments. Besides psychosocial interventions, current guidelines recommend a therapy with methylphenidate. This prospective, non-interventional study aims to investigate the efficacy and tolerability of methylphenidate treatment of adult ADHD patients in a real-world setting.
468 adult patients with newly diagnosed ADHD were observed for 12–14 weeks. Primary efficacy endpoint was the clinical global impression (CGI) by the physician. Secondary endpoints comprise patient evaluation (Wender-Reimherr self-report, WR-SR), safety, tolerability, and dosage of methylphenidate.
With a mean daily dose of 35.8 (± 17.0) mg methylphenidate, the population of patients being severely/most extremely ill or markedly ill decreased by 64 % and 61 %, respectively. According to physicians’ assessment (CGI) 74.5 % of the patients were identified as treatment responders. The total score of the patient-based assessment (WR) improved by 23.5 % (50.1 ± 40.3 points) with the most profound improvement in attention deficit (-30.0 %), disorganization (-26.6 %) and hyperactivity/unrest (-23.3 %). Self-evaluation revealed a responder rate of 35.4 %.
In summary, methylphenidate treatment improves the degree of ADHD severity under routine conditions. In addition, activities of daily living were facilitated when taking methylphenidate. The rather poor responder rates determined by patient assessment as well as the comparatively low applied median daily dose of 40 mg indicate suboptimal dosing under routine conditions, not exploiting the beneficial therapeutic potential of methylphenidate.
Key words: Methylphenidate, ADHD therapy, efficacy, tolerability, symptom relief
Psychopharmakotherapie 2019; 26(02):78-84
