Jürgen Fritze, Frankfurt/M., Claudia Riedel, Angelika Escherich, Peggy Beinlich, Karl Broich,und Thomas Sudhop, Bonn
Die Hintergründe dieses Projekts wurden in diesem Journal im Beitrag zu Thrombozytenaggregationshemmern [5] detailliert dargestellt und werden deshalb hier nur zusammengefasst: Der von der Bundesregierung akzeptierte „Nationale Aktionsplan für Menschen mit Seltenen Erkrankungen“ des Nationalen Aktionsbündnisses für Menschen mit Seltenen Erkrankungen (NAMSE) empfiehlt unter anderem, eine „Studie zur Erfassung des Umfangs des Off-Label-Use bei Seltenen Krankheiten anhand der Daten nach §303aff. SGB V […]“ durchzuführen. Darüber hinaus zielt das Projekt darauf, dem Gemeinsamen Bundesausschuss (G-BA) erstmals Informationen über Art und Häufigkeit von Off-Label-Use zumindest der am häufigsten verordneten Wirkstoffe für das Verfahren gemäß §35c Absatz 1 Sozialgesetzbuch V (SGB V) zu liefern.
Untersuchte Arzneimittel
In dieser Untersuchung wurden die drei am häufigsten verordneten Psychostimulanzien Methylphenidat, Atomoxetin und Modafinil hinsichtlich ihrer Verschreibung in Bezug zu den Zulassungsbedingungen analysiert. Obwohl Atomoxetin pharmakodynamisch nicht direkt als Psychostimulans klassifiziert wird, wurde es wegen seiner funktionellen Verwendung in die Analyse eingeschlossen.
Die zugelassenen Anwendungsgebiete der drei Psychostimulanzien unterscheiden sich, teilweise auch zwischen den verschiedenen Fertigarzneimitteln gleichen Wirkstoffs und sind nachfolgend dargestellt.
Methylphenidat (diverse Fertigarzneimittel)
Die Fachinformationen für Methylphenidat-haltige Fertigarzneimittel sehen folgende Anwendungsgebiete vor:
- Anwendung im Rahmen einer therapeutischen Gesamtstrategie zur Behandlung von Aufmerksamkeitsdefizit-Hyperaktivitäts-Störungen (ADHS) bei Kindern ab einem Alter von 6 Jahren, wenn sich andere therapeutische Maßnahmen allein als unzureichend erwiesen haben. Bei Patienten, deren Symptome bis in das Erwachsenenalter bestehen bleiben und bei denen die Behandlung einen deutlichen Nutzen gezeigt hat, kann es angebracht sein, die Therapie im Erwachsenenalter mit der gleichen Dosierung (mg/Tag) fortzuführen.
- Anwendung im Rahmen einer therapeutischen Gesamtstrategie zur Behandlung von ADHS bei Erwachsenen
- Anwendung bei Narkolepsie: Zwanghafte Schlafanfälle während des Tages im Rahmen einer therapeutischen Gesamtstrategie
Altersgrenzen
Die Fachinformationen sehen eine Anwendung ab dem sechsten Lebensjahr vor (s.o.). Eine Anwendung unterhalb dieser Altersgrenze ist zwar nicht kontraindiziert, allerdings liegen für jüngere Patienten keine Daten zur Sicherheit und Wirksamkeit vor. Für Erwachsene ist Methylphenidat in der Behandlung der Narkolepsie bereits seit Jahrzehnten zugelassenen. In der Indikation ADHS sind einzelne Methylphenidat-haltige Fertigarzneimittel für Erwachsene erst seit April 2011 zugelassen.
Atomoxetin (Strattera®)
Gemäß Fachinformation wird Strattera® zur Behandlung der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) bei Kindern ab 6 Jahren, bei Jugendlichen und bei Erwachsenen als Teil eines umfassenden Behandlungsprogramms angewendet. Für die Behandlung Erwachsener muss bestätigt werden, dass ADHS-Symptome bereits in der Kindheit vorhanden waren.
Altersgrenzen
Atomoxetin darf nicht bei Kindern unter 6 Jahren angewendet werden.
Modafinil (diverse Fertigarzneimittel)
Gemäß Fachinformation ist Modafinil seit Mitte des Jahres 2011 angezeigt zur Behandlung von Erwachsenen mit exzessiver Schläfrigkeit, die mit Narkolepsie mit oder ohne Kataplexie einhergeht.
Mindestalter
Gemäß Zulassung beträgt das Mindestalter 18 Jahre. Für die Anwendung bei Patienten jünger als 18 Jahre bestehen Bedenken zur Unbedenklichkeit und Wirksamkeit.
Methoden der Datenanalyse
Die Methodik wurde in diesem Journal im Beitrag zu Thrombozytenaggregationshemmern [5] detailliert dargestellt und wird deshalb hier nur zusammengefasst: Grundlage bilden die Daten nach §§303aff. SGB V der Jahre 2010 und 2011, also die Abrechnungsdaten der gesetzlichen Krankenkassen. Die darin enthaltenen Pharmazentralnummern (PZN) der verordneten Arzneimittel wurden in die ATC-Codes der Wirkstoffe übersetzt. Die Pseudonymisierung der Patienten erlaubt den Versichertenbezug über längere Zeiträume. Die als Freitext formulierten Anwendungsgebiete gemäß Fachinformation wurden mit Codes der amtlichen ICD-10-GM operationalisiert. Weitere den In-Label-Use definierende Kriterien (wie Anwendungseinschränkungen und Kontraindikationen) konnten nicht gewürdigt werden, weil das spezifisch entwickelte Auswertungsskript auf die Analyse verschiedenster Wirkstoffe anwendbar sein musste, um den vorgegebenen Zeitrahmen zur Fertigstellung des Projekts beim Deutschen Institut für Medizinische Dokumentation und Information (DIMDI) nicht zu gefährden .
Für alle gesetzlich Versicherten, denen Psychostimulanzien gemäß den ATC-Codes N06BA04 (Methylphenidat), N06BA07 (Modafinil) oder N06BA09 (Atomoxetin) mindestens einmal verordnet worden waren, wurden sämtliche in diesem Beobachtungszeitraum übermittelte ICD-10-GM-Codes erfasst. Als In-Label-Use wurden diejenigen pseudonymisierten Patienten klassifiziert, bei denen mindestens einmal mindestens eine der im Datensatz übermittelten Diagnosen einer der zugelassenen Diagnosen gemäß Operationalisierung entsprach, als Off-Label-Use jene Versicherten, bei denen keine Diagnose den zugelassenen Indikationsdiagnosen entsprach. Um mögliche Mängel der Operationalisierung zu kompensieren, wurde gegebenenfalls In-Label-Use rekonstruiert. Die Rekonstruktionen konnten nur semiquantitativ gelingen, weil im Beobachtungszeitraum von acht Quartalen derselbe Sachverhalt von unterschiedlichen Ärzten mit unterschiedlichen und damit über die Zeit wechselnden Codes kodiert worden sein konnte. Die Auswahl, Interpretation und Bewertung mutmaßlich beabsichtigter Off-Label-Indikationen konnte nur durch manuelle Sichtung jeder einzelnen Diagnose gemäß medizinischer Plausibilität erfolgen.
Um Off-Label-Use in Form eines Verstoßes gegen mögliche Altersbeschränkungen näherungsweise erkennen zu können, erfolgten die Zählungen differenziert nach den Altersgruppen <1 Jahr, 1 bis <14 Jahre (Kinder), 14 bis <18 Jahre (Jugendliche) und Erwachsene nach Dekaden, sodass die Altersgrenze 6 Jahre für Methylphenidat und Atomoxetin nicht gewürdigt werden konnte.
Der In-Label-Use der Psychostimulanzien wurde mit den in Tabelle 1 präsentierten Codes operationalisiert.
Tab. 1. ICD-10-GM Codes, die zur Operationalisierung eines In-Label-Use der analysierten Psychostimulanzien verwendet wurden
|
Methylphenidat |
Atomoxetin |
Modafinil |
|
|
F90.- Hyperkinetische Störungen |
+ |
+ |
|
|
G47.4 Narkolepsie und Kataplexie |
+ |
+ |
Einschränkungen der Operationalisierungen
Die Operationalisierungen konnten die unterjährigen Indikationsänderungen im Beobachtungszeitraum nicht würdigen. Indem die Zulassung der Indikationen obstruktive Schlafapnoe, Schichtarbeitersyndrom und idiopathische Hypersomnie für Modafinil zum 1. Juni 2011 widerrufen wurde, war der diesbezügliche Off-Label-Use im Beobachtungszeitraum 2010 und 2011 nicht quantifizierbar.
Limitationen aufgrund des Datenschutzes
Aus Gründen des Datenschutzes wurde für alle Einzeldiagnosen (ICD-Codes) mit einer Anzahl von Versicherten zwischen 1 und 30 vom DIMDI für solche Diagnosen eine Anzahl von 30 ausgewiesen, um sicherzustellen, dass keine Reidentifikation der Versicherten erfolgen kann. In diesen Fällen wurden zur Kompensation jeweils Spannweiten mit einem hypothetischen Minimum, bei dem n=1 Versicherte pro Gruppe angenommen wurden, und einem Maximum, bei dem hypothetisch n=30 angenommen wurden, errechnet und in den Auswertungen in Form eines Intervalls mit jeweils unterer und oberer Grenze angegeben.
Weitere Limitationen
Bei jedem Wirkstoff gilt, dass die Versicherten im Beobachtungszeitraum auch mit anderen Psychostimulanzien (und zahlreichen anderen Wirkstoffen) behandelt worden sein konnten.
Ergebnisse
Jeweils weit mehr als 99% der Versicherten waren im Beobachtungszeitraum ausschließlich ambulant behandelt worden (Tab. 2). Zwischen Methylphenidat und Atomoxetin einerseits und Modafinil andererseits bestanden zu erwartende Unterschiede in der Verteilung von Geschlecht (Tab. 2) und Alter (Abb. 1). Bei Methylphenidat und Atomoxetin dominierte das männliche Geschlecht (Tab. 2). Das Mindestalter (Tab. 2) wurde unter Modafinil bei 71 bis 158 Versicherten (Minimum und Maximum aufgrund der Datenschutzregelung) unterschritten. Für Methylphenidat und Atomoxetin konnte die – ohnehin weich formulierte – untere Altersgrenze nicht geprüft werden, weil die Standarddatenbankabfrage diese Grenze nicht enthielt.
Tab. 2. Verordnung von Psychostimulanzien: Synopse der Ergebnisse (OLU =Off-Label-Use, min/max gemäß Datenschutzregelung); infolge der Datenschutzregelung kann sich ergeben, dass die Maxima rechnerisch unter den Minima liegen
|
Methylphenidat |
Atomoxetin |
Modafinil |
|
|
Total |
308050 |
31733 |
10618 |
|
Ausschließlich ambulant |
99,95% |
99,90% |
99,84% |
|
Anteil weiblich min. |
22,7% |
20,40% |
45,90% |
|
Anteil weiblich max. |
22,7% |
20,70% |
45,90% |
|
OLU vor Rekonstruktion |
6% |
6% |
59% |
|
OLU nach Rekonstruktion |
6% |
6% |
30% |
|
Alter <18 Jahre min. |
88,11% |
88,81% |
0,67% |
|
Alter <18 Jahre max. |
88,08% |
88,32% |
1,48% |
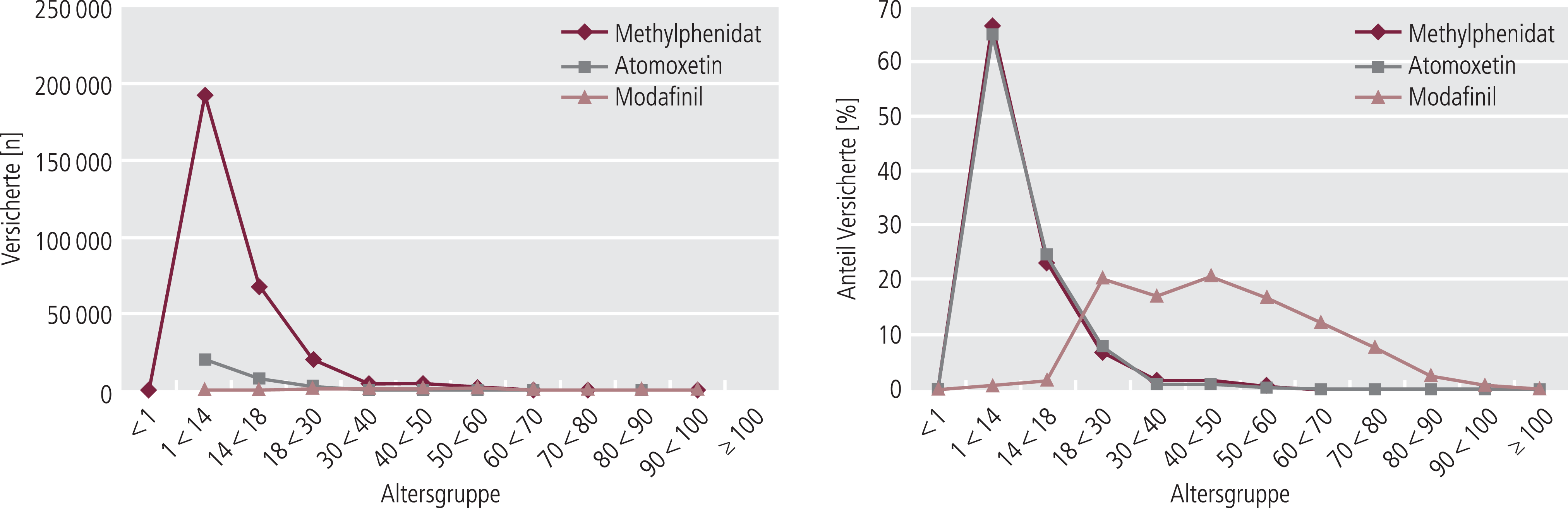
Abb. 1. Verordnung von Methylphenidat, Atomoxetin und Modafinil nach Altersgruppen (In-Label-Use; absolut und als Anteil an der Gesamtzahl der jeweiligen Versicherten)
Unter den Diagnosen, die den In-Label-Use operationalisieren, wurde Code F90.0 (Einfache Aktivitäts- und Aufmerksamkeitsstörung) am häufigsten genannt (Tab. 3). Dabei ergab sich, dass Modafinil bei knapp 3% off Label bei ADHS verordnet wurde (Tab. 3). Knapp 3% der mit Modafinil Behandelten war ein Code aus dem Code-Bereich der ADHS zugeordnet worden, was einem Off-Label-Use entspricht.
Tab. 3. In den In-Label-Use- (ILU) und Off-Label-Use-Gruppen (OLU) genannte, den In-Label-Use operationalisierende Diagnosen (infolge im Beobachtungszeitraum wechselnder Kodierungen übersteigt die Zahl der Nennungen die Gruppengrößen)
|
ICD-Code |
ICD-Titel 2010/2011 |
Atomoxetin ILU |
Methylphenidat ILU |
Modafinil |
Modafinil |
|
F90.0 |
Einfache Aktivitäts- und Aufmerksamkeitsstörung |
86,73% |
89,12% |
2,88% |
2,91% |
|
F90.1 |
Hyperkinetische Störung des Sozialverhaltens |
41,56% |
32,36% |
||
|
F90.8 |
Sonstige hyperkinetische Störungen |
2,61% |
2,36% |
||
|
F90.9 |
Hyperkinetische Störung, nicht näher bezeichnet |
16,22% |
16,99% |
||
|
G47.4 |
Narkolepsie und Kataplexie |
0,40% |
100% |
Bei der Aufklärung des apparenten Off-Label-Use (Tab. 4) ergab sich, dass maximal die Hälfte des Off-Label-Use von Modafinil Schlafapnoe-Syndromen und idiopathischer Hypersomnie galt, also Indikationen, die in einem Teil des Beobachtungszeitraums noch zugelassen waren. Wesentliche weitere den Off-Label-Use mutmaßlich motivierende Anteile galten dem chronischen Müdigkeitssyndrom (Fatigue), entweder isoliert oder mit multipler Sklerose assoziiert (was hier nicht unterschieden werden kann). Der Off-Label-Use von Atomoxetin galt am ehesten Aufmerksamkeitsstörungen ohne Hyperaktivität (F98.8), dem auch der Off-Label-Use von Methylphenidat gegolten zu haben schien, hier aber außerdem – vermutlich als Augmentation – depressiven Syndromen.
Tab. 4. Synopse der vermutlich den Off-Label-Use motivierenden ICD-10-GM-Codes und ihren Anteilen (fettgedruckt) in den Gruppen (ILU=In-Label-Use gemäß Operationalisierung; OLU=Off-Label-Use gemäß Operationalisierung)
|
ICD-Code |
ICD-Titel 2010/2011 |
Atomoxetin ILU |
Atomoxetin OLU |
Methylphenidat ILU |
Methylphenidat OLU |
Modafinil ILU |
Modafinil OLU |
|
F32.0 |
Leichte depressive Episode |
1,52% |
1,11% |
1,48% |
5,22% |
4,59% |
|
|
F32.1 |
Mittelgradige depressive Episode |
2,83% |
4,59% |
2,23% |
3,66% |
12,49% |
12,92% |
|
F32.9 |
Depressive Episode, nicht näher bezeichnet |
4,22% |
8,12% |
3,72% |
7,15% |
26,46% |
28,85% |
|
F33.1 |
Rezidivierende depressive Störung, gegenwärtig mittelgradige Episode |
0,85% |
1,03% |
2,04% |
7,02% |
7,97% |
|
|
F33.2 |
Rezidivierende depressive Störung, gegenwärtig schwere Episode ohne psychotische Symptome |
0,51% |
0,49% |
1,23% |
3,41% |
5,60% |
|
|
F33.9 |
Rezidivierende depressive Störung, nicht näher bezeichnet |
0,28% |
0,38% |
0,77% |
3,80% |
4,59% |
|
|
F34.1 |
Dysthymia |
0,97% |
1,13% |
1,91% |
8,07% |
7,60% |
|
|
F43.2 |
Anpassungsstörungen |
12,52% |
10,65% |
11,48% |
8,65% |
9,77% |
9,29% |
|
F45.9 |
Somatoforme Störung, nicht näher bezeichnet |
4,20% |
2,42% |
3,95% |
3,61% |
11,30% |
10,68% |
|
F48.0 |
Neurasthenie |
0,62% |
0,72% |
1,44% |
8,42% |
10,07% |
|
|
F98.8 |
Sonstige näher bezeichnete Verhaltens- und emotionale Störungen mit Beginn in der Kindheit und Jugend |
19,51% |
34,79% |
21,21% |
43,57% |
0,71% |
0,64% |
|
F98.9 |
Nicht näher bezeichnete Verhaltens- oder emotionale Störungen mit Beginn in der Kindheit und Jugend |
3,89% |
2,74% |
3,42% |
2,64% |
||
|
G35.10 |
Multiple Sklerose mit vorherrschend schubförmigem Verlauf: Ohne Angabe einer akuten Exazerbation oder Progression |
1,37% |
11,05% |
||||
|
G35.11 |
Multiple Sklerose mit vorherrschend schubförmigem Verlauf: Mit Angabe einer akuten Exazerbation oder Progression |
7,04% |
|||||
|
G35.20 |
Multiple Sklerose mit primär-chronischem Verlauf: Ohne Angabe einer akuten Exazerbation oder Progression |
3,46% |
|||||
|
G35.30 |
Multiple Sklerose mit sekundär-chronischem Verlauf: Ohne Angabe einer akuten Exazerbation oder Progression |
3,94% |
|||||
|
G35.31 |
Multiple Sklerose mit sekundär-chronischem Verlauf: Mit Angabe einer akuten Exazerbation oder Progression |
3,33% |
|||||
|
G35.9 |
Multiple Sklerose, nicht näher bezeichnet |
0,04% |
3,64% |
20,28% |
|||
|
G47.1 |
Krankhaft gesteigertes Schlafbedürfnis |
0,09% |
0,23% |
19,99% |
13,54% |
||
|
G47.2 |
Störungen des Schlaf-Wach-Rhythmus |
0,10% |
3,34% |
2,95% |
|||
|
G47.3 |
Schlafapnoe |
0,09% |
0,20% |
8,58% |
8,92% |
||
|
G47.30 |
Zentrales Schlafapnoe-Syndrom |
0,02% |
2,90% |
3,09% |
|||
|
G47.31 |
Obstruktives Schlafapnoe-Syndrom |
0,14% |
0,22% |
0,36% |
19,12%* |
20,30% |
|
|
G47.38 |
Sonstige Schlafapnoe |
0,03% |
4,89%* |
3,84% |
|||
|
G47.39 |
Schlafapnoe, nicht näher bezeichnet |
0,12% |
0,24% |
0,45% |
21,18%* |
22,93% |
|
|
G47.9 |
Schlafstörung, nicht näher bezeichnet |
1,63% |
1,53% |
1,56% |
9,15% |
8,90% |
|
|
G93.3 |
Chronisches Müdigkeitssyndrom |
0,07% |
0,19% |
5,90% |
11,94% |
||
|
R46.3 |
Hyperaktivität |
3,62% |
3,74% |
3,55% |
5,93% |
*Seit 2011 nicht mehr zugelassene Indikation
Zur Morbidität jenseits der zugelassenen Indikationen einerseits und den mutmaßlich den Off-Label-Use motivierenden Codes gibt Tabelle 5 einen Überblick. Für überzufällig häufige Komorbiditäten (im Sinne der Pharmakovigilanz) wurden keine eindeutigen Signale gefunden. Bei der Interpretation der Unterschiede zwischen den Wirkstoffen (Tab. 5) müssen unter anderem die Altersunterschiede als konfundierende Variablen berücksichtigt werden. Dennoch kann die Rate insbesondere kardiovaskulärer Ereignisse unter Modafinil Anlass zu erhöhter Aufmerksamkeit sein.
Tab. 5. Häufigkeiten (Auszug) von ICD-Codes zur allgemeinen Morbidität (ILU=In-Label-Use gemäß Operationalisierung; OLU=Off-Label-Use gemäß Operationalisierung)
|
ICD-Code |
ICD-Titel 2010/2011 |
Atomoxetin ILU |
Methylphenidat ILU |
Methylphenidat OLU |
Modafinil ILU |
Modafinil OLU |
|
D69.6 |
Thrombozytopenie, nicht näher bezeichnet |
0,01% |
||||
|
D70.3 |
Sonstige Agranulozytose |
0,04% |
||||
|
D70.7 |
Neutropenie, nicht näher bezeichnet |
0,18% |
0,25% |
|||
|
I21.9 |
Akuter Myokardinfarkt, nicht näher bezeichnet |
0,01% |
0,89% |
1,04% |
||
|
I25.9 |
Chronische ischämische Herzkrankheit, nicht näher bezeichnet |
0,06% |
0,65% |
7,11% |
8,39% |
|
|
I48.10 |
Vorhofflimmern: Paroxysmal |
0,02% |
0,85% |
2,48% |
||
|
I48.11 |
Vorhofflimmern: Chronisch |
2,11% |
||||
|
I48.19 |
Vorhofflimmern: Nicht näher bezeichnet |
0,02% |
2,13% |
2,71% |
||
|
I49.3 |
Ventrikuläre Extrasystolie |
0,20% |
0,20% |
0,94% |
||
|
I49.4 |
Sonstige und nicht näher bezeichnete Extrasystolie |
0,18% |
0,23% |
|||
|
I49.5 |
Sick-Sinus-Syndrom |
|||||
|
I49.8 |
Sonstige näher bezeichnete kardiale Arrhythmien |
0,22% |
0,28% |
|||
|
I49.9 |
Kardiale Arrhythmie, nicht näher bezeichnet |
1,07% |
1,05% |
0,94% |
4,60% |
3,81% |
|
I64 |
Schlaganfall, nicht als Blutung oder Infarkt bezeichnet |
0,02% |
0,18% |
2,13% |
3,38% |
|
|
K21.0 |
Gastroösophageale Refluxkrankheit mit Ösophagitis |
0,56% |
0,59% |
1,56% |
9,88% |
10,92% |
|
K21.9 |
Gastroösophageale Refluxkrankheit ohne Ösophagitis |
0,46% |
0,39% |
0,68% |
3,73% |
4,16% |
|
K71.9 |
Toxische Leberkrankheit, nicht näher bezeichnet |
0,04% |
||||
|
K76.0 |
Fettleber [fettige Degeneration], anderenorts nicht klassifiziert |
0,25% |
0,28% |
0,64% |
5,47% |
6,05% |
|
K76.9 |
Leberkrankheit, nicht näher bezeichnet |
0,99% |
1,20% |
1,05% |
3,61% |
3,87% |
|
N18.2 |
Chronische Nierenkrankheit, Stadium 2 |
0,01% |
0,82% |
1,67% |
||
|
N18.3 |
Chronische Nierenkrankheit, Stadium 3 |
0,01% |
1,03% |
2,18% |
||
|
N19 |
Nicht näher bezeichnete Niereninsuffizienz |
0,13% |
0,21% |
0,49% |
2,36% |
2,56% |
Jenseits der Narkolepsie (In-Label-Use) wurden keine seltenen Krankheiten als mögliche Off-Label-Indikation für eines der Psychostimulanzien entdeckt.
In den Jahren 2010 und 2011 wurden gemäß Arzneiverordnungsreport 2011 und 2012 56,3 bzw. 55,8 Mio. empfohlene Tagesdosen (defined daily doses, DDD) Methylphenidat zulasten der GKV verordnet sowie 2,5 Mio. DDD bzw. 2,4 Mio. DDD Atomoxetin und jeweils 0,8 Mio. DDD Modafinil. Gemäß den hier erhobenen Daten konnten daraus erstmals die mittleren Behandlungsdauern innerhalb des zweijährigen Beobachtungszeitraums abgeschätzt werden (Abb. 2). Gemäß Definition der WHO (und der amtlichen ATC-Klassifikation) entspricht die DDD der empfohlenen durchschnittlichen Tagesdosis, die mit der tatsächlichen Tagesdosis in der Verordnungspraxis nicht exakt übereinstimmen muss, sodass die genannten Behandlungsdauern (Abb. 2) nur Näherungswerte darstellen können.
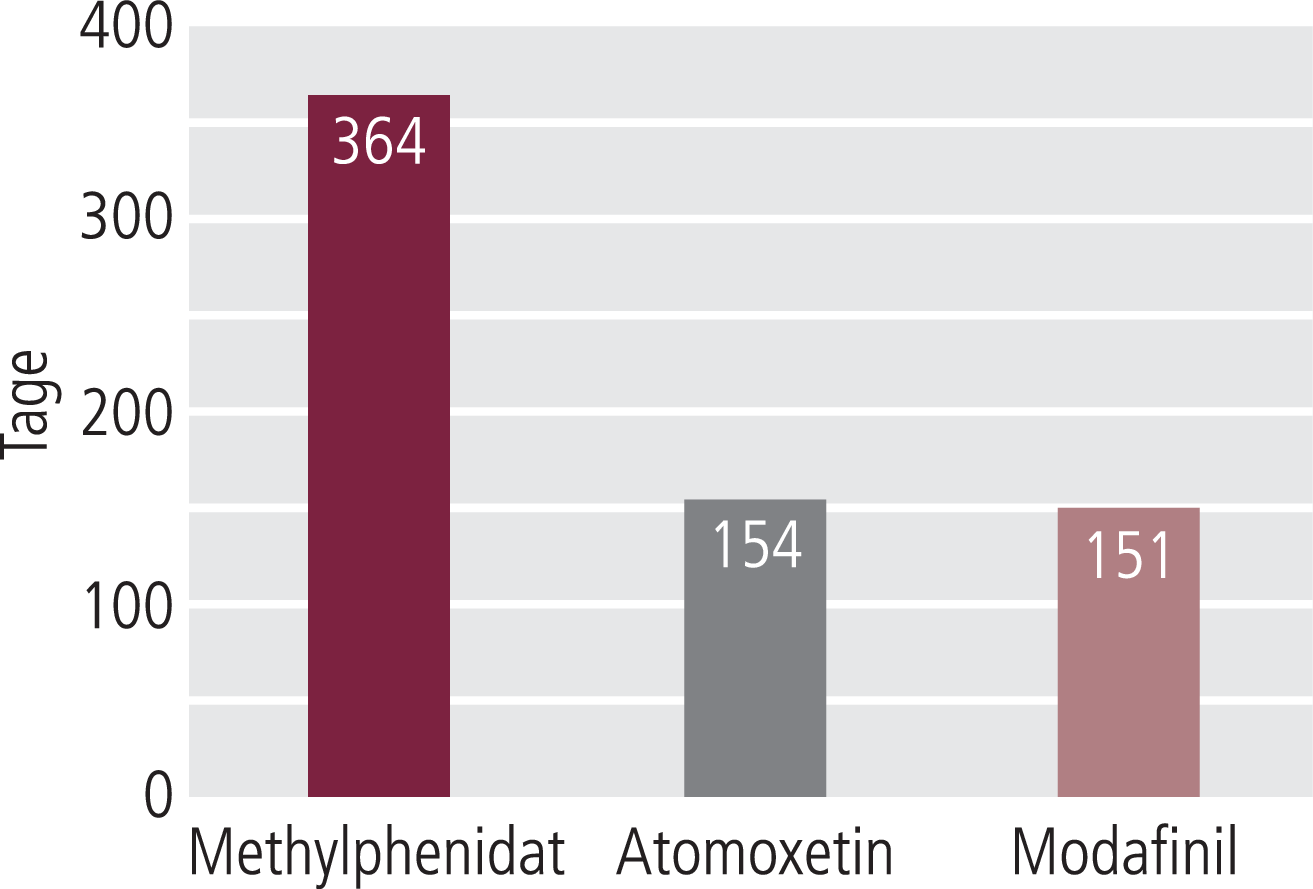
Abb. 2. Behandlungstage mit Methylphenidat, Atomoxetin und Modafinil im Beobachtungszeitraum 2010 und 2011 auf Basis der durchschnittlichen in diesen Jahren gemäß Arzneiverordnungsreport 2011 und 2012 verordneten Tagesdosen und der in diesem Projekt ermittelten Anzahl jeweils behandelter Versicherter der gesetzlichen Krankenversicherung
Diskussion
In diesem Projekt werden erstmals sogenannte Routinedaten der Krankenkassen als Vollerfassung aller gesetzlich Krankenversicherten – anhand der Daten nach §§303aff. SGB V – zur Frage des Off-Label-Use und für Zwecke der Pharmakovigilanz genutzt. Das Beispiel der hier dargestellten Psychostimulanzien belegt erneut die Praktikabilität dieses Forschungsansatzes, obwohl diese Routinedaten zu Abrechnungszwecken mit Sekundärnutzung für die Kalkulation des Risikostrukturausgleichs erhoben wurden. Bei der Interpretation der Ergebnisse müssen selbstverständlich die daraus resultierenden Schwächen der Daten berücksichtigt werden.
Rekonstruktionen waren nur für Modafinil notwendig, da sich dessen zugelassene Anwendungsgebiete im Beobachtungszeitraum geändert hatten. Rekonstruktionen erlauben nur semiquantitative Schätzungen, auch infolge der anzuwendenden Datenschutzregelung. Danach belief sich der Off-Label-Use von Modafinil auf etwa 30%, der von Methylphenidat und Atomoxetin auf jeweils etwa 6%. Der Off-Label-Use von Atomoxetin galt am ehesten Aufmerksamkeitsstörungen ohne Hyperaktivität (Code F98.8), dem auch ein Teil des Off-Label-Use von Methylphenidat gegolten zu haben schien. Zu den häufigsten Diagnosen in den Gruppen mit apparentem Off-Label-Use gehörte der unspezifische Code F98.8 (Sonstige näher bezeichnete Verhaltens- und emotionale Störungen mit Beginn in der Kindheit und Jugend).
Diesem unspezifischen Code ist unter anderem die Aufmerksamkeitsstörung ohne Hyperaktivität zugeordnet (aber auch Daumenlutschen, exzessive Masturbation, Nägelkauen und Nasebohren). Auch wenn die nosologische Differenzierung zwischen ADHS einerseits und isolierter Aufmerksamkeitsstörung andererseits wissenschaftlich umstritten ist (die neue amerikanische Klassifikation psychischer Krankheiten DSM 5 hat diese Differenzierung aufgegeben und berücksichtigt sie nur noch als Prägnanztypen), so erstrecken sich die Zulassungen von Methylphenidat zumindest formal nicht auf die isolierte Aufmerksamkeitsstörung (so sie denn tatsächlich als eigenständige Entität existiert). Die Cochrane Metaanalyse von Storebø et al. [8] fand – allerdings auf Basis weniger Daten – höhere Effektstärken von Methylphenidat beim unaufmerksamen Subtyp der ADHD. Das Gegenteil wurde für Atomoxetin berichtet [4].
Hier exemplifiziert sich das generelle Problem der Therapie mit Psychopharmaka, dass diese aus guten Gründen für Anwendungsgebiete grundsätzlich mit Bezug auf spezifisch formulierte Diagnosen geprüft und zugelassen werden, dass es sich bei den Diagnosen im psychiatrischen Fachgebiet aber im Wesentlichen um Konstrukte und Konventionen ohne externe Validierungskriterien handelt, was sich erneut in den Änderungen im DSM 5 widerspiegelt. Dem entspricht die Tradition, dass der Einsatz spezifischer Psychopharmaka in der Praxis durch Symptome, Syndrome und erwartete Verträglichkeit indiziert wird.
Zu den weiteren häufiger in den Gruppen mit apparentem Off-Label-Use genannten Diagnosen gehörten Störungen, die bei ADHS gehäuft als Komorbiditäten beobachtet werden, hier insbesondere Depressionen, andere Entwicklungsstörungen, Angststörungen und Teilleistungsstörungen, zum Beispiel die Lese-Rechtschreib-Störung (Tab. 4). Es kann nicht ausgeschlossen werden, dass bei einem Teil dieser Patienten nur die komorbide Störung, nicht aber auch die Hauptdiagnose ADHS kodiert wurde. Gegen eine solche Interpretation würde aber sprechen, dass die Verordnung von Methylphenidat mit den besonderen Aufwänden des Betäubungsmittelrechts verbunden ist, weshalb besondere Sorgfalt auch bei der Kodierung zu erwarten sein könnte.
Der – auch adjuvante – Einsatz von Psychostimulanzien und hier auch Methylphenidat und Modafinil insbesondere bei therapierefraktärer Depression wird seit Jahrzehnten diskutiert [9]. Wirklich belastbare Evidenz wurde bisher aber nicht generiert [2].
Demgegenüber scheint die nicht bestimmungsgemäße Verordnung von Modafinil der Fatigue (chronisches Müdigkeitssyndrom) entweder isoliert oder in Assoziation mit der multiplen Sklerose gegolten zu haben, daneben der ADHS. Für den Off-Label-Use von Modafinil bei ADHS liegen Placebo-kontrollierte Studien mit positiven Ergebnissen vor [10]. Ob aber in diesen Indikationen eine wirklich positive Nutzen-Risiko-Relation besteht, muss bezweifelt werden, da die Europäische Arzneimittelagentur EMA im Jahre 2011 das Anwendungsgebiet von Modafinil wegen kardiovaskulärer (Hypertonie, Arrhythmie), psychiatrischer (Suizidalität, Manie, psychotische Symptome) und dermatologischer (bis hin zum Stevens-Johnson Syndrom) Komplikationen deutlich eingeschränkt hat.
Zum Einsatz der Psychostimulanzien bei Fatigue gibt es wenige positive randomisierte, kontrollierte Studien [1]. Eine Studie zu Methylphenidat spezifisch bei Fatigue im Kontext der multiplen Sklerose (ClinicalTrials.gov Identifier: NCT02286557) scheint noch nicht abgeschlossen zu sein. Eine Studie zu Modafinil in dieser Indikation [7] ergab zwar günstige Ergebnisse, kann aber aus methodischen Gründen (insbesondere unzureichende Verblindung) nur als Pilotstudie gewertet werden.
Bei der Erwerbstätigenbefragung der DAK-Gesundheit 2014 [3] haben bedeutsame Anteile der Befragten angegeben, unter anderem Psychostimulanzien im Sinne eines Neuroenhancement (also ohne medizinische Indikation) off Label eingesetzt zu haben. Zwar spiegelt sich das nicht erkennbar in den Verordnungen zulasten der gesetzlichen Krankenversicherung im Beobachtungszeitraum 2010 bis 2011 wider; indem sich der Off-Label-Use aber unter anderem wegen der Datenschutzvorgaben nur näherungsweise quantifizieren ließ, schließen die Ergebnisse nicht aus, dass Off-Label-Use zwecks Neuroenhancement auch in gewissen Umfang zulasten der GKV stattgefunden haben könnte.
Gemäß der GKV-Mitgliederstatistik KM6 waren im Jahre 2011 12597532 Versicherte jünger als 20 Jahre. Ignoriert man die unterschiedlichen Altersgrenzen (hier <18 Jahre), dann lag die Behandlungsprävalenz mit Methylphenidat bei etwa mindestens 2,2% (infolge der unterschiedlichen Altersgrenzen eine Unterschätzung). Einschließlich der – kleinen – Verordnungsanteile der anderen Wirkstoffe in diesem Indikationsbereich (Tab. 2 und Tab. 3) lag die Behandlungsprävalenz mit diesen „Psychostimulanzien“ in den Jahren 2010 und 2011 also bei etwa der Hälfte der im Kinder- und Jugendgesundheitssurvey (KiGGS) des Robert Koch-Instituts [6] berichteten ADHS-Prävalenz (4,8% als an ADHS leidend diagnostizierte Patienten). Insofern liefert das hier berichtete Projekt erstmals belastbare Schätzungen zur Behandlungsprävalenz mit „Psychostimulanzien“ bei ADHS auf Basis von Routinedaten.
Die durchschnittlichen Behandlungsdauern (Abb. 2) dürfte man nur zur Kenntnis nehmen, jedenfalls hier nicht bewerten können.
Danksagung
Dem Bundesministerium für Gesundheit wird nachdrücklich für die finanzielle Unterstützung des Projekts gedankt. Herrn Prof. Dr. W. Schwerdtfeger, früherer Präsident des BfArM, wird herzlich für die Unterstützung bei der Initiierung dieses Projektes gedankt. Herrn Dr. Jochen Dreß und Herrn Dr. Michael Schopen, Deutsches Institut für Medizinische Dokumentation und Information (DIMDI), gilt besonderer Dank für die Kooperation bei der Entwicklung der Datenbankabfrageskripte und deren Anwendung.
Interessenkonflikterklärung
J.F. hat in den letzten 5 Jahren Honorare für Beratertätigkeit von Amgen, Janssen, Lilly, Lundbeck, Nestlé, Novartis, Pfizer, Roche, St. Jude Medical, 3M, Sanvartis, Teva und dem Verband der privaten Krankenversicherung e.V. erhalten.
Die anderen Autoren geben an, keine Interessenkonflikte zu haben.
Literatur
1. Blockmans D, Persoons P, Van Houdenhove B, Bobbaers H. Does methylphenidate reduce the symptoms of chronic fatigue syndrome? Am J Med 2006;119:167.e23–30.
2. Candy M, Jones L, Williams R, Tookman A, King M. Psychostimulants for depression. Cochrane Database Syst Rev. 2008;2:CD006722.
3. DAK-Gesundheitsreport 2015. www.dak.de/dak/download/Gesundheitsreport_2015_Update_Doping_am_Arbeitsplatz-1587940.pdf
4. Ercan ES, Akyol Ardic U, Kabukcu Basay B, Ercan E, Basay O. Atomoxetine response in the inattentive and combined subtypes of attention deficit hyperactivity disorder: a retrospective chart review. Atten Defic Hyperact Disord. 2013;5:377–85. doi: 10.1007/s12402–013–0111–0. Epub 2013 Jun 5.
5. Fritze J, Riedel C, Escherich A, Beinlich P, et al. Thrombozytenaggregationshemmer: Spektrum der Verordnung und Mobidität. Explorative Analyse anhand einer Vollerfassung der Abrechnungsdaten der Gesetzlichen Krankenversicherung. Psychopharmakotherapie 2017;24:8–20.
6. Hölling H, Schlack R, Petermann F, et al.; KiGGS Stuiengruppe. Psychische Auffälligkeiten und psychosoziale Beeinträchtigungen bei Kindern und Jugendlichen im Alter von 3 bis 17 Jahren in Deutschland – Prävalenz und zeitliche Trends zu 2 Erhebungszeitpunkten (2003–2006 und 2009–2012). Ergebnisse der KiGGS-Studie – Erste Folgebefragung (KiGGS Welle 1). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2014;57:807–19.
7. Rammohan KW, Rosenberg JH, Lynn DJ. Efficacy and safety of modafinil (Provigil®) for the treatment of fatigue in multiple sclerosis: a two centre phase 2 study. J Neurol Neurosurg Psychiatry 2002;72:179–83.
8. Storebø OJ, Krogh HB, Ramstad E, Moreira-Maia CR, et al. Methylphenidate for attention-deficit/hyperactivity disorder in children and adolescents: Cochrane systematic review with meta-analyses and trial sequential analyses of randomised clinical trials. BMJ 2015;351:h5203. doi: 10.1136/bmj.h5203.
9. Stotz G, Woggon B, Angst J. Psychostimulants in the therapy of treatment-resistant depression. Review of the literature and findings from a retrospective study in 65 depressed patients. Dialogues Clin Neurosci 1999;1:165–74.
10. Turner D. A review of the use of modafinil for attention-deficit hyperactivity disorder. Expert Rev Neurother 2006;6:455–68.
Prof. Dr. med. Jürgen Fritze, Asternweg 65, 50259 Pulheim, E-Mail: juergen.fritze@dgn.de
Dr. med. Claudia Riedel, Angelika Escherich, Peggy Beinlich, Prof. Dr. Karl Broich, Priv.-Doz. Dr. Thomas Sudhop, Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn
Psychostimulants: Spectra of prescribing and morbidities
In an ongoing project supported by the Federal Ministry of Health (BMG) off-label-use of pharmaceuticals with high prescription rates is investigated in a database comprising all citizens covered by public sick funds. The focus is on prevalences and indications as well as on the identification of off-label-use specifically addressing rare diseases in the context of the Action Plan of the National Action League for People with Rare Diseases (NAMSE). In the years 2010 through 2011 among psychostimulants methylphenidate, atomoxetin und modafinil had probably been used off-label in about 5%, 6% and 30%, respectively, methylphenidate and atomoxetin essentially addressing isolated attention deficit disorder and depressive syndromes (possibly as an augmentation strategy) while modafinil appears to have been prescribed for chronic fatigue be it isolated or associated with multiple sclerosis. Far more than 99% had exclusively been treated as outpatients. Because of methological reasons (among others approval of methylphenidate for adults in 2011, i.e. during the observation period) off-label-use due to ignoring limits of age could be assessed only for modafinil where 0.7% to 1.5% had been younger than 18 years. Beyond the diagnoses putatively underlying in- and off-label-use, respectively, there were no prominent comorbidities. Rare diseases beyond narcolepsy and potentially motivating off-label-use were not detected.
Key words: psychostimulants, methylphenidate, atomoxetin, modafinil, off-label-use, National Action League for People with Rare Diseases, NAMSE
Psychopharmakotherapie 2017; 24(02)
