Wiebke Schrempf, Dresden
Die Narkolepsie ist eine seltene, chronische Schlafstörung, die etwa 0,02 bis 0,05% der Gesamt-Weltbevölkerung betrifft und bei rund 24% der Patienten zu relevanten Einschränkungen führt [22]. Die Inzidenz liegt bei etwa 0,74/100000 pro Jahr [30]. Die Erkrankung manifestiert sich meist in der 2. Dekade, seltener ab der 4. Dekade und gelegentlich auch bereits in den ersten zehn Lebensjahren (ca. 20% der Erkrankungen) [8]. Die ICSD-2 (International classification of sleep disorders, 2. Aufl.) unterscheidet die klassische Form der Narkolepsie mit Kataplexie (Narkolepsie Typ 1) von der Narkolepsie ohne Kataplexie und von sekundären Narkolepsien (z.B. bei strukturellen Läsionen des Hirnstamms oder des Hypothalamus).
Die klassischen Symptome der Narkolepsie umfassen die sogenannte narkoleptische Tetrade, bestehend aus dem Auftreten exzessiver Tagesschläfrigkeit und Symptomen von dissoziierten REM-Schlaf-Phänomenen wie Kataplexie (plötzlicher Tonusverlust der Muskulatur im Wachzustand bei affektiver Erregung, vor allem bei Freude oder Ärger, dabei Areflexie), hypnagogen Halluzinationen (sensorische Ereignisse, vor allem visuelle, während des Einschlafens) und Schlafparalyse (Bewegungsunfähigkeit nach dem Aufwachen oder beim Einschlafen) [8, 34]. Zusätzlich kann automatisches Verhalten auftreten und in der Polysomnographie ist eine nächtliche Schlaffragmentierung (häufige Schlafstadienwechsel und Weckreaktionen) sowie verfrühtes Auftreten von REM-Schlaf typisch.
Diagnose
Zur Diagnosestellung muss sowohl bei der Narkolepsie mit als auch bei der Narkolepsie ohne Kataplexie eine über mindestens drei Monate bestehende ausgeprägte Tagesschläfrigkeit bestehen. Zudem muss in den multiplen Schlaflatenztests (MSLT) im Schlaflabor – bestehend aus vier bis fünf Tagschlaftests im Abstand von zwei Stunden – mindestens zweimal ein verfrühtes Auftreten von REM-Schlaf (innerhalb von 15 Minuten nach dem Einschlafen; sogenanntes Sleep-onset-REM, SOREM) dokumentiert werden. Zusätzlich ist eine durchschnittliche Einschlaflatenz von unter acht Minuten (bei 5 MSLT) typisch. Durch eine bzw. zwei vorangehende Polysomnographien sollen ein ausgeprägter Schlafentzug sowie andere Ursachen eines gestörten Nachtschlafs (z.B. relevante schlafbezogene Atmungsstörungen) als Ursache der erhöhten Tagesschläfrigkeit ausgeschlossen werden. Hier kann auch die typischerweise auftretende Schlaffragmentierung nachgewiesen werden.
Zur Quantifizierung der Tagesschläfrigkeit empfehlen sich Schlaffragebögen wie die Epworth Sleepiness Scale (ESS). Zur Symptomabfrage dienen zum Beispiel der Stanford Narcolepsy Questionnaire [1] oder der Swiss Narcolepsy Score [31].
Darüber hinaus empfehlen sich zum Ausschluss anderer Differenzialdiagnosen der Tagesschläfrigkeit, vor allem einer mangelnden Schlafhygiene und zu kurzer Schlafdauer, die ergänzende Abfrage von Schlaffragebögen (Morgen- und Abendprotokolle) sowie die Durchführung einer Aktigraphie. Zudem sollte eine Familienanamnese erhoben werden. Bei Verdacht auf eine sekundäre Narkolepsie wird im Rahmen der Ausschlussdiagnostik eine zerebrale Magnetresonanztomographie empfohlen.
Typisch, aber nicht spezifisch, ist das Vorliegen des HLA-Haplotyps DRB1*1501/DQB1*0602, der bei etwa 90 bis 95% der Patienten mit Kataplexie, jedoch nur bei rund 40% der Patienten ohne Kataplexie, vorliegt. Das Fehlen des HLA-Typs ist jedoch kein Ausschlusskriterium für diese Diagnose. Leider ist auch ein positiver Befund unspezifisch, da bis zu 30% der Normalbevölkerung [23] ebenfalls diesen Haplotyp aufweisen können. Angehörige von Narkolepsie-Patienten haben bei positivem Haplotyp DQB1*0602 ebenfalls ein erhöhtes Risiko, an Narkolepsie zu erkranken.
Bei Patienten mit Kataplexie lässt sich eine relevante Reduktion des Hypocretin-Spiegels im Liquor nachweisen [27], die auf einen Funktionsverlust bzw. eine verstärkte Degeneration hypocretinerger Neurone des dorsolateralen Hypothalamus, die für die Schlaf-Wach-Regulation eine bedeutende Rolle spielen, zurückgeführt wird und deren Ursache noch nicht abschließend geklärt ist [32]. Diskutiert werden infektiöse und autoimmunologische Prozesse [12]. Dies wird auch dadurch gestützt, dass sich in genomweiten Assoziationsstudien eine Assoziation zum T-Zell-Rezeptor-Alpha-Locus [14] sowie erhöhte Autoantikörper-Titer gegen Trib2 (Tribbles Pseudokinase 2, ein Protein, das modulierend an verschiedenen Signalwegen mitwirkt) nachweisen ließen [16].
Bei Patienten ohne Kataplexie ist die Reduktion des Hypocretins im Liquor deutlich seltener vorhanden, aber auch bei der klassischen Narkolepsie mit Kataplexie weisen etwa 5 bis 10% der Patienten einen normalen Hypocretin-Spiegel auf [17].
Neben den hypocretinergen Veränderungen wurden auch Störungen in anderen Transmittersystemen, beispielsweise im noradrenergen, cholinergen und histaminergen System, beschrieben [2].
Verlauf
Die Erkrankung kann einen unterschiedlichen Verlauf nehmen, meist ist die exzessive Tagesschläfrigkeit jedoch das erste Symptom, entweder isoliert oder zusammen mit kataplektischen Episoden [8]. Die Symptome der Narkolepsie sind oft sehr belastend für die Patienten, die sich in ihrer Lebensqualität häufig stark beeinträchtigt sehen [10], sodass viele Patienten eine lebenslange medikamentöse Therapie benötigen. Die Symptome der Erkrankung können sich im Verlauf der Erkrankung bessern, begleitend treten jedoch oft auch andere unspezifische Symptome, zum Teil auch als Folge der Tagesschläfrigkeit, wie Konzentrationsstörungen und Persönlichkeitsveränderungen sowie Depressionen auf [6, 31].
Da es bisher keine kausale Therapie der Erkrankung gibt, wird eine Kombination aus Änderungen des Lebensstils sowie symptomatischen Therapien angewendet. An erster Stelle sollten eine Optimierung der Schlafhygiene und die Entwicklung von Coping-Strategien wie individuell angepassten, regelmäßigen kurzen Tagschlafepisoden stehen, die die Tagesschläfrigkeit bei diesen Patienten verbessern können.
Bei den medikamentösen Therapieverfahren werden vor allem Arzneistoffe zur Behandlung der Tagesschläfrigkeit, zur Therapie der Kataplexien und für beide Symptome unterschieden.
Therapie der Tagesschläfrigkeit
An medikamentösen Therapieverfahren stehen zur Behandlung der Tagesschläfrigkeit als zugelassene Medikamente vor allem Stimulanzien wie Modafinil (200 bis 400 mg, maximal 600 mg/Tag) sowie als 2. Wahl Methylphenidat (10 bis 60 mg/Tag, BtM-pflichtig) zur Verfügung. In der Vergangenheit wurden auch Amphetamine und dann wegen der im Vergleich hierzu kürzeren Halbwertszeit und geringen Nebenwirkungsrate auch Methylphenidat eingesetzt, das im Vergleich zu Modafinil jedoch weniger verträglich ist.
Modafinil wirkt im Gegensatz zu den klassischen Amphetaminen und Methylphenidat über eine erhöhte Ausschüttung von Monoaminen und hypothalamischem Histamin sowie eine Aktivierung des Dopamin-Transporters [7]. Auch bei anderen Formen erhöhter Tagesmüdigkeit und -schläfrigkeit, beispielsweise bei schlafbezogenen Atmungsstörungen oder bei Morbus Parkinson, wurden zum Teil positive Effekte auf Tagesschläfrigkeit beschrieben [18]. Bei Erwachsenen wird die Substanz gut vertragen und auch das Risiko einer Abhängigkeit wird als gering eingeschätzt. Bei Kindern allerdings traten in höheren Dosierungen relevante Nebenwirkungen auf, sodass auch der Hersteller von einer Anwendung bei jüngeren Kindern abrät [29].
Sollte die Tagesschläfrigkeit sich unter Modafinil nicht relevant verbessern, stehen als Alternativen Gamma-Hydroxybuttersäure (GHB) (siehe Therapie der Kataplexien) oder Methylphenidat zur Verfügung. Kaum noch zur Anwendung kommen andere Off-Label-Varianten wie Dextroamphetamin (Methamphetamin). Armodafinil, das länger wirksame R-Isomer von Modafinil, ist in den USA zugelassen, aber nicht in Deutschland.
Als neue Therapieoption wurde im April 2016 Pitolisant (Wakix® von Bioprojet Pharma) von der Europäischen Arzneimittelagentur (EMA) zur Behandlung der Narkolepsie zugelassen. Pitolisant (Abb. 1) ist ein inverser Agonist/Antagonist am H3-Subtyp des Histaminrezeptors. Die Wirkung beruht auf einer erhöhten Histamin-Freisetzung im Gehirn, wodurch Wachheit und Aufmerksamkeit gesteigert werden.
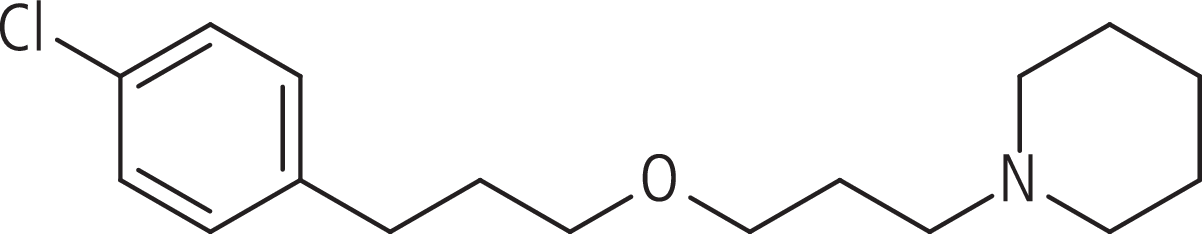
Abb. 1. Pitolisant
Tuberomamilläre histaminerge Neurone scheinen bei der Schlaf-Wach-Regulation eine große Rolle zu spielen [13] und werden durch hypocretinerge Neurone aktiviert [3]. Die wachheitsfördernde Wirkung von Orexinen scheint eng an die Intaktheit histaminerger Neuronen geknüpft zu sein [25], allerdings werden nicht alle Effekte der histaminergen Neurone unter hypocretinerger Kontrolle vermittelt, beispielsweie Arousal-Mechanismen. Im Liquor von Narkolepsie-Patienten war in mehreren Studien eine Reduktion von Histamin nachweisbar [2, 28]. Unter der Annahme, dass eine Stimulation histaminerger Neurone die Wachheit unabhängig von Hypocretin verbessern könnte, wurde Pitolisant entwickelt.
Pitolisant stimulierte im Tierversuch bei Hypocretin-defizienten Mäusen die histaminerge und noradrenerge neuronale Aktivität, förderte die Wachheit und zeigte ein vermindertes Auftreten von verfrühtem REM-Schlaf [21]. Auch tragen zusätzlich zu den histaminergen und noradrenergen auch kortikale dopaminerge und cholinerge Neurone zum wachheitsfördernden Effekt bei [20]. Zusätzlich zum Effekt auf die Tagesschläfrigkeit konnte auch eine Abnahme kataplektischer Episoden im Tiermodell des „narkoleptischen“ Dobermanns nachgewiesen werden [5].
Auch bei Patienten konnte in einer kleinen Pilotstudie mit einfach-verblindetem Design anhand der Reduktion des ESS-Scores sowie der Anzahl von Tagschlafepisoden eine Abnahme der Tagesschläfrigkeit gezeigt werden. Die Behandlung wurde insgesamt gut toleriert; als Hauptnebenwirkungen traten in den ersten Tagen der Behandlung Kopfschmerzen, Insomnie und Übelkeit sowie Depressionen/Angst auf, welche meist im Verlauf abklangen [21].
In einer doppelblinden, randomisierten, multizentrischen Studie an 95 Patienten wurde Pitolisant 10 bis 40 mg gegen Modafinil 100 bis 400 mg und Placebo verglichen; dabei zeigte sich unter Pitolisant eine signifikante Reduktion der Tagesschläfrigkeit gemessen anhand der ESS sowie Verlängerung der Einschlaflatenzen in den „Maintainance of wakefulness tests“ (multiple Wachbleibetests; MWT) im Vergleich zu Placebo sowie eine Verbesserung der Aufmerksamkeitsspanne [9]. Signifikante Unterschiede zwischen der Modafinil- und der Pitolisant-Gruppe ließen sich nicht nachweisen. Ebenso zeigte sich in der Post-hoc-Analyse eine Abnahme kataplektischer Episoden in der Pitolisant-Gruppe im Vergleich zu Placebo, aber nicht im Vergleich zu Modafinil. An Nebenwirkungen wurden erneut vor allem Kopfschmerzen, abdominelle Beschwerden und Übelkeit sowie Insomnie angegeben. Entzugssymptome traten nach Absetzen in der Pitolisant-Gruppe nicht auf [9].
Auch bei idiopathischer Hypersomnie wurden positive Effekte auf die Tagesschläfrigkeit beschrieben [19]. Die Zulassung der EMA basiert auf zwei Placebo-kontrollierten Zulassungsstudien mit insgesamt 261 Patienten, die einen positiven Effekt auf die Wachheit und zusätzlich einen leichten Effekt auf die Kataplexien zeigen konnten, sowie einer weiteren Studie mit 105 Patienten, in der eine Reduktion der Kataplexie nachgewiesen werden konnte [11]. Langzeitdaten zur Sicherheit fehlen noch und werden aktuell auf Wunsch der Zulassungsbehörden noch untersucht (Studie P15-11, [11]).
Das Arzneimittel ist in zwei Dosierungen von 4,5-mg- und 18-mg-Tabletten erhältlich und ist indiziert zur Behandlung Erwachsener mit Narkolepsie mit oder ohne Kataplexie. Die empfohlenen Behandlungsdosen liegen zwischen 4,5 und 36 mg/Tag. Kontraindikationen sind schwergradige Leber- und Nierenfunktionsstörungen, Überempfindlichkeit gegen die Medikation und Stillzeit.
Daten bei Kindern (<18 Jahre), Patienten mit schweren Depressionen/Angststörungen oder schwerwiegender koronarer Herzkrankheit (KHK) liegen nicht vor. Es besteht das Risiko einer QT-Zeit-Verlängerung, sodass das EKG vor und während der Therapie monitoriert werden muss. Bisher wurden keine Absetz- und Abhängigkeitssymptome berichtet. Die Wirkung der Medikaiton kann durch Interaktionen am H1-Rezeptor (z.B. durch trizyklische Antidepressiva) oder am CYP2D6-System abgeschwächt werden.
Therapie der Kataplexien
Kataplexien sind die spezifischsten Symptome der Narkolepsie. Diese sind durch einen plötzlichen Tonusverlust der Muskulatur gekennzeichnet, der häufig durch affektive Stimuli ausgelöst wird, und werden als Auftreten von REM-Atonie im Wachzustand angesehen.
Natriumoxybat (Gammahydroxybutyrat, GHB, BtM-pflichtig) ist nicht nur zur Behandlung der Kataplexien einsetzbar, sondern wirkt auch gut auf alle anderen Narkolepsie-Symptome, vor allem die erhöhte Tagesschläfrigkeit. Aber auch den fragmentierten Nachtschlaf und die hypnagogen Halluzinationen werden positiv beeinflusst. GHB ist ein endogener zerebraler Neurotransmitter bzw. wirkt modulatorisch mit Effekten auf das dopaminerge, serotonerge, gabaerge und opioide System [15]. Initial als Anästhetikum entworfen, wurde eine Induktion von sowohl REM- als auch NREM-Schlaf durch Natriumoxybat dokumentiert und deshalb wurde es auch in der Therapie der Narkolepsie eingesetzt. Aufgrund der kurzen Wirkdauer von nur zwei bis vier Stunden muss das Arzneimittel aufgeteilt in zwei Dosierungsintervalle mit 2,25 bis 4,5 g je Einzeldosis zur Bettzeit und erneut nach zwei bis vier Stunden eingenommen werden. Probleme der Medikation bestehen in seinem Suchtpotenzial sowie der Gefahr des Auftretens von Entzugssymptomen nach dem Absetzen. Auch wurde das Medikament missbräuchlich als sogenannte KO-Tropfen eingesetzt und es wurden auch Todesfälle, vor allem bei Patienten mit schwergradigen schlafbezogenen Atmungsstörungen, beschrieben. Insgesamt ist Natriumoxybat aber, wenn es bei Erwachsenen mit Narkolepsie sachgemäß eingesetzt wird, ein sehr effektives und sicheres Arzneimittel.
Bei ausgeprägter Kataplexie zusätzlich zur Tagesschläfrigkeit kann Natriumoxybat auch als Arzneistoff der ersten Wahl eingesetzt werden. Auch eine Kombination aus Natriumoxybat und Modafinil ist gut wirksam und kann bei fehlendem Ansprechen auf die Monotherapie erwogen werden, wenngleich das Auftreten von Nebenwirkungen etwas häufiger sein kann (v.a. Kopfschmerzen, aber auch Tremor und Dysästhesien) [4].
Zur Therapie von Kataplexien wurden bisher zudem vor allem Antidepressiva wie trizyklische Antidepressiva (TCA) (z.B. Clomipramin) und selektive Serotonin-Wiederaufnahmehemmer (SSRI) wie Venlafaxin, Reboxetin sowie Fluoxetin eingesetzt. Ebenso haben Monoaminoxidase-Hemmer einen positiven Effekt auf die Kataplexien, werden aufgrund der Nebenwirkungen sowie der Interaktionen vor allem mit verschiedenen Arzneistoffen und Lebensmitteln (wegen des CYP-Metabolismus) jedoch selten eingesetzt.
SSRI können auch leichte wachheitsfördernde Effekte haben, diese sind jedoch meist nur mild ausgeprägt [33]. SSRI können den REM-Schlafanteil deutlich reduzieren, sodass dies als potenzieller Wirkungsmechanismus bei der Reduktion der Kataplexie angenommen wird. Bei Hunden konnte gezeigt werden, dass der Haupteffekt der SSRI über eine Hemmung der Wiederaufnahme von Adrenalin vermittelt wird [26]. Auch deshalb sind sehr selektive reine Serotonin-Wiederaufnahmehemmer wie Escitalopram wahrscheinlich nicht ganz so effektiv. Die Dosierungen liegen üblicherweise unterhalb der bei Depressionen notwendigen, beispielsweise bei Venlafaxin bei 75 bis 150 mg/Tag.
TCA wirken über die Hemmung der Wiederaufnahme von Monoaminen, haben darüber hinaus aber auch anticholinerge Effekte mit entsprechenden Nebenwirkungen. Die Wirkung der Antidepressiva auf die Kataplexien setzt in der Regel rasch ein, allerdings treten beim Absetzen auch häufig verstärkt Kataplexien im Sinne eines Rebounds [24].
Bei Patienten mit unbehandelten schlafbezogenen Atmungsstörungen, Suchtmittelanamnese und Epilepsie sollten diese Medikamente jedoch allenfalls nach guter Risiko-Nutzen-Abwägung eingesetzt werden.
Zusammenfassung/Ausblick
Die Narkolepsie ist eine seltene, für die Patienten jedoch sehr belastende Erkrankung, die mit erhöhter Tagesschläfrigkeit, dissoziierten REM-Schlaf-Phänomenen wie Kataplexie und Schlafstörungen einhergeht. Zur Therapie der Tagesschläfrigkeit und der Kataplexien steht neben den bewährten Arzneistoffen wie Modafinil, Natriumoxybat und Antidepressiva (SSRI, TCA) nun ein inverser Agonist/Antagonist am Histamin-H3-Rezeptor zur Verfügung, der bei dieser Erkrankung die Therapieoptionen erweitert.
Weitere in der Entwicklungs- und Erprobungsphase befindliche Therapieansätze beinhalten beispielsweise Dopamin-Transporter-Inhibitoren, Histamin-Antagonisten, bzw. Histamin-Antagonisten mit gleichzeitiger hemmender Wirkung am Serotonin-Transporter, Hypocretin-Agonisten und andere. Die Fortschritte in der Erforschung der Physiologie und Pathophysiologie des Schlafs und der Schlafstörungen können dazu beitragen, in der Zukunft noch wirksamere Therapiestrategien zu entwickeln.
Interessenkonflikterklärung
Forschungsbeihilfe (unrestricted research grant) von TEVA GmbH, Unterstützung einer Fortbildungsveranstaltung durch UCB Pharma. Die Unterstützung durch die Firmen hatte keine Einfluss auf den Artikel.
Literatur
1. Anic-Labat S, Guilleminault C, et al. Validation of a cataplexy questionnaire in 983 sleep-disorders patients. Sleep 1999;22:77–87.
2. Bassetti CL, Baumann CR, et al. Cerebrospinal fluid histamine levels are decreased in patients with narcolepsy and excessive daytime sleepiness of other origin. J Sleep Res 2010;19:620–3.
3. Bayer L, Eggermann E, et al. Orexins (hypocretins) directly excite tuberomammillary neurons. Eur J Neurosci 2001;14:1571–5.
4. Black J, Houghton WC. Sodium oxybate improves excessive daytime sleepiness in narcolepsy. Sleep 2006;29:939–46.
5. Bonaventure P, Letavic M, et al. Histamine H3 receptor antagonists: from target identification to drug leads. Biochem Pharmacol 2007;731084–96.
6. Broughton R, Dunham W, et al. Ambulatory 24 hour sleep-wake monitoring in narcolepsy-cataplexy compared to matched controls. Electroencephalogr Clin Neurophysiol 1988;70:473–81.
7. Broughton RJ, Fleming JA, et al. Randomized, double-blind, placebo-controlled crossover trial of modafinil in the treatment of excessive daytime sleepiness in narcolepsy. Neurology 1997;49:444–51.
8. Dauvilliers Y, Arnulf I, et al. Narcolepsy with cataplexy. Lancet 2007;369:499–511.
9. Dauvilliers Y, Bassetti C, et al. Pitolisant versus placebo or modafinil in patients with narcolepsy: a double-blind, randomised trial. Lancet Neurol 2013;12:1068–75.
10. Dodel R, Peter H, et al. Health-related quality of life in patients with narcolepsy. Sleep Med 2007;8:733–41.
11. European Public Assessment Report: Wakix. EMA/828546/2015.
12. Fontana A, Gast H, et al. Narcolepsy: autoimmunity, effector T-cell activation due to infection, or T-cell independent, major histocompatibility complex class II induced neuronal loss? Brain 2010;133:1300–11.
13. Haas HL, Sergeeva OA, et al. Histamine in the nervous system. Physiol Rev 2008;88: 1183–241.
14. Hallmayer J, Faraco J, et al. Narcolepsy is strongly associated with the T-cell receptor alpha locus. Nat Genet 2009;41:708–11.
15. Huang YS, Guilleminault C. Narcolepsy: action of two gamma-aminobutyric acid type B agonists, baclofen and sodium oxybate. Pediatr Neurol 2009;41:9–16.
16. Kawashima M, Lin L, et al. Anti-Tribbles homolog 2 (TRIB2) autoantibodies in narcolepsy are associated with recent onset of cataplexy. Sleep 2010;33:869–74.
17. Khatami R, Maret S, et al. Monozygotic twins concordant for narcolepsy-cataplexy without any detectable abnormality in the hypocretin (orexin) pathway. Lancet 2004;363:1199–200.
18. Kumar R. Approved and investigational uses of modafinil: an evidence-based review. Drugs 2008;68:1803–39.
19. Leu-Semenescu S, Nittur N, et al. Effects of pitolisant, a histamine H3 inverse agonist, in drug-resistant idiopathic and symptomatic hypersomnia: a chart review. Sleep Med 2014;15:681–7.
20. Ligneau X., Perrin D, et al. BF2.649 [1-{3-[3-(4-Chlorophenyl)propoxy]propyl}piperidine, hydrochloride], a nonimidazole inverse agonist/antagonist at the human histamine H3 receptor: Preclinical pharmacology. J Pharmacol Exp Ther 2007;320:365–75.
21. Lin JS, Dauvilliers Y, et al. An inverse agonist of the histamine H3 receptor improves wakefulness in narcolepsy: studies in orexin–/– mice and patients. Neurobiol Dis 2008;30:74–83.
22. Longstreth WT Jr., Koepsell TD, et al. The epidemiology of narcolepsy. Sleep 2007;30:13–26.
23. Mignot E, Young T, et al. Nocturnal sleep and daytime sleepiness in normal subjects with HLA-DQB1*0602. Sleep 1999;22:347–52.
24. Mignot EJ. A practical guide to the therapy of narcolepsy and hypersomnia syndromes. Neurotherapeutics 2012;9:739–52.
25. Mochizuki T, Arrigoni E, et al. Orexin receptor 2 expression in the posterior hypothalamus rescues sleepiness in narcoleptic mice. Proc Natl Acad Sci USA 2011;108: 4471–6.
26. Morgenthaler TI, Kapur VK, et al. Practice parameters for the treatment of narcolepsy and other hypersomnias of central origin. Sleep 2007;30:1705–11.
27. Nishino S, Ripley B, et al. Hypocretin (orexin) deficiency in human narcolepsy. Lancet 2000;355:39–40.
28. Nishino S, Sakurai E, et al. Decreased CSF histamine in narcolepsy with and without low CSF hypocretin-1 in comparison to healthy controls. Sleep 2009;32:175–80.
29. Rugino T. A review of modafinil film-coated tablets for attention-deficit/hyperactivity disorder in children and adolescents. Neuropsychiatr Dis Treat 2007;3:293–301.
30. Silber MH, Krahn LE, et al. The epidemiology of narcolepsy in Olmsted County, Minnesota: a population-based study. Sleep 2002;25:197–202.
31. Sturzenegger C, Bassetti CL. The clinical spectrum of narcolepsy with cataplexy: a reappraisal. J Sleep Res 2004;13:395–406.
32. Thannickal TC, Siegel JM, et al. Pattern of hypocretin (orexin) soma and axon loss, and gliosis, in human narcolepsy. Brain Pathol 2003;13:340–51.
33. Wise MS, Arand DL, et al. Treatment of narcolepsy and other hypersomnias of central origin. Sleep 2007;30:1712–27.
34. Yoss RE, Daly DD. Narcolepsy. Med Clin North Am 1960;44:953–68.
Dr. med. Wiebke Schrempf, Klinik und Poliklinik für Neurologie, Interdisziplinäres Schlaflabor der Klinik für Neurologie und Innere Medizin, Technische Universität Dresden, 01307 Dresden, E-Mail: Wiebke.Schrempf@uniklinikum-dresden.de
Current therapy of narcolepsy. Pitolisant expands the therapeutic options
Narcolepsy is a rare chronic disease characterized by increased daytime sleepiness, dissociated REM sleep phenomena like cataplexy, and insomnia. For the therapy of daytime sleepiness and cataplexy, modafinil, sodium oxybate, and various antidepressants have been shown to be effective. Lately pitolisant, an inverse agonist/antagonist at histamine H3 receptors, has become available as a new treatment option for patients with narcolepsy with or without cataplexy.
Key words: Narcolepsy, daytime sleepiness, cataplexy, pitolisant, modafinil, sodium oxybate
Psychopharmakotherapie 2016; 23(05)
