Claas Ehlers, Holger Honig, Bremerhaven, und Per Odin, Bremerhaven und Lund
Entwicklung der Levodopa/Carbidopa-Infusionstherapie
Der Forschungsgruppe um Arvid Carlsson gelang in den 50er-Jahren die Entdeckung des Neurotransmitters Dopamin und seiner Wirkung im menschlichen Gehirn. Dies trug neben den Arbeiten von Hornykiewitz und Birkmeyer dazu bei, seine Rolle bei der Parkinson-Erkrankung zu verstehen. Cotzias, Van Woert und Schiffer isolierten 1967 das aktive Isomer Levodopa [5, 36]. Kurze Zeit später begann man mit den ersten peroralen Levodopa-Therapien. Dabei zeigte sich, dass diese häufig mit motorischen Fluktuationen und Dyskinesien vergesellschaftet waren. Im Jahr 1975 zeigte die Forschungsgruppe um Shoulson und Glaubiger, dass mittels einer intravenösen Infusion von Levodopa die motorischen Symptome bei Parkinson-Patienten mit ausgeprägten „On-Off“-Fluktuationen deutlich gebessert werden konnten [38]. Man nahm an, dass unter einer kontinuierlichen venösen Infusion von Levodopa stabile Plasmakonzentrationen erreicht wurden, die den beschriebenen Effekt auf die Motorik der Patienten bedingten. Obwohl weitere Studien diese Ergebnisse wiederholten, konnte sich die intravenöse Levodopa-Therapie aufgrund ihrer komplexen technischen Anwendung nicht als Option für die Langzeittherapie durchsetzen [23].
Als praktikablerer Ansatz erfolgten ab Mitte der 80er-Jahre erste Versuche zu einer enteralen Applikation von Levodopa [13]. Diese bietet unter anderem eine Möglichkeit, die Unwägbarkeiten der gastralen Entleerung zu umgehen.
Die erzielten Effekte, sowohl auf die Plasmakonzentration als auch auf die motorischen Symptome, entsprachen dabei denen der intravenösen Applikation [23]. Ein Problem bei der weiteren Entwicklung war die große zu applizierende Menge an wässrigen Levodopa/Carbidopa-Lösungen, die schließlich in der Formulierung eines Gels mündete; dieses ermöglichte die Zusammenführung von 2 g Levodopa mit 0,5 g Carbidopa in nur 0,1 Liter Methylcellulose-Gel. Erste klinische Studien mit etwa 65 Patienten mit diesem Duodopa® genannten Produkt erfolgten 1991, wobei die Weiterentwicklung geeigneter Pumpen und Sonden in Uppsala, Schweden, weitere Jahre in Anspruch nahm [20, 27]. Im Jahr 2001 erhielt das Arzneimittel von der EMA einen Orphan-Drug-Status für die Behandlung des fortgeschrittenen Parkinson-Syndroms. Das gegenseitige Anerkennungsverfahren (Mutual recognition procedure [MRP]) für Duodopa® wurde noch im gleichen Jahr eingeleitet. In Deutschland wurde das Produkt 2004 zugelassen.
Heutzutage handelt es sich bei der Duodopa®-Pumpentherapie um ein erprobtes Therapiekonzept für das Komplikationsstadium des fortgeschrittenen idiopathischen Parkinson-Syndroms, das in einer Vielzahl von Ländern weltweit Anwendung findet. Die Zulassung in den USA erfolgte im Februar 2015.
Selektion geeigneter avancierter Therapien für Patienten im Komplikationsstadium
Wahl einer geeigneten avancierten Therapie
Die Auswahl einer der drei avancierten Therapieformen für geeignete Patienten mit idiopathischem Parkinson-Syndrom im Komplikationsstadium gestaltet sich oft schwierig und erfordert ein großes Maß an Erfahrung mit allen drei Therapieverfahren seitens der behandelnden Ärzte. Motorische und nichtmotorische Symptome sowie verschiedene individuelle Faktoren, wie Alter, Primärsymptome, aber auch der kognitive Status der Patienten, müssen berücksichtigt werden (Tab. 1) [41]. Jedes der avancierten Therapieverfahren hat in unterschiedlichen Studien einen mehr oder weniger starken Einfluss auf die „Off“-Symptomatik, „On-Off“-Fluktuationen und Dyskinesien zeigen können [7, 16, 17, 21, 41]. Trotzdem gestalten sich direkte Vergleiche der drei möglichen Therapieoptionen schwierig. Dies liegt daran, dass es kaum randomisierte vergleichende Studien mit den drei Therapien gibt [12, 16, 41].
Tab. 1. Vergleich der Indikationen für avancierte Therapieformen bei idiopathischem Parkinson-Syndrom
|
Levodopa/Carbidopa-Infusion |
Apomorphin-Infusion |
STN-DBS |
|
|
|
DBS: Deep brain stimulation (tiefe Hirnstimulation); STN: Nucleus subthalamicus
Zwar sind große, vergleichende Studien geplant, doch bleibt bisher lediglich der Vergleich von Ergebnissen kleinerer nicht randomisierter Studien sowie der indirekte Vergleich von Studien mit nur einer Therapieform als Hilfsmittel bei der Wahl einer geeigneten Therapie für die Patienten. Daher erfordert die Entscheidung zur Auswahl eines geeigneten Therapieverfahrens neben der klinischen Erfahrung des behandelnden Arztes für jeden einzelnen Patienten eine Risiko-Nutzen-Abwägung in Hinblick auf die individuelle Indikation und eventuelle Kontraindikationen der infrage kommenden Therapieformen. Dies bedeutet immer eine genaue Berücksichtigung der Wünsche und Möglichkeiten der Patienten. Dabei spielen, neben der sozialen Situation des Patienten, Faktoren wie die Verbesserung der Lebensqualität, technische Aspekte bei der Bedienung der mit jeder Therapieform verbundenen Geräte, der Effekt der Therapie auf motorische und nichtmotorische Symptome, mögliche Nebenwirkungen und die sich aus einer bestimmten Therapieform ergebenden Möglichkeiten und eventuellen Nebeneffekte eine entscheidende Rolle [41].
Duodopa®-Pumpentherapie
Die drei avancierten Therapieoptionen (Duodopa®, Apomorphin und tiefe Hirnstimulation [Deep brain stimulation, DBS]) stellen generell bezüglich motorischer Symptome sehr effektive Behandlungsmöglichkeiten für das Komplikationsstadium des idiopathischen Parkinson-Syndroms dar. Bei manchen Patienten kann es aufgrund bestimmter Kontraindikationen (Tab. 2) vorkommen, dass nicht alle avancierten Therapien anwendbar sind. In solchen Fällen richtet sich die Auswahl der geeigneten Therapie nach den oben genannten Faktoren.
Tab. 2. Vergleich der Kontraindikationen für avancierte Therapieformen bei idiopathischem Parkinson-Syndrom
|
Levodopa/Carbidopa-Infusion |
Apomorphin-Infusion |
STN-DBS |
|
|
|
Patienten, die beispielsweise keine tiefe Hirnstimulation oder Apomorphin-Injektionstherapie wünschen oder die für diese Formen von avancierter Therapie nicht geeignet sind – sei es, dass die tiefe Hirnstimulation (z.B. aufgrund des Alters oder einer Depression) oder Apomorphin (z.B. wegen eines unzureichenden Effekts oder eines erhöhten Risikos für Impulskontrollstörungen) weniger geeignet oder gar kontraindiziert sind –, haben dann trotzdem weiterhin die Möglichkeit, eine intraduodenale/intrajejunale Infusionstherapie zu erhalten.
Die Duodopa®-Pumpentherapie eignet sich insbesondere für Patienten im Komplikationsstadium, die trotz eines generell guten Ansprechens auf Levodopa nicht mehr von einer oralen Therapie, Pflastern oder einer Apomorphin-Injektionstherapie (z.B. Apo-go®-Pen) profitieren, bzw. bei deren Dyskinesien und „On-Off“-Fluktuationen die orale Therapie keinen akzeptablen Effekt mehr auf die Symptomatik zeigt. Bei Patienten, die sich für eine Duodopa®-Pumpentherapie entscheiden, sollte vorab geklärt werden, inwieweit eine Bedienung der Pumpe vonseiten des Patienten oder eines Zugehörigen erfolgen kann, ansonsten muss gegebenenfalls die Organisation eines Pflegediensts erfolgen, der diese Aufgabe übernimmt.
Folglich ist auch eine ausgeprägte Demenz als Kontraindikation für die Anlage einer Duodopa®-Pumpe zu werten, ebenso wie alle Erkrankungen, bei denen sich Operationen im Bereich des oberen Gastrointestinaltrakts verbieten.
Pharmakokinetik der Levodopa/Carbidopa-Infusionstherapie
Das primäre Ziel einer Therapie mit einer intraduodenalen/intrajejunalen Levodopa/Carbidopa-Infusion ist das Erreichen stabiler Levodopa-Spiegel im Plasma. Dies soll eine kontinuierliche Stimulation der Dopamin-Rezeptoren im Bereich der nigro-striatalen Bahnen bewirken. Mehrere Untersuchungen legen dabei den Schluss nahe, dass der Levodopa-Plasmaspiegel gut mit dem motorischen Status und daher möglicherweise auch mit dem zentralen Rezeptorbesatz korreliert [26, 38, 39]. Bereits in frühen Studien hatte sich weiterhin gezeigt, dass die Applikationsart von Levodopa einen nachweisbaren Effekt auf die Konzentration über die Zeit hatte. Mit der Infusionstherapie erreichte man stabilere Levodopa-Plasmakonzentrationen als beispielsweise mit der oralen Einnahme von schnell freisetzenden Präparaten oder von Retard-Präparaten [4, 22].
In neueren Studien konnte zudem gezeigt werden, dass sich eine Dosisreduktion um bis zu 20% bei der Duodopa®-Pumpentherapie erreichen ließ, wenn zusätzlich ein Catechol-O-Methyltransferase(COMT)-Inhibitor gegeben wurde. Dabei wurde die Stabilität der Plasmakonzentration des Levodopa nicht wesentlich beeinflusst. Möglicherweise könnte dies als Nebeneffekt zu einer Vermeidung von Polyneuropathien führen, die bei einigen Patienten unter Levodopa-Therapie beobachtet wurden [24].
Chirurgisches Anlageverfahren, Pumpe und Sondensystem
Eine Behandlung mittels enteraler Levodopa-Infusion erfordert die Einlage einer PEJ-Sonde in den proximalen Anteil des Duodenums oder Jejunums. Einen Überblick über die orthotope Lage aller benötigten technischen Geräte vermittelt Abbildung 1. Zur Anlage wird eine perkutane endoskopische Gastrostomie/Gastrojejunostomie (PEG/PEJ) durchgeführt. Die Rate an peri- bzw. postoperativen Komplikationen nach dieser Art von Eingriff ist gering. Zudem wird bei der PEG/PEJ-Anlage keine Intubationsnarkose benötigt, was einen nicht zu unterschätzenden Vorteil dieser Methode darstellt. Nichtsdestoweniger handelt es sich bei der PEG/PEJ-Anlage um einen chirurgischen Eingriff, der insbesondere bei Patienten mit Parkinson-bedingter Dysphagie mit besonderer Vorsicht erfolgen muss, da es infolge eines Eingriffs zu einer Aspirationspneumonie kommen kann. Im Vergleich mit konventionellen chirurgischen Gastrostomien sind die Komplikations-, Morbiditäts- und Mortalitätsraten bei PEG/PEJ-Anlagen geringer [15, 27]. Bei der gefürchtetsten Komplikation nach PEG/PEJ-Anlage handelt es sich, mit einer Häufigkeit von unter 1%, um die Entstehung einer Peritonitis mit einem möglichen letalen Ausgang. Zur bestmöglichen Vermeidung dieses und anderer peri-/postoperativer Komplikationen sollten die zur Duodopa®-Pumpentherapie erforderlichen Eingriffe in Abteilungen mit sorgfältig geschultem und erfahrenem Personal erfolgen. Weiterhin kann vor einer Entscheidung bezüglich einer permanenten Versorgung und einem damit verbundenen chirurgischen Eingriff eine Testphase mit nasoduodenaler Sonde erfolgen. Technische Probleme mit Pumpen oder Sonden sind im Vergleich mit den chirurgischen peri-/postoperativen Komplikationen öfter Ursache für eine längere oder erneute Hospitalisation der Patienten. Dabei stellte die Dislokation der Sondenspitze in den Anfangsjahren der Duodopa®-Pumpentherapie (1991 bis 2002) ein häufiges Problem dar, das durch die Entwicklung neuer Sonden mit distalem „Pig-tail“-Ende (siehe Abb. 1) seit 2003 in seiner Häufigkeit deutlich reduziert werden konnte [14, 19, 21]. Bei einigen Patienten wurde das Auftreten von chronisch progredienten, milden und überwiegend sonsorischen Polyneuropathien unter kontinuierlicher Levodopa/Carbidopa-Infusionstherapie beobachtet. Dies wurde im Zusammenhang mit kumulativen Levodopa-Dosen, niedrigen Vitamin-B12- sowie hohen Homocystein- und Methylmalonsäure-Spiegeln beobachtet [18, 39]. Die Duodopa®-Fachinformation gibt einen Mangel an Vitamin B6 und Vitamin B12 sowie einen erhöhten Homocysteinspiegel im Blut als häufige Nebenwirkung an (1 bis 10% der Patienten). Die Bestimmung des Vitamin-B12/B6-Spiegels vor Beginn der Therapie, Supplementation und Kontrollen im Verlauf sind zu empfehlen.
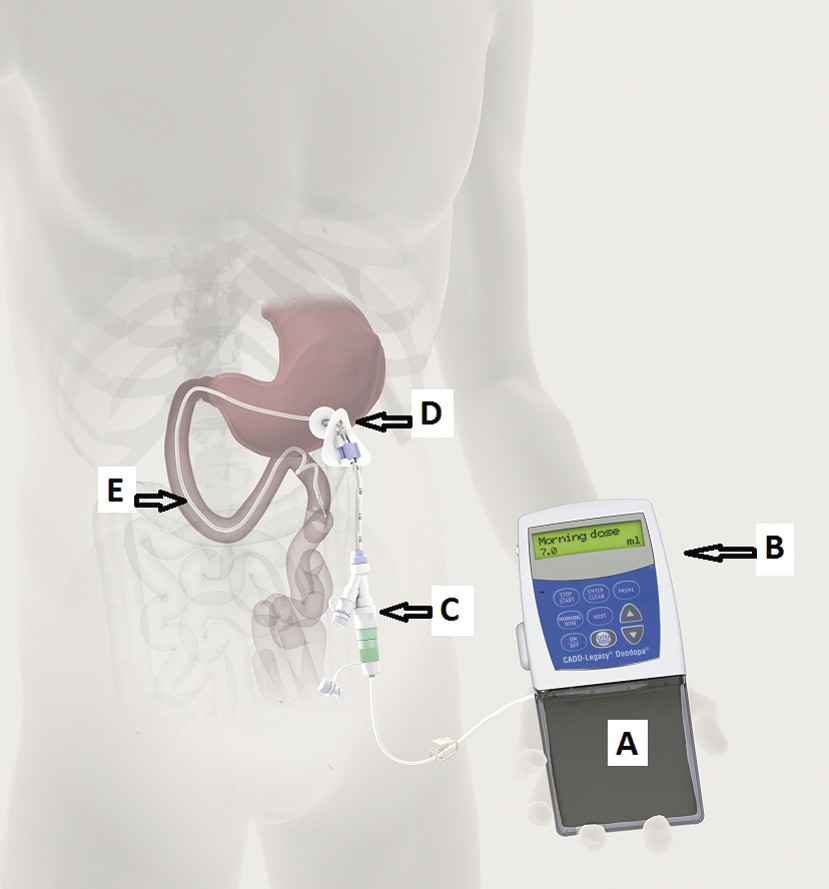
Abb. 1. Einzeldarstellung Anlage einer Duodopa®-Pumpe [Grafik: AbbVie] A: Duodopa®-Container, B: Pumpe, C: Verbindungsstück, D: gastraler Port, E: intestinale Sonde mit Pig-tail-Ende
Weiterhin können sich Schwierigkeiten mit den Verbindungsstücken und Hypergranulationen am Stoma ergeben, Komplikationen mit letalem Ausgang sind selten [21, 27, 29].
Klinik unter Behandlung mit Duodopa®
Motorische Symptome
Ein Hauptanliegen der kontinuierlichen Levodopa/Carbidopa-Infusionstherapie ist eine Verbesserung der motorischen Beschwerden. Kontrollierte Studien, die die intraduodenale/intrajejunale Infusionstherapie mit der oralen Levodopa-Therapie verglichen, konnten zeigen, dass sich unter einer Duodopa®-Pumpentherapie der klinische Status der Patienten stabilisierte. Vor Kurzem wurden diese Beobachtungen in der ersten randomisierten und doppelblinden Vergleichsstudie zwischen oraler Therapie und Duodopa®-Pumpentherapie erneut bestätigt. Dabei war insbesondere zu beobachten, dass sich die Fluktuationen der motorischen Funktion in der Duodopa®-Pumpentherapie-Gruppe deutlich besserten, die durchschnittlichen „Off“-Zeiten wurden reduziert (Abnahme im Durchschnitt um 4,04 Stunden) und zudem eine Zunahme der Zeit im guten „On“ (Zunahme im Durchschnitt 4,11 Stunden) erreicht [29].
Die ersten Ergebnisse der GLORIA-Studie, einer Langzeit-Beobachtung von 372 Patienten unter Duodopa®-Pumpentherapie, zeigten nach den ersten zwölf Monaten bei 170 Patienten eine deutliche Reduktion der UPDRS-Werte in den Teilen II und III (Unified Parkinson Disease Rating Scale; „Aktivitäten des täglichen Lebens“ und „Motorische Untersuchung“) bei zusätzlicher Verringerung der Dyskinesien und „Off“-Zeiten [2]. Diese Beobachtungen konnten bisher in verschiedenen Studien mit unterschiedlichen Laufzeiten, Instrumenten und Beobachtungsschwerpunkten gemacht werden (Abb. 2) [8, 9, 23, 25, 31–35, 42, 43].
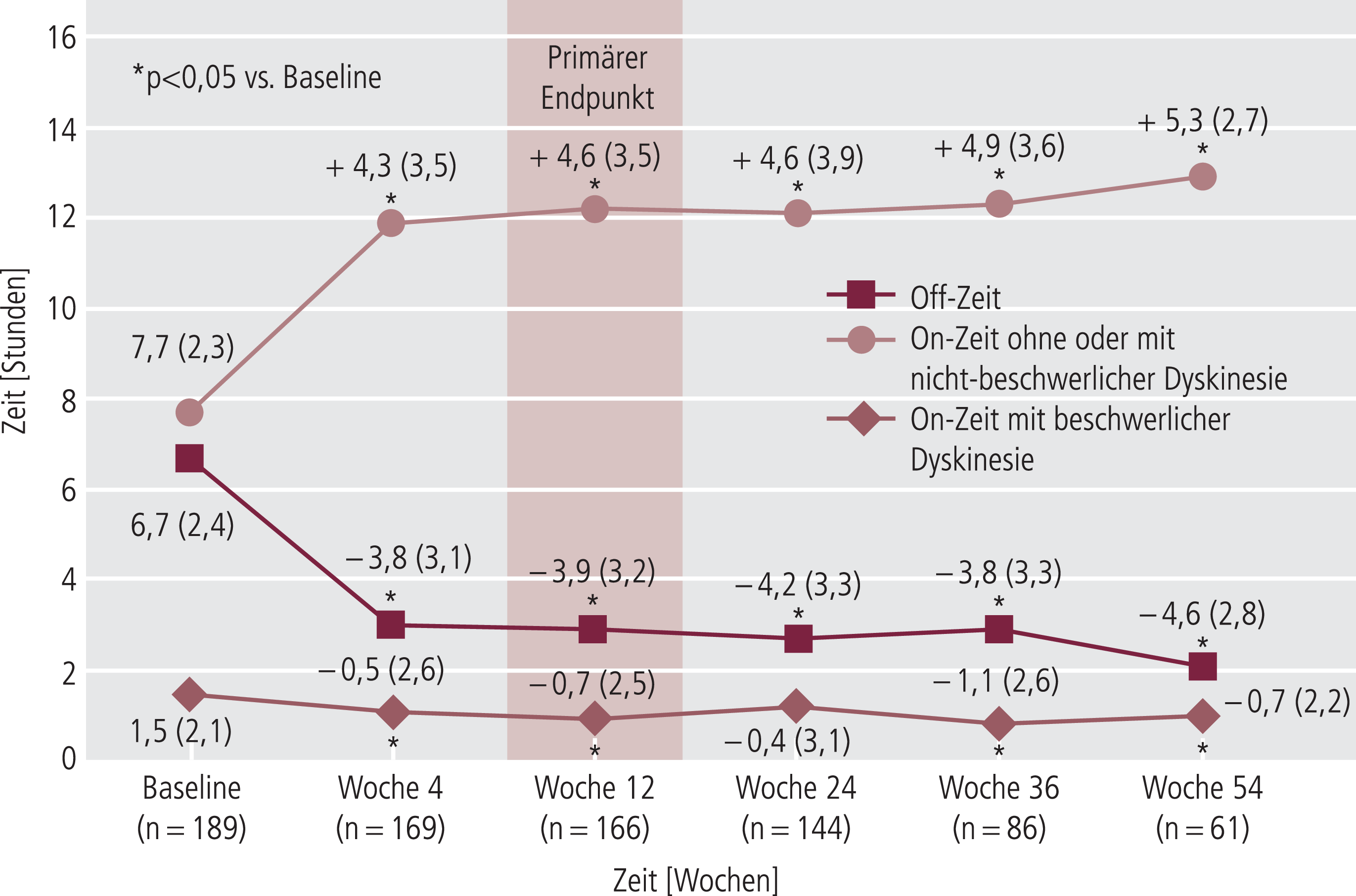
Abb. 2. Veränderungen der durchschnittlichen täglichen „On“- und „Off“-Zeiten unter Duodopa®-Pumpentherapie [9]; Baseline-Wert bzw. Veränderung jeweils als Mittelwert (Standardabweichung)
Nichtmotorische Symptome
Für den Bereich der nichtmotorischen Symptome konnte die kontinuierliche Therapie mit Levodopa/Carbidopa-Gel in Studien ebenfalls eine ausgeprägte Besserung im Vergleich zur oralen Therapie im Komplikationsstadium des idiopathischen Parkinson-Syndroms zeigen. Ein positiver Effekt bei Depression und anderen psychischen Symptomen wurde beobachtet. Eine Verbesserung der subjektiven Schlafqualität und eine Abnahme der Tagesmüdigkeit konnte unter Duodopa®-Pumpentherapie nachgewiesen werden, wenngleich größere Studien mit polysomnographischer Diagnostik gebraucht werden, um die Ergebnisse zu verifizieren und die zugrundeliegenden Mechanismen genau zu klären [8, 35, 44]. Die EuroInf-Studie konnte bei bis zu drei Viertel der Patienten mit kontinuierlicher Levodopa/Carbidopa-Infusionstherapie deutliche Verbesserungen der nichtmotorischen Symptome insbesondere bei gastrointestinalen und urologischen Problemen sowie bei Schlaf und Erschöpfungszuständen beobachten [16].
Lebensqualität (Quality of Life, QoL)
Die Duodopa®-Pumpentherapie konnte in verschiedenen Studien sehr gute Effekte auf die Lebensqualität (Health related Quality of Life [HrQoL]) zeigen (Tab. 3). Eine Korrelation zwischen der Verbesserung motorischer Symptome und der HrQoL wurde mithilfe des PDQ(Parkinson’s Disease Questionnaire)-39 oder dem PDQ-8 nachgewiesen [8, 43]. Weitere Studien, die sich mit dieser Fragestellung und individueller Lebensqualität befassen, werden derzeit durchgeführt.
Tab. 3. Ergebnisse von Studien zur Verbesserung der gesundheitsbezogenen Lebensqualität (Health related quality of life [HrQoL]) unter Duodopa® (seit 2009)
|
Referenz |
n |
Ergebnisse im HrQoL |
|
Antonini et al., 2013 [2] |
73 |
Baseline: 53,3±21,7 Mean of the LV: 47,0±15,2 (beides auf PDQ-8) |
|
Devos, 2009 |
91 |
89,3% der Patienten berichten von einer moderaten oder großen Verbesserung der Lebensqualität |
|
Fernandez et al., 2013 |
192 (24 abgebrochen) |
Bedeutende und anhaltende Verbesserung versus Baseline im PDQ-39 |
|
Foltynie et al., 2013 |
12 (1 abgebrochen) |
Baseline: 49,7 (10,4) 1-Monats-Follow-up: 41,3 (11,1) 3-Monats-Follow-up: 35,8 (13,.3) Latest Follow-up: 38,7 (11,2) (alle auf PDQ-39) |
|
Honig et al., 2009 [11] |
22 |
Veränderung von Baseline bis Monat 6: –23,4 (PDQ-8) |
|
Olanow et al., 2014 |
35 (in der Duodopa®-Gruppe) |
PDQ-39 Veränderung von Baseline bis Woche 12: –10,9 (3,3) |
|
Puente et al., 2010 |
9 |
Baseline: 73,2±11,7 18 Monate: 45,7±21,7 (PDQ-39) |
|
Pålhagen et al., 2012 |
27 |
Baseline: 33,6 (10,8) 12-Monats-Follow-up: 28,8 (12,8) (n=23) (PDQ-39) |
|
Santos-Garcia et al., 2012 [37] |
11 (1 abgebrochen; 1 für Follow-up verloren) |
Baseline: 53,7±11,9 31 Monate: 33,6±12,8 (PDQ-39) |
|
Zibetti et al., 2013 |
17 |
Baseline: 59,2 (18,7) 3-Jahres-Follow-up: 43,1 (13,9) (PDQ-39) |
|
Zibetti et al., 2014 |
59 (7 verstorben, 11 abgebrochen, bei 39 Patienten wurde die Lebensqualität beurteilt) |
Große Verbesserung: 17 (44%) Moderate Verbesserung: 19 (48%) Geringe Verbesserung: 3 (8%) |
LV: Last Value (Durchschnittswert der letzten berichteten Erfassung); PDQ: Parkinson’s Disease Questionnaire
Ausblick auf die zukünftige Entwicklung
Die kontinuierliche Levodopa/Carbidopa-Therapie befindet sich in stetiger Weiterentwicklung. Dabei spielen neben den pharmakologischen vor allem die technischen Aspekte eine wichtige Rolle. Der Fokus liegt auf der Verbesserung der Pumpen und Infusionssysteme, mit kleineren, leistungsfähigeren Pumpen.
Zusammenfassung
Die kontinuierliche Levodopa/Carbidopa-Infusionstherapie stellt heute neben der Apomorphin-Pumpentherapie und der tiefen Hirnstimulation eine etablierte Behandlungsmöglichkeit für das idiopathische Parkinson-Syndrom im Komplikationsstadium dar. Studien konnten belegen, dass mit dieser Form von avancierter Therapie erhebliche Verbesserungen für Parkinson-Patienten in den Bereichen der motorischen Fluktuationen, Dyskinesien, nichtmotorischen Symptome und der Lebensqualität erreicht werden können. Die Auswahl geeigneter Patienten für dieses Therapieverfahren orientiert sich dabei an den jeweiligen Indikationen und Kontraindikationen sowie den Ressourcen und sozialen Gegebenheiten des Patienten. Darüber hinaus erfordert dies auch eine große Erfahrung des behandelnden Arztes im Umgang mit allen drei zur Verfügung stehenden Therapieformen und ihren jeweiligen Risikoprofilen, damit die Therapie den größtmöglichen Nutzen für den Patienten zeigt.
Trotz einiger Erfahrung mit diesem Therapieverfahren und guter Therapieergebnisse besteht weiterhin Bedarf an Studien, unter anderem um den Effekt der kontinuierlichen Levodopa/Carbidopa-Infusionstherapie auf die nichtmotorischen Symptome besser abbilden zu können. Des Weiteren sollte geprüft werden, ob und wie ein nächtlicher Einsatz von Duodopa®-Pumpen erfolgen kann und auch, ab wann mit dem Einsatz dieser avancierten Therapie im Krankheitsverlauf begonnen werden sollte. Dies würde auch dazu beitragen, den Effekt der Therapie direkt mit der Apomorphin-Infusionstherapie und der tiefen Hirnstimulation vergleichen zu können.
Das Hauptziel der Infusionstherapie mit Levodopa/Carbidopa-Gel liegt in der Stabilisierung der Plasmakonzentration des Levodopas. Dafür wird, nach der chirurgischen Anlage einer PEJ/PEG-Sonde, mittels einer Duodopa®-Pumpe das Gel gezielt an den Ort der intestinalen Aufnahme im Bereich des proximalen Jejunums eingebracht. In verschiedenen Studien konnte unter dieser Therapie eine deutliche Verbesserung der motorischen und nichtmotorischen Symptome beobachtet werden. Weiterhin konnte auch eine Verbesserung der Health related Quality of Life bei mittels Duodopa®-Pumpentherapie behandelten Patienten erfasst werden. Bei der kontinuierlichen Levodopa/Carbidopa-Infusionstherapie handelt es sich um ein erprobtes und sehr sicheres Therapieverfahren, unerwünschte Nebenwirkungen der Therapie treten selten auf und Komplikationen betreffen größtenteils Probleme technischer Natur. Eine kontinuierliche Weiterentwicklung der Pumpen und Sondensysteme findet statt.
Interessenkonflikterklärung
CE hat keine Honorare für Berater- oder Vortragstätigkeiten erhalten.
HH hat von AbbVie, Lundbeck, Nordic Infucare, Orion Pharma, Genzyme und Sanofi Honorare für Beratertätigkeiten erhalten.
PO hat von AbbVie, Britannia, Lundbeck, Nordic Infucare, Orion Pharma, und UCB Honorare für Berater- und Vortragstätigkeiten erhalten.
Literatur
1. Antonini A, Isaias IU, Rodolfi G, Landi A, et al. A 5-year prospective assessment of advanced Parkinson disease patients treated with subcutaneous apomorphine infusion or deep brain stimulation. J Neurol 2011;258:579–85.
2. Antonini A, Odin P, Opiano L, Tomantschger V, et al. Effect and safety of duodenal levodopa infusion in advanced Parkinson’s disease: a retrospective multicenter outcome assessment in patient routine care. J Neural Transm (Vienna) 2013;120:1553–8.
3. Antonini A, Yegin A, Preda C, Poewe W. Global long-term registry on efficacy and safety of DUODOPA in patients with advanced Parkinson’s disease in routine care (GLORIA): 12-month interim findings. Neurology 2014;10(Suppl S7.005).
4. Bredberg E, Nilsson D, Johansson K, Aquilonius SM, et al. Intraduodenal infusion of a water-based levodopa dispersion for optimisation of the therapeutic effect in severe Parkinson’s disease. Eur J Clin Pharmacol 1993;45:117–22.
5. Cotzias GC, Van Woert MH, Schiffer LM. Aromatic amino acids and modification of Parkinsonism. N Engl J Med 1967;276:374–9.
6. Devos D; French DUODOPA Study Group. Patient profile, indications, efficacy and safety of duodenal levodopa infusion in advanced Parkinson’s disease. Mov Disord 2009;24:993–1000.
7. Elia AE, Dollenz C, Soliveri P, Albanese A. Motor features and response to oral levodopa in patients with Parkinson’s disease under continuous dopaminergic infusion or deep brain stimulation. Eur J Neurol 2012;19:76–83.
8. Fasano A, Ricciardi L, Lena F, Bentivoglio AR, et al. Intrajejunal levodopa infusion in advanced Parkinson’s disease: long-term effects on motor and non-motor symptoms and impact on patient’s and caregiver’s quality of life. Eur Rev Med Pharmacol Sci 2012;16:79–89.
9. Fernandez HH, Vanagunas A, Odin P, Espay AJ, et al. Levodopa-carbidopa intestinal gel in advanced Parkinson’s disease open-label study: Interim results. Parkinsonism Relat Disord 2013;19:339–45.
10. Foltynie T, Magee C, James C, Webster GJ, et al. Impact of duodopa on quality of life in advanced Parkinson’s disease: a UK case series. Parkinsons Dis 2013;2013:362908.
11. Honig H, Antonini A, Martinez-Martin P, Forgacs I, et al. Intrajejunal levodopa infusion in Parkinson’s disease: a pilot multicenter study of effects on nonmotor symptoms and quality of life. Mov Disord 2009;24:1468–74.
12. Kulisevsky J, Luquin MR, Arbelo JM, Burguera JA, et al. Advanced Parkinson’s disease: Clinical characteristics and treatment. Part II. Neurologia 2013;28:558–83.
13. Kurlan R, Rubin AJ, Miller C, Rivera-Calimlim L, et al. Duodenal delivery of levodopa for on-off fluctuations in parkinsonism: Preliminary observations. Ann Neurol 1986;20:262–5.
14. Lai CW, Barlow R, Barnes M, Hawthorne AB. Bedside placement of nasojejunal tubes: a randomised-controlled trial of spiral- vs. straight-ended tubes. Clin Nutr 2003;22:267–70.
15. Ljungdahl M, Sundbom M. Complication rate lower after percutaneous endoscopic gastrostomy than after surgical gastrostomy: a prospective, randomized trial. Surgical Endoscopy And Other Interventional Techniques 2006;20:1248–51.
16. Martinez-Martin P, Reddy P, Katzenschlager R, Antonini A, et al. EuroInf: A multicenter comparative observational study of apomorphine and levodopa infusion in Parkinson’s disease. Mov Disord 2014; doi:10.1002/mds.26067.
17. Merola A, Zibetti M, Angrisano S, Rizzi L, et al. Comparison of subthalamic nucleus deep brain stimulation and Duodopa in the treatment of advanced Parkinson’s disease. Mov Disord 2011;26:664–70.
18. Müller T, Jugel C, Ehret R, Ebersbach G, et al. Elevation of total homocysteine levels in patients with Parkinson’s disease treated with duodenal levodopa/carbidopa gel. J Neural Transm 2011;118:1329–33.
19. Nyholm D. Enteral levodopa/carbidopa gel infusion for the treatment of motor fluctuations and dyskinesias in advanced Parkinson’s disease. Expert Rev Neurother 2006;6:1403–11.
20. Nyholm D. Pharmacokinetic optimisation in the treatment of Parkinson’s disease. Clin Pharmacokinet 2006;45:109–36.
21. Nyholm, D. Update on levodopa/carbidopa intestinal gel infusion. Eur Neurol Rev 2012;7:13–6.
22. Nyholm D, Askmark H, Gomes-Trolin C, Knutson T, et al. Optimizing levodopa pharmacokinetics: intestinal infusion versus oral sustained-release tablets. Clin Neuropharmacol 2003;26:156–63.
23. Nyholm D, Aquilonius SM. Levodopa infusion therapy in Parkinson disease: state of the art in 2004. Clin Neuropharmacol 2004;27:245–56.
24. Nyholm D, Johansson A, Lennernäs H, Askmark H. Levodopa infusion combined with entacapone or tolcapone in Parkinson disease: a pilot trial. Eur J Neurol 2012;19:820–6.
25. Nyholm D, Klangemo K, Johansson A. Levodopa/carbidopa intestinal gel infusion long-term therapy in advanced Parkinson’s disease. Eur J Neurol 2012;19:1079–85.
26. Nyholm D, Lennernäs H, Gomes-Trolin C, Aquilonius SM. Levodopa pharmacokinetics and motor performance during activities of daily living in patients with Parkinson’s disease on individual drug combinations. Clin Neuropharmacol 2002;25:89–96.
27. Nyholm D, Lewander T, Johansson A, Lewitt PA, et al. Enteral levodopa/carbidopa infusion in advanced Parkinson disease: long-term exposure. Clin Neuropharmacol 2008;31:63–73.
28. Nyman R, Lundgren D, Nyholm D. Soft tissue-anchored transcutaneous port attached to an intestinal tube for long-term gastroduodenal infusion of levodopa/carbidopa in Parkinson disease. J Vasc Interv Radiol 2009;20:500–5.
29. Olanow CW, Kieburtz K, Odin P, Espay AJ, et al. Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson’s disease: a randomised, controlled, double-blind, double-dummy study. Lancet Neurol 2014;13:141–9.
30. Olivares A, Collado D, Muñoz-Navas M, Calvo M, et al. Complications of percutaneous endoscopic gastrostomy-jejunostomy for levodopa/carbidopa infusion in advanced Parkinson’s disease. Gastroenterol Insights 2012;4:13–5.
31. Pålhagen SE. Long-term study of intraduodenal levodopa (Duodopa®) in patients with advanced Parkinson’s disease. Mov Disord 2013;28:167–8.
32. Pålhagen SE, Dizdar N, Hauge T, Holmberg B, et al. Interim analysis of long-term intraduodenal levodopa infusion in advanced Parkinson disease. Acta Neurol Scand 2012; 126:29–33.
33. Pickut BA, van der Linden C, Dethy S, Van De Maele H, et al. Intestinal levodopa infusion: the Belgian experience. Neurol Sci 2014;35:861–6.
34. Puente V, De Fabregues O, Oliveras C, Ribera G, et al. Eighteen month study of continuous intraduodenal levodopa infusion in patients with advanced Parkinson’s disease: impact on control of fluctuations and quality of life. Parkinsonism Relat Disord 2010;16:218–21.
35. Reddy P, Martinez-Martin P, Rizos A, Martin A, et al. Intrajejunal levodopa versus conventional therapy in Parkinson disease: motor and non-motor effects. Clin Neuropharmacol 2012;35:205–7.
36. Roe DL. From DOPA to Parkinson’s disease: The early history of dopamine research. J Hist Neurosci 1997;6:291–301.
37. Santos-García D, Sanjurjo LF, Macias M, Llaneza M, et al. Long-term exposure to duodenal levodopa/carbidopa infusion therapy improves quality of life in relation especially to mobility, activities of daily living, and emotional well-being. Acta Neurol Scand 2012;125:187–91.
38. Shoulson IRA, Glaubiger GA, Chase TN. On-off response. Clinical and biochemical correlations during oral and intravenous levodopa administration in parkinsonian patients. Neurology 1975;25:1144–8.
39. Tedroff J, Pedersen M, Aquilonius SM, Hartvig P, et al. Levodopa-induced changes in synaptic dopamine in patients with Parkinson’s disease as measured by [11C] raclopride displacement and PET. Neurology 1996;46:1430–6.
40. Uncini A, Eleopra R, Onofrj M. Polyneuropathy associated with duodenal infusion of levodopa in Parkinson’s disease: features, pathogenesis and management. J Neurol Neurosurg Psychiatry 2014;30:85–6.
41. Volkmann J, Albanese A, Antonini A, Chaudhuri KR, et al. Selecting deep brain stimulation or infusion therapies in advanced Parkinson’s disease: an evidence-based review. J Neurol 2013;260:2701–14.
42. Zibetti M, Merola A, Artusi CA, Rizzi L, et al. Levodopa/carbidopa intestinal gel infusion in advanced Parkinson’s disease: a 7-year experience. Eur J Neurol 2014;21:312–8.
43. Zibetti M, Merola A, Ricchi V, Marchisio A, et al. Long-term duodenal levodopa infusion in Parkinson’s disease: a 3-year motor and cognitive follow-up study. J Neurol 2013;260:105–14.
44. Zibetti M, Rizzone M, Merola A, Angrisano S, et al. Sleep improvement with levodopa/carbidopa intestinal gel infusion in Parkinson disease. Acta Neurol Scand 2013;127:28–32.
Cand. med. Claas Ehlers, Dr. med. Holger Honig, Prof. Dr. med. Per Odin, Klinik für Neurologie und Neurophysiologie Klinikum Bremerhaven, Postbrookstraße 103, 27574 Bremerhaven, E-Mail: claas.ehlers@uni-wh.de; E-Mail: per.odin@med.lu.se
Duodenal/jejunal levodopa/carbidopa infusion
For patients with advanced idiopathic Parkinson’s disease and severe progressive motor complications with failure of adjusting oral medication, three device-aided therapy options are available – the deep brain stimulation (DBS) and one of two continuous dopaminergic stimulations: the continuous subcutaneous apomorphine infusion or the continuous duodenal/jejunal levodopa/carbidopa infusion. Choosing one of the above mentioned advanced therapy options requires consideration of different individual factors of each patient, such as cognitive and neuropsychiatric status, motor and non-motor symptoms and age. This article further describes the continuous duodenal/jejunal levodopa/carbidopa infusion.
Key words: Idiopathic Parkinson’s disease (IPD), continuous dopaminergic stimulation (CDS), Duodopa®
Psychopharmakotherapie 2016; 23(01)
