Hans-Peter Volz, Werneck
Die Schizophrenie ist eine chronische Erkrankung und zählt zu den 20 führenden Erkrankungen, die zu Arbeitsunfähigkeit führen [1]. Die Hauptbehandlungsmethode stellen Antipsychotika dar, die – als Gruppe betrachtet – sehr wirksam sind.
Allerdings ist die medikamentöse Non-Adhärenz bei schizophrenen Patienten ein gravierendes Problem [16, 19, 22, 31]. Sie ist von allen bekannten Faktoren der stärkste Prädiktor für das Auftreten einer erneuten schizophrenen Episode [21]. Das frühzeitige Auftreten einer erneuten Episode ist nicht nur wegen der damit verbundenen Beeinträchtigungen durch die bestehende akute Symptomatik ungünstig; mit Zunahme der Zahl der Exazerbationen kommt es außerdem trotz entsprechender Behandlung zu einer immer längeren Zeit bis zum Erreichen der Remission und der Anteil der Patienten, die eine Remission erreichen, wird immer geringer [23]. Die langfristige Prognose ist weitgehend vom Ausmaß der Negativsymptomatik und vor allem der Kognitionsstörungen, insbesondere von Störungen des Arbeitsgedächtnisses, abhängig [47].
Mit der Einführung der atypischen Antipsychotika in die Therapie der Schizophrenie war die Hoffnung verbunden, dass aufgrund der besseren Verträglichkeit dieser Substanzen die Adhärenz zunehmen würde. Diese Erwartung wurde jedoch nur teilweise erfüllt. So berichten Dolder et al. [15] zwar über einen statistisch signifikanten Unterschied in der regelmäßigen Medikamenteneinnahme zwischen den Behandlungen mit typischen (42,6%) und atypischen Antipsychotika (50,1%), aber die Differenz von etwa 8 Prozentpunkten erscheint geringer als erwartet. Allerdings zeigen auch die modernen Antipsychotika gravierende Nebenwirkungen.
Es ist eine Reihe atypischer Antipsychotika auf dem Markt, von denen einige bereits patentfrei sind, weitere werden folgen. Insgesamt werden mit Antipsychotika weltweit 14,5 Milliarden US-Dollar/Jahr umgesetzt [4], sodass es andererseits nicht verwundert, dass weitere Neuentwicklungen vor der Zulassung stehen. Die Markteinführung ist allerdings in Deutschland durch das komplexe Verfahren gemäß AMNOG (Arzneimittelmarkt-Neuordnungsgesetz) kompliziert. Nach der Marktzulassung ist gegenüber dem Gemeinsamen Bundesausschuss (GBA) zu zeigen, dass ein therapeutischer Zusatznutzen besteht, von dessen Ausmaß, wenn er überhaupt demonstriert werden kann, der zu erzielende Preis im Wesentlichen abhängt.
Vor dem Hintergrund dieser komplexen Situation soll die Datenlage für ein neues Atypikum, Lurasidon, das bereits seit 2010 auf dem US-amerikanischen Markt zur Verfügung steht, dargestellt werden. Hierbei werden die Daten im Rahmen der Schizophrenie-Studien berichtet; Daten zu Wirksamkeit bei bipolaren Erkrankungen werden nicht berücksichtigt (siehe hierfür [13, 27, 46]).
Rezeptorpharmakologie/Tierpharmakologie
Lurasidon ist ein starker D2- und 5-HT2A-Antagonist, zusätzlich weist es eine ausgeprägte Bindung zum 5-HT7-Rezeptor auf und ist ein partieller Agonist am 5-HT1A-Rezeptor [12, 26]. Interaktionen mit dem 5-HT1A-Rezeptor werden mit antidepressiven, Interaktionen mit dem 5-HT7-Rezeptor mit prokognitiven Effekten in Zusammenhang gebracht [3, 5]. Daneben wirkt die Substanz am alpha2A- und alpha2Β-(noradrenergen) Rezeptor moderat antagonistisch [8–10, 21]. An histaminergen (H1), muskarinergen, nicotinergen, glutamatergen und Sigma-Rezeptoren weist die Substanz eine nur geringe Bindung auf, auch zeigte sich keine Interaktion am Serotonin- oder Dopamin-Transporter [11, 20, 45]. Tabelle 1 gibt einen Überblick über die Bindungsaffinitäten an unterschiedlichen Rezeptoren im Vergleich zu anderen atypischen Antipsychotika.
Tab. 1. Vergleich der Rezeptorbindungsprofile zwischen Lurasidon und anderen Antipsychotika. Die Werte sind Mittelwerte + S.E.M. von mindestens drei unterschiedlichen Experimenten [mod. nach 20]
|
Rezeptor |
Bindungsaffinität, Kia [nmol/l] |
||||
|
Lurasidon |
Risperidon |
Olanzapin |
Clozapin |
Haloperidol |
|
|
Dopamin D2 |
1,68±0,09 |
2,91±0,16 |
14,4 ± 3,2 |
108±27 |
3,28±0,42 |
|
5-HT1A |
6,75±0,97 (4,0) |
262±21 (90) |
>1000b (>69) |
123±5 (1,1) |
>1000b (>300) |
|
5-HT2A |
2,03±0,46 (1,2) |
0,205±0,066 (0,070) |
5,78±0,89 (0,40) |
9,17±1,46 (0,085) |
84,7±13,1 (26) |
|
5-HT7 |
0,495±0,090 (0,29) |
2,72±0,42 (0,93) |
n. t. |
42,2±12,0 (0,39) |
>1000b (>300) |
|
Noradrenalin α1 |
47,9±7,8 (29) |
1,42±0,09 (0,49) |
22,1±7,7 (1,5) |
17,5±5,0 (0,16) |
17,9±1,5 (5,5) |
|
Noradrenalin α2A |
40,7±7,7 (24) |
13,7±1,1 (4,7) |
n. t. |
147±14 (1,4) |
>1000b (>300) |
|
Noradrenalin α2C |
10,8±0,64 (6,4) |
11,0±1,4 (3,8) |
n. t. |
15,6±2,0 (0,14) |
>1000b (>300) |
|
Histamin H1 |
>1000b (>590) |
3,46±0,17 (1,2) |
3,83±0,52 (0,27) |
2,02±2,02 (0,019) |
330±22 (100) |
|
Muskarinerg |
>1000b (>590) |
>1000b (>340) |
7,6±1,3 (0,53) |
4,9±2,0 (0,045) |
>1000b (>300) |
a Zahlen in Klammern geben das Verhältnis (Ratio) des Ki-Werts zu jenem des Dopamin-D2-Rezeptors an; b IC50-Wert; n. t. =nicht getestet
In einer PET-Studie wurde bei 21 gesunden Probanden der Grad der D2-Rezeptorbesetzung bei unterschiedlichen Lurasidon-Dosen untersucht. Folgende Werte wurden gefunden: 10 mg: 41,0–43,3%, 20 mg: 51,0–54,8%, 40 mg: 63,1–67,5%, 60 mg: 77,4–84,3%; 80 mg: 72,9–78,9%. Unter der Annahme, dass für eine antipsychotische Wirkung eine D2-Rezeptor-Blockade zwischen 60 und 80% notwendig ist, würde dies bedeuten, dass eine Dosis von mindestens 40 mg Lurasidon für eine antipsychotische Wirksamkeit notwendig ist [30].
Lurasidon wird rasch, allerdings nur zu 9 bis 19%, resorbiert, die maximale Plasmakonzentration wird innerhalb von ein bis drei Stunden erreicht [43]. Es besteht eine lineare Korrelation zwischen der aufgenommenen Dosis und den erreichten Plasmaspiegeln im Dosisbereich 20 bis 160 mg. Der Steady-State wird innerhalb von sieben Tagen erreicht. Lurasidon wird zu 99,8% an Proteine gebunden, vor allem an Albumin und Alpha-1-Glykoprotein [30]. Die Eliminationshalbwertszeit liegt bei 20 bis 40 Stunden, nach oraler Gabe einer radioaktiv markierten Dosis wurden etwa 67% der Dosis in den Fäzes und 19% im Urin nachgewiesen [43].
Die Bioverfügbarkeit steht in deutlicher Abhängigkeit von der Nahrungszufuhr. So waren die mittlere maximale Plasmakonzentration und die AUC (Area under the curve) etwa 3- bzw. 2-mal höher, wenn Lurasidon mit Nahrung eingenommen wurde im Vergleich zur Einnahme ohne Nahrung [43]. Hierbei wurde die Bioverfügbarkeit durch eine Erhöhung der Nahrungszufuhr von 350 auf 1000 kcal nicht zusätzlich verändert; auch der Fettgehalt der Nahrung blieb ohne Einfluss.
Klinisch relevant ist der ausgeprägte Metabolismus der Substanz über CYP3A4. Es entstehen zwei aktive Metaboliten (ID-14283 und ID-14326) in geringer Konzentration, zwei inaktive Metaboliten (ID-20219 und ID-20220) in höherer und ein weiterer inaktiver Metabolit (ID-11614) in geringer Konzentration [6, 7, 30]. Lurasidon ist kein Substrat von CYP1A1, CYP1A2, CYP2A6, CYP4A11, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 oder CYP2E1 [43].
Aus der ausgeprägten Metabolisierung über CYP3A4 ergeben sich Konsequenzen bezüglich des Interaktionsverhaltens der Substanz.
In den tierpharmakologischen Studien wurden im Wesentlichen Antipsychotika-typische Effekte gezeigt, bemerkenswert erscheint aber, dass in einer Reihe von kognitiven Tests (Object recognition test, Object retrieval with detour task) und Modellen für antidepressive Wirkungen (z.B. Forced swim test) die Substanz deutliche prokognitive bzw. antidepressive Effekte zeigte [45].
Interaktionsstudien
Wie Chiu et al. [6] zusammenfassend darstellen, wurden sieben Phase-I-Interaktionsstudien (single- und multiple-dose) durchgeführt, in zwei 6-wöchigen Phase-III-Studien konnte eine eventuelle Wechselwirkung zwischen Lurasidon und Valproinsäure bzw. Lithium erfasst werden.
Ketoconazol, ein starker Hemmer von CYP3A4, führte zu einem 6,8-fachen Anstieg der Cmax von Lurasidon und einem 9,3-fachen Anstieg der AUC. Diltiazem, ein Calciumkanalblocker zur Hochdrucktherapie, der ein moderater Hemmer von CYP3A4 ist, führte zu 2,1- bzw. 2,2-fachen Anstiegen. Rifampicin, ein starker CYP3A4-Induktor reduzierte diese Parameter auf ein Siebtel bzw. ein Fünftel. Midazolam, ein Substrat von CYP3A4, zeigte bei gleichzeitiger Lurasidon-Gabe einen Anstieg der Cmax von Lurasidon um 21% und der AUC um 44%. Unveröffentlichte präklinische Studien hätten, so Chiu et al., gezeigt, dass Lurasidon auch den Transporter P-Glykoprotein hemmt, Digoxin ist (u.a.) ein Substrat dieses Transporters. Die dargestellten Parameter wurden für Digoxin bei gleichzeitiger Verabreichung zusammen mit Lurasidon um 9 bzw. 13% angehoben, was als klinisch irrelevant gilt.
Es ergaben sich keine signifikanten Interaktionen zwischen Lurasidon und Lithium, Valproinsäure, Ethinylestradiol oder Norelgestromin (dem Hauptmetaboliten von Norgestimat, das zusammen mit Ethinylestradiol als orales Kombinationskontrazeptivum eingesetzt wird).
Hieraus ist zu schließen, dass die gemeinsame Gabe von Lurasidon mit starken Hemmern von CYP3A4 wie Ketoconazol, Clarithromycin, Boceprevir, Cobicistat, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Posaconazol, Ritonavir, Saquinavir, Telaprevir, Telithromycin, Voriconazol ebenso kontraindiziert ist wie mit starken CYP3A4-Induktoren wie Rifampicin, Johanniskraut-Extrakten, Phenytoin, Phenobarbital und Carbamazepin [43, 44].
Bei schwächeren CYP3A4-Hemmern sollte die Lurasidon-Dosis entsprechend vermindert werden, hier gilt 80 mg/Tag als Maximaldosis.
Eine klinisch relevante Interaktion mit Lithium liegt nicht vor [43].
Spezielle Populationen
Bei Patienten mit leichter Leber- oder Nierenfunktionsstörung ist keine Dosisanpassung notwendig [44]. Bei Patienten mit gravierenden Leber- oder Nierenerkrankungen sollte die Dosis von Lurasidon nicht höher als 80 mg/Tag sein [44].
Etwas genauer hat dies Preskorn [37] spezifiziert. Ausgehend von der allgemein anerkannten Schweregradeinteilung von Nieren- und Leberfunktionsstörungen (gering: errechnete Creatinin-Clearance 50 bis <80 ml/min bzw. Child-Pugh-Score [CPS] 5 bis 6 oder Klasse A; mittel: 30 bis <50 ml/min bzw. CPS 7 bis 9 oder Klasse B; schwer: 10 bis <30 ml/min bzw. CPS 10 bis 15 oder Klasse C) gibt er folgende Empfehlung: Für Patienten mit einer moderaten oder schweren renalen oder hepatischen Insuffizienz beträgt die Startdosis 20 mg Lurasidon/Tag, die Maximaldosis für Patienten mit einer mittleren oder schweren renalen Insuffizienz beträgt 80 mg/Tag, für jene mit einer mittleren oder schweren hepatischen Insuffizienz 40 mg/Tag. In der Fachinformation wird hier eine Dosierung von 80 mg/Tag empfohlen [44].
Wirksamkeit – Akutstudien
Zur Akutwirksamkeit liegen sechs ähnlich designte 6-wöchige, Placebo-kontrollierte Studien vor, fünf umfassten einen Dosisbereich von 20 bis 120 mg/Tag, einer umfasste auch die 160-mg/Tag-Dosis (Tab. 2). Fünf dieser Studien zeigten Effektivität, eine Studie [7, 12] wurde als „failed“ klassifiziert, da weder Lurasidon noch der aktive Komparator (Haloperidol) in der Lage war, einen statistisch signifikanten Wirkvorteil im Vergleich zu Placebo zu erzielen. Abbildung 1 zeigt das Hauptergebnis einer Studie, in der Lurasidon in Dosierungen von 80 und 160 mg/Tag im Vergleich mit retardiertem Quetiapin 600 mg und mit Placebo untersucht wurde.
Tab. 2. Übersicht über die Effektivitätsstudien mit Lurasidon [mod. nach 11]
|
Referenz |
Dauer, Design |
Krankheitsstatus |
N (randomisiert) |
Lurasidon-Dosis (n) |
Aktive Kontrolle, Dosis (n) |
N Placebo |
Kommentare in Bezug auf Effektivitätsergebnisse |
|
[35] |
6 Wochen, DBPC |
Akute Schizophrenie |
149 |
40 mg/Tag (50) 120 mg/Tag (49) |
Keine |
50 |
LUR 40 und 120 mg/Tag waren statistisch signifikant effektiver als PLA |
|
[7, 12] |
6 Wochen, DBPC |
Akute Schizophrenie |
356 |
20 mg/Tag (71) 40 mg/Tag (69) 80 mg/Tag (71) |
HAL 10 mg/Tag (73) |
72 |
LUR 20, 40, 80 mg/Tag und HAL 10 mg/Tag unterschieden sich nicht statistisch signifikant von PLA; Studie in den USA durchgeführt. |
|
[32] |
6 Wochen, DBPC |
Akute Schizophrenie |
180 |
80 mg/Tag (90) |
Keine |
90 |
LUR statistisch signifikant effektiver als PLA |
|
[33] |
6 Wochen, DBPC |
Akute Schizophrenie |
500 |
40 mg/Tag (125) 80 mg/Tag (123) 120 mg/Tag (124) |
Keine |
128 |
LUR 80, aber weder 40 noch 120 mg/Tag statistisch signifikant effektiver als PLA. Completers konnten in eine 22-Monate-Verlängerungsstudie gehen [40] |
|
[29] |
6 Wochen, DBPC |
Akute Schizophrenie |
478 |
40 mg/Tag (120) 120 mg/Tag (119) |
OLA 15 mg/Tag (123) |
116 |
LUR 40, 120 mg/Tag und OLA 15 mg/Tag statistisch signifikant effektiver als PLA. Completers (N=298) konnten in eine 6-Monate-Verlängerungsstudie gehen, was auf 254 zutraf [41] |
|
[25] |
6 Wochen, DBPC |
Akute Schizophrenie |
488 |
80 mg/Tag (125) 160 mg/Tag (121) |
QXR 600 mg/Tag (120) |
122 |
LUR 80, 160 mg/Tag und QXR 600 mg/Tag statistisch signifikant effektiver als PLA, Completers (N=353) konnten in eine 1-Jahres-Verlängerungsstudie, auch doppelblind, gehen, was auf 236 zutraf [26] |
|
NCT00711269 [11] |
6 Wochen, DBPC |
Schizophrenie |
447 |
40 mg/Tag (125) 80 mg/Tag (129) |
RIS 4 mg/Tag (64) |
129 |
Weder LUR 40, 80 mg/Tag noch RIS 4 mg/Tag konnten sich statistisch signifikant von PLA differenzieren; die Studie wurde in Japan, Korea und Taiwan durchgeführt |
|
[36] |
3 Wochen, DBPC |
Schizophrenie oder schizo-affektive Störung, nicht-akut |
301 |
120 mg/Tag (150) |
ZIP 80 mg/Tag (151) |
Keine |
Der Anteil an Patienten, die die Studie abbrachen, war ähnlich für LUR und ZIP, auch die Reduktion in den Psychopathologie-Skalen. Ergebnisse über kognitive Parameter wurden separat publiziert [17] |
|
[28] |
6 Wochen, randomisiert, offen, Switch-Studie |
Schizophrenie oder schizo-affektive Störung, nicht-akut |
240 |
40 mg/Tag für zwei Wochen (74); 40 mg/Tag für eine Woche, dann Steigerung auf 80 mg/Tag für eine weitere Woche (88); 80 mg/Tag für zwei Wochen (82); für alle Gruppen dann flexibel |
Keine |
Keine |
Kein Unterschied in der Möglichkeit zu switchen zwischen den Gruppen. Eine weitere Untersuchung [2] erfasste Lebensqualitätsparameter. Von den 196 Patienten, die die Akutstudie beendeten, wurden 148 in eine offene Verlängerungsstudie für weitere 6 Monate eingeschlossen [12] |
|
Langzeitstudien |
|||||||
|
[10] |
1 Jahr |
Schizophrenie oder schizo-affektive Störung, nicht-akut |
629 |
40–120 mg/Tag (427), mittlere Dosis 85 mg/Tag |
RIS 2–6 mg/Tag (202) mittlere Dosis 4,3 mg/Tag |
Keine |
Vergleichbare Verbesserung in den Effektivitätsmaßen, die Rückfallwahrscheinlichkeit war ebenfalls vergleichbar. Die Gesamtzahl der Abbrecher war in der LUR-Gruppe höher als in der RIS-Gruppe |
|
[26] |
1 Jahr |
Schizophrenie |
292 |
40–160 mg/Tag (151 + 56) |
QXR 200–800 mg/Tag (85) |
Keine |
Doppelblinde Verlängerung von Loebel et al. [25]. LUR erwies sich als nicht-unterlegen vs. QXR, zeigte höhere Remissionsraten und ein vermindertes Hospitalisierungsrisiko |
DBPC: doppelblind, Placebo-kontrolliert; HAL: Haloperidol; LUR: Lurasidon; OLA: Olanzapin; PLA: Placebo; QXR: retardiertes Quetiapin; RIS: Risperidon; ZIP: Ziprasidon
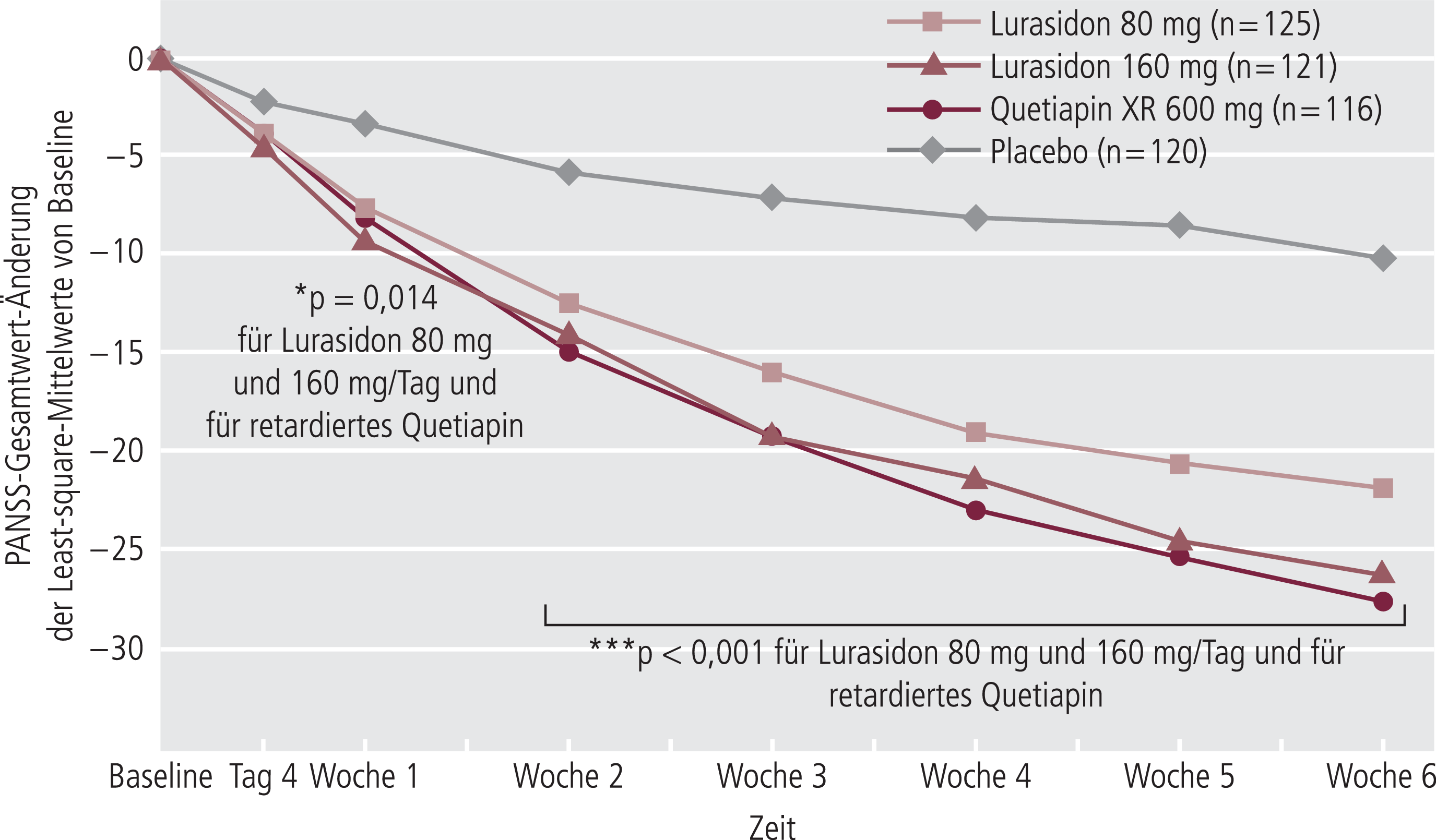
Abb. 1. Wirksamkeit von Lurasidon bei akuter Schizophrenie – Änderung des PANSS-Gesamtwerts (PANSS: Positive and negative syndrome scale) (Mixed-effects model for repeated measures analysis [MMRM]); Intent-to-treat-Patienten; LS means =Least-Square-Mittelwerte) [modifiziert nach 25]
In der Studie von Nasrallah et al. [33] wurden 40, 80 und 120 mg/Tag Lurasidon mit Placebo verglichen; während die 80-mg/Tag-Dosisgruppe eine statistisch signifikante Überlegenheit vs. Placebo zeigte, war dies für die beiden anderen Dosisgruppen nicht der Fall. Die Autoren spekulieren, ob dieses Ergebnis, das im Gegensatz zu den meisten anderen Akutwirksamkeitsstudien steht, mit der außergewöhnlich hohen Placebo-Response in dieser Studie zu tun haben könnte.
Loebel et al. [24] veröffentlichten das Resultat einer gepoolten Metaanalyse zum Fünf-Faktoren-Modell der PANSS (Positive and negative syndrome scale; siehe Tab. 3). Im Fünf-Faktoren-Modell werden negative, positive, kognitive, antriebsgesteigerte und depressive Komponenten der PANSS betrachtet.
Die antipsychotische Effektivität von Lurasidon bewegt sich im Bereich von Olanzapin und retardiertem Quetiapin, den Substanzen, die als aktive Kontrollen verwendet wurden [25, 29].
Tab. 3. Ergebnisse einer gepoolten Analyse der Akutwirksamkeit von Lurasidon, basierend auf dem Fünf-Faktoren-Modell der PANSS (Positive and negative syndrome scale). Die fünf PANSS-Faktoren wurden basierend auf dem MMRM (Mixed-effects model for repeated measures) analysiert. Die Effektstärken wurden mithilfe einer ANCOVA (Analysis of covariance) bestimmt (LOCF [Last observation carried forward] als Endpunkt) [24]
|
PANSS Faktorwerte |
Lurasidon 40 mg/Tag |
Lurasidon 80 mg/Tag |
Lurasidon 120 mg/Tag |
||||||
|
Veränderung zum Ausgangswert |
p-Wert |
Effektstärke |
Veränderung zum Ausgangswert |
p-Wert |
Effektstärke |
Veränderung zum Ausgangswert |
p-Wert |
Effektstärke |
|
|
Positivsymptomatik |
–7,92 |
<0,001 |
0,35 |
–8,48 |
<0,001 |
0,47 |
–8,25 |
<0,001 |
0,42 |
|
Negativsymptomatik |
–5,59 |
<0,001 |
0,41 |
–4,96 |
0,02 |
0,25 |
–5,21 |
0,002 |
0,31 |
|
Desorganisation |
–4,86 |
<0,001 |
0,40 |
–5,10 |
<0,001 |
0,47 |
–5,22 |
<0,001 |
0,50 |
|
Feindseligkeit |
–2,33 |
<0,013 |
0,25 |
–2,58 |
0,002 |
0,33 |
–2,87 |
<0,001 |
0,44 |
|
Depression/Angst |
–3,14 |
0,002 |
0,31 |
–3,23 |
0,002 |
0,35 |
–3,01 |
0,012 |
0,26 |
In einer 3-wöchigen Vergleichsstudie vs. Ziprasidon ohne Placebo-Kontrolle [17, 36] zeigte Lurasidon eine ähnlich ausgeprägte Aktivität wie Ziprasidon. Eine weitere in Asien durchgeführte Studie war „failed“. In dieser 6-Wochen-Studie war Risperidon der aktive Komparator; weder dieser noch Lurasidon unterschieden sich statistisch signifikant von Placebo [8].
Nasrallah et al. [34] analysierten die Veränderung der Depressivität mithilfe einer gepoolten Analyse von vier Akut-Kurzzeitstudien. Auch wurde der Montgomery-Åsberg-Depressionsscore erfasst. Es zeigte sich ein statistisch signifikanter Effekt von Lurasidon auf die depressive Symptomatik. Eine initiale Dosis-Titration ist nicht erforderlich, die Substanz kann sowohl morgens als auch abends als Einmal-Dosis gegeben werden.
Wirksamkeit – Langzeitstudien
In Bezug auf die längerfristige Wirksamkeit wurde die Kurzzeitstudie versus Quetiapin [25] in doppelblindem Design für die Lurasidon- und die Quetiapin-Gruppe verlängert [26]. Lurasidon und retardiertes Quetiapin konnten flexibel über die 12-Monats-Studienperiode dosiert werden (40–160 bzw. 400–800 mg/Tag). Das Design sah einen Non-Inferioritätsansatz vor und in der Tat stellte sich Lurasidon als nicht unterlegen im Vergleich zu retardiertem Quetiapin heraus. Das Rückfallrisiko wurde in der Lurasidon-Gruppe um 27,2% (Hazard-Ratio [HR] 0,728) im Vergleich zu retardiertem Quetiapin gesenkt. Gemäß Kaplan-Meier-Schätzer betrug das Rückfallrisiko für Lurasidon über 12 Monate 0,237 und für retardiertes Quetiapin 0,336, was eine Number needed to treat (NNT) von 11 für Lurasidon im Vergleich zu retardiertem Quetapin ergibt (nicht signifikant). Der PANSS-Score wurde unter Lurasidon signifikant stärker gesenkt als unter retardiertem Quetiapin. In Abbildung 2 ist das Hauptergebnis dieser Studie zusammengefasst.
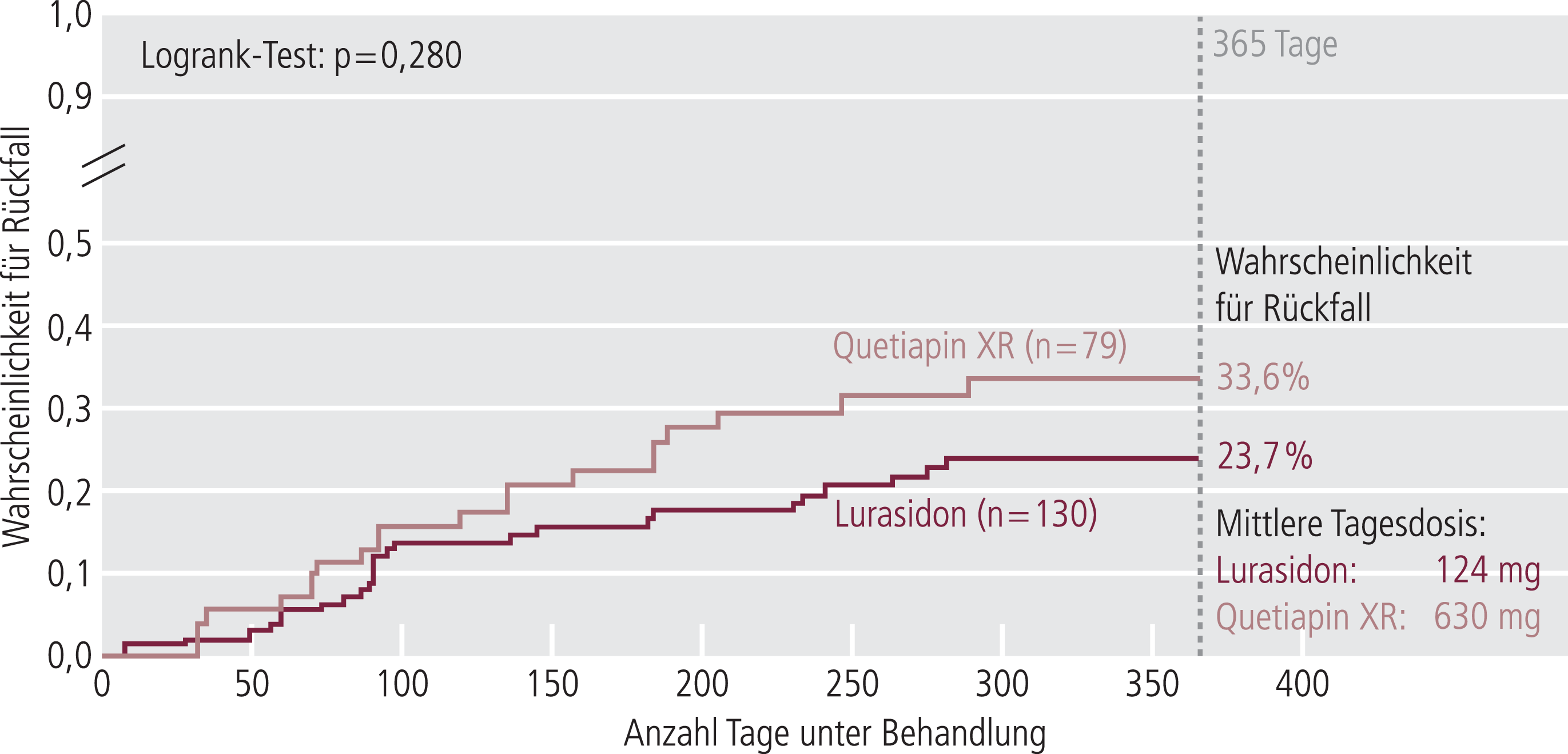
Abb. 2. Kaplan-Meier-Darstellung der Wahrscheinlichkeit, während der 12-monatigen doppelblinden Behandlungsphase (Lurasidon oder Quetiapin retardiert [XR]) einen Rückfall zu erleiden [mod. nach 26]
Mithilfe dieser Daten wurde auch eine probabilistische Modellrechnung der Kosten durchgeführt [38], die für die USA-Preisverhältnisse eine Kostenersparnis von etwa 3300 US-Dollar zugunsten von Lurasidon im Vergleich zu retardiertem Quetiapin ergab.
Eine traditionelle Rückfall-Verhütungsstudie wurde inzwischen beendet, Ergebnisse sind bisher nicht publiziert.
Daneben existiert noch eine doppelblinde, randomisierte Studie über 12 Monate im Vergleich zu Risperidon [10]. Stabile, meist vorbehandelte Patienten wurden im Verhältnis 2:1 Lurasidon/Risperidon auf die Prüfsubstanzen umgestellt und für bis zu 12 Monate beobachtet. Hier war der primäre Studienparameter die Verträglichkeit. Es zeigte sich eine vergleichbare rückfallprophylaktische Wirksamkeit beider Substanzen, allerdings waren die Gesamtzahl der Studienabbrüche unter Lurasidon höher als unter Quetiapin.
Kognitive Parameter
In einer Studie von Harvey et al. [18] wurden Patienten einer Akutstudie [26], die doppelblind über ein Jahr weitergeführt wurde, mit einer computerisierten kognitiven Testbatterie sowohl nach sechs Wochen doppelblinder Behandlung als auch nach weiteren drei und sechs Monaten untersucht. Dabei wurden zwei Gruppen von Patienten gebildet: 1. alle Patienten der Studie („full sample“) und 2. eine Gruppe, die prädefinierten neurokognitiven Minimalanforderungen genügte („evaluable sample“) . Die Ergebnisse sind in Abbildung 3 dargestellt und belegen den potenziellen prokognitiven Effekt von Lurasidon im Vergleich zu Placebo und Quetiapin. Es handelt sich um eine der größten Untersuchungen zu kognitiven Effekten von Antipsychotika im Vergleich zu Placebo.
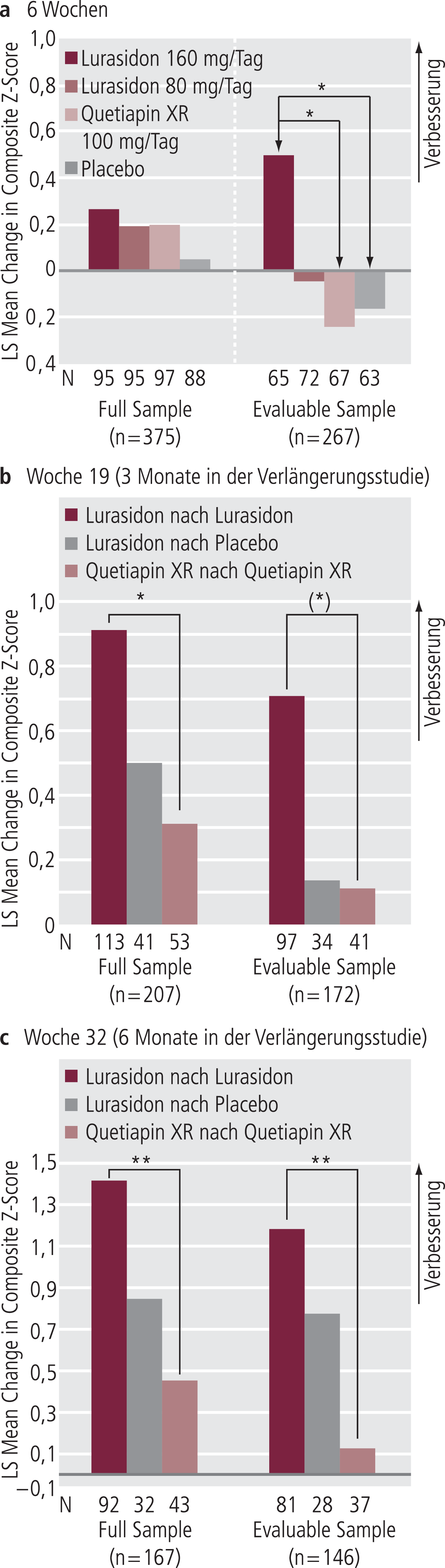
Abb. 3. a): Darstellung der Veränderung des zusammengesetzten Z-Scores als Globalmaß für die kognitive Leistungsfähigkeit im ersten Teil der Studie, Dauer 6 Wochen (Last observation carried forward ANCOVA, *p<0,05). b) und c): Darstellung der Veränderung des zusammengesetzten Z-Scores als Globalmaß für die kognitive Leistungsfähigkeit im zweiten und dritten Teil der Studie (nach 19 bzw. 32 Wochen) (Last observation carried forward ANCOVA, **p<0,01, *p<0,05, (*) p=0,58) [mod. nach 18]
Verträglichkeit und Sicherheit
Am häufigsten (Inzidenz ≥5% und mindestens 2-mal häufiger als unter Placebo) wurden in den Kurzzeitstudien Somnolenz, Akathisie, Übelkeit und Parkinsonismus beobachtet (Tab. 4) [43]. Auch unter den höheren Dosen (160 mg/Tag) traten diese Nebenwirkungen nicht häufiger als unter niedrigeren Dosen auf [11].
Tab. 4. Nebenwirkungen bei >2% der Lurasidon-behandelten Patienten und häufiger unter Lurasidon als unter Placebo vorkommend (Akutstudien) [42]
|
Nebenwirkung [%] |
Placebo (n=455) |
Lurasidon (alle Dosen) |
|
Gastrointestinales System |
||
|
Übelkeit |
6 |
12 |
|
Erbrechen |
6 |
8 |
|
Dyspepsie |
6 |
8 |
|
Speichelfluss |
<1 |
2 |
|
Allgemein |
||
|
Fatigue |
3 |
4 |
|
Muskuloskeletal |
||
|
Rückenschmerzen |
3 |
4 |
|
Störungen des Nervensystems |
||
|
Somnolenz |
10 |
22 |
|
Akathisie |
3 |
15 |
|
Parkinsonismus |
5 |
11 |
|
Dystonie |
1 |
5 |
|
Benommenheit |
3 |
5 |
|
Psychiatrische Störungen |
||
|
Insomnie |
7 |
8 |
|
Agitation |
3 |
6 |
|
Angst |
3 |
6 |
|
Unruhe |
2 |
3 |
In der Untersuchung von Meltzer et al. [29] wurden 40 und 120 mg Lurasidon/Tag mit 15 mg/Tag Olanzapin und mit Placebo verglichen. Hier zeigte sich, dass unter 40 mg Lurasidon/Tag weniger nebenwirkungsbedingte Abbrüche als unter 120 mg Lurasidon vorkamen. Die häufigsten Nebenwirkungen in der Lurasidon-Gruppe (alle Dosen; als Number needed to harm, NNH, in Relation zur Placebo-Gruppe ausgedrückt) waren Akathisie (9,2), Parkinsonismus (13,3), Agitation (15,2) und Übelkeit (15,1); in der 120-mg/Tag-Lurasidon-Gruppe: Somnolenz (9,1), Sedierung (9,8), Akathisie (4,5) und Parkinsonismus (10,8); in der 15-mg/Tag-Olanzapin-Gruppe: Gewichtszunahme (6,5), Sedierung (8,8), Mundtrockenheit (11,1) und Akathisie (15,4). In dieser Studie zeigte sich neben dem Vorteil bezüglich des Körpergewichts auch in anderen metabolischen Laborparametern ein klarer Vorteil zugunsten von Lurasidon.
Eine Metaanalyse aller Nebenwirkungen der seinerzeit verfügbaren Akutstudien zeigt das in Tabelle 5 wiedergegebene Bild [42]. Bei Auswertung der das extrapyramidal-motorische System (EPS) betreffenden Nebenwirkungen in unterschiedlichen Lurasidon-Dosisgruppen zeigt sich eine gewisse Dosisabhängigkeit (Tab. 6) [43].
Tab. 5. Inzidenz und Number needed to harm (NNH) von häufigen (Inzidenz >5% und 2-mal größer als unter Placebo) Nebenwirkungen unter Lurasidon im Vergleich zu Placebo [mod. nach 7, 11]
|
Nebenwirkung |
Placebo (n=708) |
Lurasidon 20–160 mg/Tag (n=1508) |
|
|
Inzidenz [%] |
NNH (95%-KI) |
||
|
Akathisie |
3 |
13 |
10 (9–13) |
|
Somnolenz |
7,1 |
17,0 |
11 (8–14) |
|
Übelkeit |
5 |
10 |
20 (14–36) |
|
Parkinsonismus |
5 |
10 |
20 (14–36) |
KI =Konfidenzintervall
Tab. 6. Extrapyramidal-motorische Nebenwirkungen (EPS) [%] in unterschiedlichen Lurasidon-Dosen [42]
|
Nebenwirkung |
Placebo |
Lurasidon |
|||
|
20 mg/Tag (n=71) |
40 mg/Tag (n=360) |
80 mg/Tag (n=282) |
120 mg/Tag (n=291) |
||
|
Alle EPS-Ereignisse |
9 |
10 |
24 |
26 |
39 |
|
Alle EPS-Ereignisse ohne Akathisie/Unruhe |
5 |
6 |
13 |
11 |
22 |
|
Akathisie |
3 |
6 |
11 |
15 |
22 |
|
Dystonie |
1 |
0 |
4 |
5 |
7 |
|
Parkinsonismus |
5 |
6 |
10 |
7 |
17 |
|
Unruhe |
2 |
1 |
4 |
1 |
3 |
Insgesamt ist die Substanz, auch bei längerer Anwendung, gewichtsneutral, im Gegensatz zu den untersuchten Vergleichssubstanzen Olanzapin und retardiertem Quetiapin [8, 43]. In den Langzeituntersuchungen [10, 26] zeigten sich qualitativ ähnliche Resultate. Das metabolische Profil von Lurasidon ähnelte in der durchgeführten 3-Wochen-Studie jenem von Ziprasidon [36]. In der 12-Monats-Vergleichsstudie vs. Risperidon [10] war Lurasidon günstiger bezüglich des Körpergewichts (unter Lurasidon zeigten 7% der Patienten einen Gewichtsanstieg ≥7%, unter Risperidon 14%).
In einer Studie [41] wurden Patienten aus einer Akutstudie [29], die entweder mit Lurasidon, Olanzapin oder Placebo für sechs Wochen behandelt waren, umgestellt auf Lurasidon und offen für weitere sechs Monate behandelt. Hier zeigte sich für die vormals mit Olanzapin behandelten Patienten, die eine deutliche Gewichtszunahme während der Akutstudie aufgewiesen hatten, ein Gewichtsabfall nach Umstellung auf Lurasidon.
Auch in Bezug auf andere metabolische Parameter zeigte sich Lurasidon einer Reihe anderer Antipsychotika überlegen, wie von De Hert et al. [14] im Vergleich zu Asenapin, Iloperidon und Paliperidon zusammenfassend dargestellt.
Im Vergleich zu Risperidon zeigte sich auch bezüglich der Prolactin-Werte ein Vorteil zugunsten von Lurasidon (der Anteil der Patienten mit einem Wechsel von normal zu erhöhten Werten war für Männer unter Lurasidon 13%, unter Risperidon 25%, für Frauen 12 bzw. 50%). Die drei häufigsten Nebenwirkungen in der Lurasidon-Gruppe (in Klammern die Werte für die Risperidon-Gruppe) waren Übelkeit in 16,7% (10,9%), Insomnie in 15,8% (13,4%) und Sedierung in 14,6% (13,9%) der Fälle. Die häufigsten Nebenwirkungen in der Risperidon-Gruppe (hier die Lurasidon-Werte in Klammern) waren Gewichtszunahme in 19,8% (9,3%), Somnolenz in 17,8% (13,6%) und Kopfschmerzen in 14,9% (10,0%) der Fälle [10].
In den Studien insgesamt [43] zeigte sich ein dosisabhängiger Prolactin-Anstieg, allerdings hält sich dessen klinische Relevanz in engen Grenzen, da eine Erhöhung >5-fach des Normwerts in 2,8% der mit Lurasidon behandelten Patienten vs. 1,0% der mit Placebo behandelten Patienten auftrat. In den nicht kontrollierten Langzeitstudien zeigte sich sogar ein geringer Abfall der Prolactin-Werte [43].
Bisherige Daten zeigen keinen Hinweis darauf, dass Lurasidon das QTc-Intervall ändert. In einer Studie wurde der Einfluss von Lurasidon (120 und 600 mg/Tag) auf die QTc-Zeit untersucht; es wurde kein Effekt festgestellt [43]. In den Placebo-kontrollierten Kurzzeitstudien wurde keine QTc-Zeit-Verlängerung über 500 ms in der Lurasidon- oder in der Placebo-Gruppe festgestellt [11].
Eine Zusammenfassung der Nebenwirkungen von Lurasidon im Vergleich zu anderen Antipsychotika gibt Tabelle 7.
Tab. 7. Nebenwirkungen von Lurasidon im Vergleich zu anderen Antipsychotika [nach 30]
|
Substanz |
QT-Verlängerung |
Hypotension |
Sedierung |
KG-Zunahme |
Metabolisches Syndrom |
EPS |
Prolactin-Anstieg |
|
Lurasidon |
– |
– |
+ |
+/– |
– |
+ |
+/–* |
|
Amisulprid |
+ |
– |
– |
+ |
+ |
+ |
+++ |
|
Aripiprazol |
– |
– |
– |
+/– |
+/- |
+/– |
– |
|
Asenapin |
+ |
– |
– |
+/– |
– |
+/– |
+/– |
|
Chlorpromazin |
++ |
+++ |
+++ |
++ |
++ |
++ |
+++ |
|
Clozapin |
+ |
+++ |
+++ |
+++ |
+++ |
– |
– |
|
Haloperidol |
++ |
+ |
+ |
+ |
+ |
+++ |
+++ |
|
Olanzapin |
+ |
+ |
++ |
+++ |
+++ |
+/– |
+ |
|
Paliperidon |
+ |
++ |
+ |
++ |
++ |
+ |
+++ |
|
Quetiapin |
++ |
++ |
++ |
++ |
++ |
– |
– |
|
Risperidon |
+ |
++ |
+ |
++ |
++ |
+ |
+++ |
|
Sertindol |
+++ |
+++ |
– |
+ |
+ |
– |
+/– |
|
Sulpirid |
+ |
– |
– |
+ |
+ |
+ |
+++ |
|
Ziprasidon |
+++ |
+ |
+ |
+/– |
+/– |
+/– |
+/– |
*In Kurzzeitstudien, nicht aber in Langzeitstudien wurde ein Prolactin-Anstieg beobachtet; +++ =hohe Inzidenz/Schweregrad; ++ =moderate Inzidenz/Schweregrad; + =niedrige Inzidenz/Schweregrad; – =sehr niedrige Inzidenz/Schweregrad; EPS: extrapyramidal-motorische Nebenwirkungen; KG: Körpergewicht
Fazit
Mit Lurasidon steht ein neues atypisches Antipsychotikum zur Verfügung, das breit geprüft wurde. Es zeigt eine ähnliche Akutwirksamkeit wie Quetiapin und Olanzapin, in der Langzeitwirksamkeit gibt es Hinweise für eine überlegene Wirksamkeit im Vergleich zu Quetiapin.
Neben der guten Wirksamkeit scheint die Substanz vor allem durch ihre gute Verträglichkeit, insbesondere was metabolische Parameter betrifft, gekennzeichnet zu sein.
Neben diesen klar gezeigten Eigenschaften existieren für die Substanz erste vielversprechende Ergebnisse, die auf eine besondere Wirksamkeit auf kognitive Defizite bei schizophrenen Patienten hinweisen. Diese Wirksamkeit könnte in Beziehung stehen zu der eingangs erwähnten ausgeprägten Affinität der Substanz zum 5-HT7-Rezeptor. Falls diese Eigenschaft in weiteren Untersuchungen belegt wird, könnte sie als besonderes unterscheidendes Merkmal von Lurasidon im Vergleich zu den anderen atypischen Antipsychotika gewertet werden.
Hinweis
Nach Erstellung dieses Manuskripts wurde der Vertrieb von Lurasidon eingestellt. Im AMNOG-Verfahren wurde der Substanz kein Zusatznutzen zuerkannt. In Österreich wurde Lurasidon noch nicht in den Markt eingeführt. In der Schweiz ist es auf dem Markt. (Stand Mai 2015)
Interessenkonflikterklärung
Beratungen: Für folgende Firmen war H-PV als Berater in den letzten zwei Jahren tätig: Lundbeck GmbH, AstraZeneca GmbH, Pfizer Pharma GmbH, Otsuka Pharma GmbH, Dr. Willmar Schwabe GmbH & Co. KG, Steigerwald Arzneimittelwerk GmbH, Lilly Deutschland GmbH, Janssen-Cilag GmbH, Neuraxpharm GmbH
Vorträge: Von folgenden Firmen hat H-PV Zuwendungen in den letzten zwei Jahren für Vorträge erhalten: Lundbeck GmbH, AstraZeneca GmbH, Pfizer Pharma GmbH, Otsuka GmbH, Dr. Willmar Schwabe GmbH & Co. KG, Steigerwald Arzneimittelwerk GmbH, Lilly Deutschland GmbH, Janssen-Cilag GmbH, Bristol-Myers Squibb & Co. KG. aA, Servier Deutschland GmbH, Otsuka Pharma GmbH, Spitzner Arzneimittelwerke GmbH, Trommsdorff GmbH & Co. KG, Neuraxpharm GmbH
Literatur
1. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (4th ed.) (DSM-IV). APA, 1994.
2. Awad G, Hassan M, Loebel A, Hsu J, et al. Health-related quality of life among patients treated with lurasidone: results from a switch trial in patients with schizophrenia. BMC Psychiatry 2014;14:53.
3. Ballaz SJ, Akil H, Wastson SJ. The 5-HT7-receptor: role in novel object discrimination and relation to novelty-seeking behavior. Neuroscience 2007;149:192–202.
4. BCC Research. Antipsychotic drugs: technologies and global market. www.bccresearch.com/market-research/pharmaceuticals/antipsychotic-drugs-markets-phm063a.html (Zugriff am 29.09.2014).
5. Blier P, Ward NM. Is there a role for 5-HT1A-agonists in the treatment of depression? Biol Psychiatry 2003;53:193–203.
6. Chiu YY, Ereshefsky L, Preskorn SH, Poola N, et al. Lurasidone drug-drug interaction studies: a comprehensive review. Drug Metab Drug Interact 2013;29:191–202.
7. Citrome L. Lurasidone for schizophrenia: a review of the efficacy and safety profile for this newly approved second-generation antipsychotic. Int J Clin Pract 2011;65:189–210.
8. Citrome L. Lurasidone for the active treatment of adults with schizophrenia: what is the number needed to treat, number needed to harm, and likelihood to be helped or harmed? Clin Schizophr Relat Psychoses 2012;6:76–85.
9. Citrome L. Lurasidone in schizophrenia: New information about dosage and place in therapy. Adv Ther 2012;29:815–25.
10. Citrome L, Cucchiaro J, Sarma K, et al. Long-term safety and tolerability of lurasidone in schizophrenia: a 12-month, double-blind, active-controlled study. Int Clin Psychpharmacol 2012;27:165–76.
11. Citrome L. A review of the pharmacology, efficacy and tolerability of recently approved and upcoming orals antipsychotics: An evidence-based medicine approach. CND Drugs 2013;27:879–911.
12. Citrome L, Weider PJ, McEvoy JP, Correll CU, et al. Effectiveness of lurasidone in schizophrenia or schizoaffective patients switched from other antipsychotics: a 6-month, open-label, extension study. CNS Spectr 2014;19:330–9.
13. Citrome L, Ketter TA, Cucchiaro J, Loebel A. Clinical assessment of lurasidone benefit and risk in the treatment of bipolar I depression using number needed to treat, number needed to harm, and likelihood to be helped or harmed. J Affect Disord. 2014;155:20–7.
14. De Hert M, Yu W, Detraux J, Sweers K, et al. Body weight and metabolic adverse effects of asenapine, iloperidone, lurasidone and paliperidone in the treatment of schizophrenia and bipolar disorder. CNS Drugs 2012;26:733–59.
15. Dolder CR, Lacro JP, Dunn LB, Jeste DV. Antipsychotic medication adherence: is there a difference between typical and atypical agents? Am J Psychiatry 2002;159:103–8.
16. Donohoe G, Owens N, O’Donnell C, Burke T, et al. Predictors of compliance with neuroleptic medication among inpatients with schizophrenia: a discriminant function analysis. Eur Psychiatry 2001;16:293–8.
17. Harvey PD, Ogasa M, Cucchiaro J, et al. Performance and interview-based assessments of cognitive change in a randomized, double-blind comparison of lurasidone vs. ziprasidone. Schizophr Res 2011;127:188–94.
18. Harvey PD, Siu CO, Hsu J, Cucchiaro J, et al. Effect of lurasidone on neurocognitive performance in patients with schizophrenia: A short-term placebo- and active-controlled study followed by a 6-month double-blind extension. Eur Neuropsychopharmacol 2013;23:1373–82.
19. Hellewell JS. Patients’ subjective experiences of antipsychotics: clinical relevance. CNS Drugs 2002;16:457–71.
20. Ishibashi T, Horisawa T, Tokuda K, Ishiyama T, et al. Pharmacological profile of lurasidone, a novel antipsychotic agent with potent 5-hydroxytryptamine 7 (5-HT7) and 5-HT1A receptor activity. J Pharmacol Exp Ther 2010;334:171–81.
21. Kane JM, Aguglia E, Altamura AC, Yuso Gutierrez JL, et al. Guidelines for depot antipsychotic treatment in schizophrenia. European Neuropsychopharmacology Consensus Conference in Siena, Italy. Eur Neuropsychopharmacol 1998;8:55–66.
22. Lacro JP, Dunn LB, Dolder CR, Leckband SG, et al. Prevalence of and risk factors for medication non-adherence in patients with schizophrenia: a comprehensive review of recent literature. J Clin Psychiatry 2002;63:892–909.
23. Lieberman JA, Koreen AR, Chakos M, Sheitman B, et al. Factors influencing treatment response and outcome of first-episode schizophrenia: implications for understanding the pathophysiology of schizophrenia. J Clin Psychiatry 1996;57(Suppl 9):5–9.
24. Loebel A, Cucchiaro J, Silva R, Ogasa M, et al. Efficacy of lurasidone in schizophrenia: Results of a pooled analysis based on a 5-factor model of schizophrenia. Schizophr Res 2010;117:267.
25. Loebel A, Cucchiaro J, Sarma K, et al. Efficacy and safety of lurasidone 80 mg/day and 160 mg/day in the treatment of schizophrenia: a randomized, double-blind, placebo- and active-controlled trial. Schizophrenia Res 2013;145:101–9.
26. Loebel A, Cucchiaro J, Xu J, et al. Effectiveness of lurasidone vs. quetiapine XR for relapse prevention in schizophrenia: a 12-month, double-blind, non-inferiority study. Schizophrenia Res 2013;147:95–102.
27. Loebel A, Cuchiaro J, Silva R, Kroger H, et al. Lurasidone monotherapy in the treatment of bipolar I depression: a randomized, double-blind, placebo-controlled study. Am J Psychiatry 2014;171:160–8.
28. McEvoy JP, Citrome L, Hernandez D, et al. Effectiveness of lurasidone in patients with schizophrenia or schizoaffective disorder switched from other antipsychotics: a randomized, 6-week, open-label study. J Clin Psychiatry 2013;74:170–9.
29. Meltzer HY, Cucchiaro J, Silva R, et al. Lurasidone in the treatment of schizophrenia: a randomized, double-blind, placebo- and olanzapine-controlled study. Am J Psychiatry 2011;168:957–67.
30. Meyer JM, Loebel AD, Schweizer E. Lurasidone: a new drug in development for schizophrenia. Expert Opin Investig Drugs 2009;18:1715–26.
31. Misdrahi D, Llorca PM, Lancon C, Bayle FJ. [Compliance in schizophrenia: predictive factors, therapeutical considerations and research implications]. Encephale 2002;28: 266–72.
32. Nakamura M, Ogasa M, Guarino J, et al. Lurasidone in the treatment of acute schizophrenia: a double-blind, placebo-controlled trial. J Clin Psychiatry 2009;70:829–36.
33. Nasrallah HA, Silva R, Philips D, et al. Lurasidone for the treatment of acutely psychotic patients with schizophrenia: a 6-week, randomized, placebo-controlled study. J Psychiatr Res 2013;47:670–7.
34. Nasrallah HA, Cucchiaro JB, Mao Y, Pikalov AA, et al. Lurasidone for the treatment of depressive symptoms in schizophrenia: analysis of 4 pooled, 6-week, placebo-controlled studies. CNS Spectr 2014;23:1–8.
35. Ogasa M, Kimura T, Nakamura M, et al. Lurasidone in the treatment of schizophrenia: a 6-week, placebo-controlled study. Psychopharmacology (Berl) 2013;225:829–36.
36. Potkin SG, Ogasa M, Cucchiaro J, et al. Double-blind comparison of the safety and efficacy of lurasidone and ziprasidone in clinically stable outpatients with schizophrenia or schizoaffective disorder. Schizophr Res 2011;132:101–7.
37. Preskorn SH. Clinically important differences in the pharmacokinetics of the ten newer „atypical“ antipsychotics: Part 3. Effects of renal and hepatic impairment. J Psychiatr Pract 2012;18:430–7.
38. Rajagopalan K, O’Day K, Meyer K, Pikalov A, et al. Annual cost of relapses and relapse-related hospitalizations in adults with schizophrenia: results from a 12-month, double-blind, comparative study of lurasidone vs. quetiapine extended release. J Med Econ 2013;16:987–96.
39. Samalin L, Garnier M, Llorca PM. Clinical potential of lurasidone in the management of schizophrenia. Ther Clin Risk Manag 2011;7:239–50.
40. Silva R, Correll C, Simonelli D, et al. Long-term safety and effectiveness of lurasidone in schizophrenia: results of a 22-month, open-label extension study. Poster Presentation NR6–27; American Psychiatric Associaton 165th Annual Meeting; May 5–9, 2012, Philadelphia, Pennsylvania.
41. Stahl SM, Cucchiaro J, Silva R, et al. Effectiveness of lurasidone for patients with schizophrenia following 6 weeks of acute treatment with lurasidone, olanzapine, or placebo: a 6-month, open-label, extension study. J Clin Psychiatry 2013;74:507–15.
42. Sunovion Pharmaceuticals Inc. Latuda (lurasidone Hcl) tablets. Prescribing information. 2010.
43. Sunovion Pharmaceuticals Inc. Latuda (lurasidone hydrochloride) tablets. Product label. July 2013. www.latuda.com/latudaprescribinginformation.pdf (Zugriff am 29.9.2014).
44. Takeda, Fachinformation Latuda®. 2014.
45. Tarazi FI, Riva MA. The preclinical profile of lurasidone: clinical relevance for the treatment of schizophrenia. Exp Opin Drug Discov 2013;8:1297–307.
46. Vieta E, Valenti M. Pharmacological management of bipolar depression: Acute treatment, maintenance, and prophylaxis. CNS Drugs 2013;27:515–29.
47. Volz HP, Reischies F, Riedel M. [Cognitive disorders in schizophrenic patients]. Nervenarzt 2010;81:39–54.
Prof. Dr. Hans-Peter Volz, Krankenhaus für Psychiatrie, Psychotherapie und Psychosomatische Medizin Schloss Werneck, Balthasar-Neumann-Platz 1, 97440 Werneck, E-Mail: hans-peter.volz@kh-schloss-werneck.de
Lurasidone
Lurasidone is a strong inhibitor of the dopaminergic D2- and the serotonergic 5-HT2A-receptor. The compound also interacts with the 5-HT1A- and the 5-HT7-receptor, these properties might be responsible for the antidepressive and procognitive effects. The compound is heavily metabolized via CYP3A4 thus causing interactions with inhibitors and inducers of this enzyme. The efficacy compared to placebo is well proven, in acute trials a comparable efficacy to quetiapine and olanzapine could be demonstrated. In contrast to these compounds, lurasidone practically caused no changes in metabolic parameters. In a long-term study lurasidone was more effective than quetiapine. Overall, the compound showed a preferable side-effect profile compared to other atypical antipsychotics.
Key words: Lurasidone, D2-antagonist, 5-HT2A-antagonist, CPY3A4, side-effects
Psychopharmakotherapie 2015; 22(03)
