Dr. Tanja Saußele, Stuttgart
Die Serotoninrezeptor-Familie besteht aus sieben Subfamilien (5-HT1–7), von denen 12 Mitglieder G-Protein-gekoppelte Rezeptoren sind. Für eine große Vielfalt von Arzneistoffen ist das serotonerge System ein Hauptangriffspunkt. Darunter befinden sich beispielsweise atypische Antipsychotika, Antimigränemittel, Antiemetika, Arzneistoffe gegen das Reizdarmsyndrom, Anxiolytika und Antidepressiva. Der Einsatz dieser Medikamente birgt jedoch unerwünschte Nebenwirkungen, die zum Beispiel durch die Interaktion mit verschiedenen Subtypen der Serotoninrezeptoren oder Rezeptoren für andere biogene Amine zustande kommen.
Nichtselektive Rezeptorbindung
Der 5-HT1B-Rezeptor wird vor allem im kardiovaskulären System und ZNS exprimiert. Im ZNS wirkt der 5-HT1B-Rezeptor als inhibitorischer präsynaptischer Rezeptor und moduliert die Freisetzung von Serotonin und vielen anderen Neurotransmittern.
Die Antimigränemittel Ergotamin und Dihydroergotamin (Abb. 1) sind wirksame 5-HT1B-Rezeptoragonisten; die nichtgewünschte Aktivierung der 5-HT2B-Rezeptoren führt zur bekannten valvulopathischen Wirkung (Fibrose der Herzklappen), da interstitielle Fibroblasten in menschlichen Herzklappen reich an Serotonin-Rezeptoren vom Subtyp 5-HT2B sind, deren Aktivierung über eine gesteigerte Mitogenese zu einer überschießenden Proliferation führt [1]. Auch die Antiparkinsonmittel Pergolid und Cabergolin können eine Valvulopathie verursachen, da sie potente 5-HT2B-Agonisten sind.
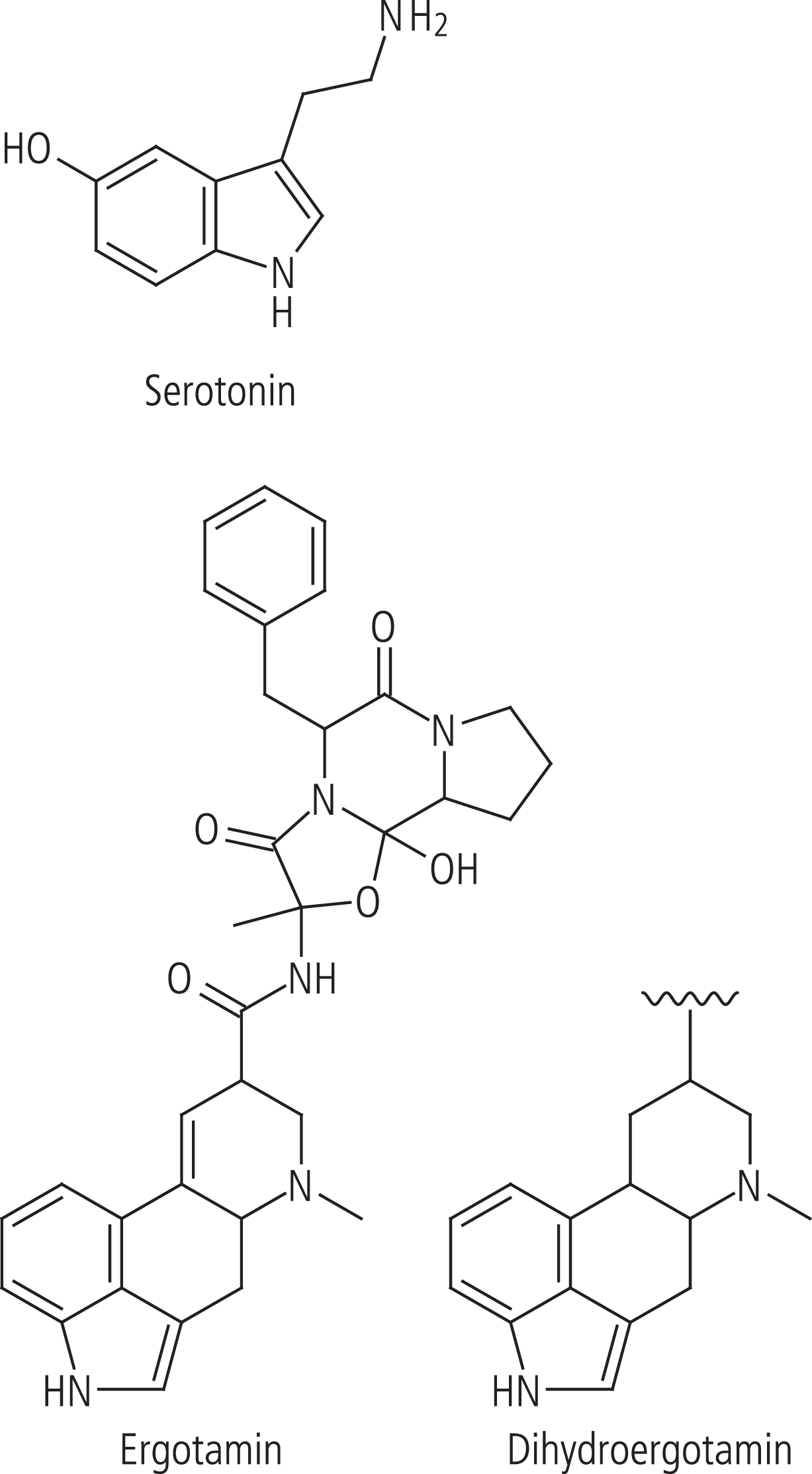
Abb 1. Endogener Ligand Serotonin und die synthetischen Serotoninrezeptor-Liganden Ergotamin und Dihydroergotamin
Unterschiedliche Signaltransduktion
Zudem können verschiedenen Agonisten an ein und demselben Rezeptor auch unterschiedliche Signaltransduktionswege in Gang setzen (sog. funktionelle Selektivität). Bei den 5-HT1B- und 5-HT2B-Rezeptoren kann neben dem Hauptsignalweg, der G-Protein-abhängig ist, auch eine alternative Signaltransduktion über β-Arrestine (Abb. 2) mit anschließender Aktivierung extrazellulär regulierter Kinasen (ERK) erfolgen und so zur gesteigerten Mitogenese mit Herzklappenfibrose führen.
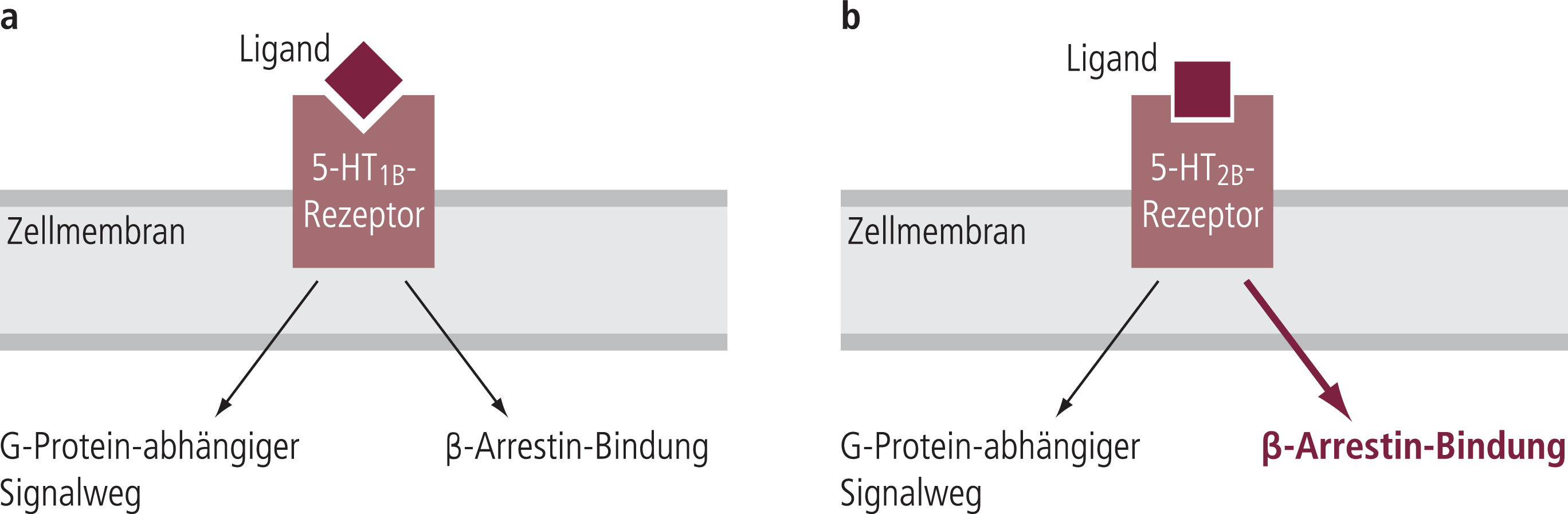
Abb. 2. Funktionelle Selektivität an den Serotininrezeptoren. a) Keine bevorzugte Signaltransduktion am 5-HT1B-Rezeptor durch den Liganden (Ergotamin). b) Bevorzugter β-Arrestin-Weg durch den Liganden Ergotamin am 5-HT2B-Rezeptor
5-HT1B-Rezeptor
Der 5-HT1B-Rezeptor besteht aus einer Alpha-Helix mit sieben Transmembran-Domänen (Abb. 3). Die extrazelluläre Schleife 2 (ECL2) bildet zum Teil die Ligandenbindungstasche und wird durch eine Disulfidbrücke stabilisiert, die bei G-Protein-gekoppelten Rezeptoren hoch konserviert ist. Über der Bindungstasche verläuft ein Teil des N-Terminus, der eine Rolle bei der Ligandenbindung beim 5-HT1B-Rezeptor zu haben scheint.
Forschungsergebnisse
Wissenschaftler aus den USA und China haben die Kristallstruktur der humanen Rezeptoren 5-HT1B und 5-HT2B, gebunden an die Agonisten Ergotamin und/oder Dihydroergotamin, aufgedeckt und miteinander verglichen. Durch diese Strukturinformation und zusätzliche computergestützte Liganden-Docking-Experimente konnte die überlappende Substratspezifität zwischen den beiden Rezeptoren aufgeklärt werden: Beide Rezeptoren verfügen über eine zusätzliche Bindungstasche neben dem Bindungsort für den endogenen Liganden Serotonin. Dort können chemische Gruppen binden, die weiter entfernt von der Indolamin-Gruppe sind und dann vermutlich die Signaltransduktion beeinflussen.
Es konnten aber auch entscheidende Unterschiede gefunden werden:
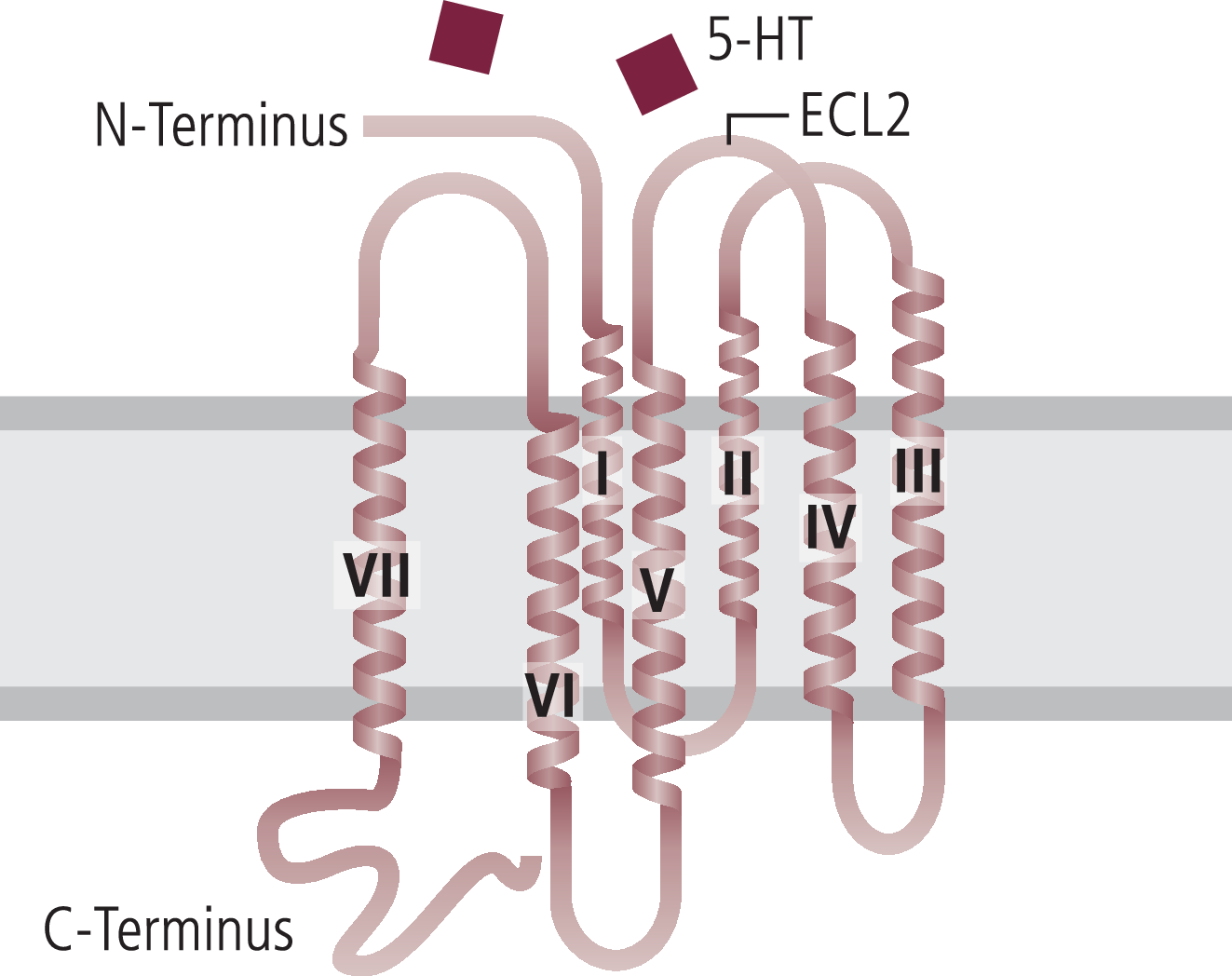
Abb. 3. Schematische Darstellung des Serotoninrezeptors mit den sieben Transmembrandomänen (I bis VII) und den extrazellulären Schleifen. 5-HT: Serotonin, ECL2: extrazelluläre Schleife 2
Unterschiedliche Selektivität
Im Komplex mit Ergotamin zeigt sich eine große Ligandenbindungstasche, die von den Aminosäuren der Helices III, V, VI, VII und ECL2, die weit in der Transmembrandomäne eingebettet sind, gebildet wird.
Das Ende der Helix V des 5-HT1B-Rezeptors ist 3 Angström weiter nach außen gerichtet als das des 5-HT2B-Rezeptors. Dadurch entsteht eine vergrößerte, weiter geöffnete Tasche, die die unterschiedliche Selektivität der Rezeptor-Subtypen erklärt.
Unterschiedliche Signaltransduktion
Zusätzlich konnte die Struktur beider Rezeptoren in Anwesenheit desselben Liganden (Ergotamin) bestimmt werden. Unterschiede in der intrazellulären Domäne, die mit G-Proteinen und Arrestinen interagiert, konnten entdeckt werden.
Eine Stelle betrifft beispielsweise die Verbindung zwischen der extrazellulären Schleife 2 (ECL2) und der Helix V, die beim 5-HT2B-Rezeptor durch eine zusätzliche Wasserstoffbrückenbindung und der daraus resultierenden verkürzten Disulfidbrückenbindung zu einer Konformationsänderung an der extrazellulären Spitze der Helix V in der zytoplasmatischen Region führt.
So wird bei der Bindung von Ergotamin an den 5-HT2B-Rezeptor die Signaltransduktion über β-Arrestin bevorzugt, im Gegensatz zur beobachteten Kopplung an G-Proteine beim 5-HT1B-Rezeptor.
Kommentar
Das CHMP der europäischen Arzneimittelagentur EMA hat Ende Juni eine Anwendungsbeschränkung für Ergotderivat-haltige Arzneistoffe bekannt gegeben [2]. So sollen Dihydroergocristin-, Dihydroergotamin- sowie Nicergolin-haltige Arzneistoffe nicht mehr angewendet werden für die symptomatische Behandlung der chronischen pathologischen kognitiven und neurosensorialen Beeinträchtigung bei älteren Menschen, Zusatzbehandlung der Claudicatio intermittens bei peripherer arterieller Verschlusskrankheit, Zusatzbehandlung des Raynaud-Syndroms und zur Migräneprophylaxe.
Grund dafür ist eine negative Nutzen-Risiko-Bewertung, da ein erhöhtes Risiko für eine Fibrose, unter anderem der Herzklappen, und für Vergiftungen (Ergotismus) besteht.
Unterschiede bei den Ligandenbindungseigenschaften der 5-HT-Rezeptoren zwischen Menschen und Nagetieren verhindern eine Extrapolierung der Ergebnisse von Tierversuchen auf den Menschen und erschweren deshalb die Entwicklung selektiver 5-HT-Rezeptoragonisten
Die Forschungsergebnisse der zwei Arbeitsgruppen um Wang et al. und Wacker et al. könnten einen entscheidenden Beitrag leisten, um spezifische Arzneistoffe zu entwickeln, die selektiv an den 5-HT1B-Rezeptor binden oder nur einen bevorzugten Signalweg, beispielsweise die Bindung an G-Proteine, aktivieren. Dadurch könnten unerwünschte Arzneimittelwirkungen wie eine Valvulopathie, die durch die Bindung an den 5-HT2B-Rezeptor zustande kommen, in Zukunft ausgeschlossen werden.
Quellen
Wang C et al. Structural basis for molecular recognition at serotonin receptors. Science 2013;340:610–4.
Wacker D et al. Structural features for functional selectivity at serotonin receptors. Science. 2013;340:615–9.
Palczewski K, Kiser PD. Biochemistry. As good as chocolate. Science 2013;340:562–3.
Literatur
1. Roth, BL. Drugs and valvular heart disease. N Engl J Med 2007;356:6–9.
2. Pressemitteilung der Euopean Medicines Agency. New restrictions on use of medicines containing ergot derivatives. EMA/385266/2013. 28. Juni 2013.
Psychopharmakotherapie 2013; 20(06)
