Christoph Bartel, Susanne Kraemer, Edith Schneider, Bad Homburg, und Kai G. Kahl, Hannover
Beschreibung des klinischen Bilds
Die Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) ist ein etabliertes Krankheitsbild im Kindes- und Jugendalter. Im Rahmen des Kinder- und Jugendgesundheitssurvey wurde in Deutschland eine Prävalenz von 4,8% gefunden. Weitere 4,9% der Teilnehmer wurden als ADHS-Verdachtsfälle eingestuft [47].
Lange Zeit galt die Annahme, dass ADHS sich mit dem Erwachsenwerden „auswächst“ [13]. Seit Ende der 90er-Jahre wird jedoch zunehmend ein Fortbestehen der ADHS im Erwachsenenalter mit Teilen der Symptome oder im Vollbild angenommen – jedoch mit einer durch Alter und Reifungsgrad veränderten Darstellung der Symptomatik [29]. Unzureichende Diagnosekriterien der International Classification of Diseases (ICD-10) der Weltgesundheitsorganisation [56] und der vierten Auflage des Diagnostic and Statistical Manual of Mental Disorders (DSM-IV-TR) der American Psychiatric Association [8] haben dazu beigetragen, dass Unsicherheiten bezüglich der Diagnosestellung der ADHS im Erwachsenenalter bestehen.
Diagnostic and Statistical Manual of Mental Disorders
Die im Mai 2013 publizierte Aktualisierung des DSM mit dem DSM-5 [9] wird der klinischen Notwendigkeit für eine validierte Diagnostik bei Erwachsenen besser gerecht, womit die Einleitung einer zielgerichteten Behandlung nunmehr eher möglich sein sollte. Da die Anzahl und die Beschreibung der diagnostischen Kriterien oder Kernsymptome sich nicht geändert haben, sondern nur für das Erwachsenenalter besser spezifiziert wurden, sind die bisher in der klinischen Anwendung und in den Studien verwendeten Skalen sowie die Selektion der Patientenpopulationen der Studien auch auf die DSM-5 anwendbar [22]. Allerdings wird für die ADHS-Diagnose im Erwachsenenalter in der DSM-5 jetzt das Alter, bis zu dem eine relevante Symptomatik zurückverfolgt werden muss, auf vor dem 12. Lebensjahr festgelegt statt bisher dem 7. Lebensjahr. Außerdem müssen im Erwachsenenalter nur noch fünf statt wie bisher sechs Symptome für die Unaufmerksamkeit und/oder Hyperaktivität/Impulsivität vorhanden sein.
Einordnung nach DSM-IV-TR
Im Folgenden wird nur auf die Kriterien der DSM-IV Bezug genommen werden, weil sich die bis dato vorliegende Literatur, die Studienprotokolle und die Skalen darauf bezogen haben. In den beiden derzeit gültigen Diagnosesystemen (ICD und DSM) werden unverändert die diagnostischen Kriterien unterschiedlich definiert. Weltweit am gebräuchlichsten, insbesondere auch in der Forschung, waren zum Zeitpunkt der Durchführung der hier vorgestellten Studien die Kriterien der vierten überarbeiteten Auflage des DSM (DSM-IV-TR) [8]. Hier werden die 18 Kernsymptome der ADHS genannt. Diese werden den Bereichen Unaufmerksamkeit bzw. Hyperaktivität/Impulsivität zugeordnet, dabei jeweils neun Symptome für die Unaufmerksamkeit und neun Symptome für die Hyperaktivität/Impulsivität. Im DSM-IV-TR werden drei Subtypen der ADHS unterschieden: Sind sechs von neun Symptomen der Unaufmerksamkeit vorhanden, wird ADHS vom vorwiegend unaufmerksamen Subtyp diagnostiziert. Sechs Symptome bei Hyperaktivität/Impulsivität sprechen für den vorwiegend hyperaktiv-impulsiven Subtyp. Wenn aus beiden Bereichen jeweils sechs Symptome vorhanden sind, wird dies als kombinierter Subtyp bezeichnet.
Beide Klassifikationssysteme verlangen unverändert, dass die Symptome seit dem Grundschulalter und über einen längeren Zeitraum bestehen. Außerdem müssen die Symptome in mindestens zwei Bereichen zu eindeutigen Beeinträchtigungen der entwicklungsgemäßen sozialen, schulischen oder beruflichen Leistungsfähigkeit führen. Zusätzlich dürfen sie nicht Ausdruck einer anderen Erkrankung sein.
International Classification of Diseases
In der für die Diagnosestellung im klinischen Alltag weiterhin gültigen ICD-10 finden sich die ADHS-Kriterien im Kapitel V, F9 (Verhaltens- und emotionale Störungen mit Beginn in der Kindheit und Jugend). Dabei wird wie folgt unterschieden:
- F90.0 einfache Aktivitäts- und Aufmerksamkeitsstörung
- F90.1 hyperkinetische Störung des Sozialverhaltens
- F90.8 andere
- F90.9 nicht näher bezeichnete
Ein Beginn der Symptome „früh“ (vor dem 6. Lebensjahr) und das Vorhandensein „von längerer Dauer“ werden für die Diagnosestellung gefordert. Die Symptome müssen in mehr als einer Situation in Erscheinung treten. Im Gegensatz zu den Kriterien des DSM-IV-TR müssen die Betroffenen gleichzeitig sowohl eine beeinträchtigte Aufmerksamkeit (z.B. rascher Wechsel zwischen Aktivitäten, Ablenkbarkeit) als auch Hyperaktivität und Impulsivität (z.B. ausgeprägte Redseligkeit, Zappeln) aufweisen. Infolge der Störung – aber nicht gefordert für die Diagnosestellung – werden in der ICD unter anderem folgende Begleitmerkmale aufgeführt:
- Distanzlosigkeit
- impulsive Missachtung sozialer Regeln
- Lernstörungen
- motorische Ungeschicklichkeiten
Laut ICD-10 kann mit denselben Kriterien „auch im Erwachsenenalter die Diagnose eines hyperkinetischen Syndroms gestellt werden“, jedoch unter Beachtung entwicklungsbedingter Veränderungen. Eine eigene Definition oder Symptombeschreibung für Patienten im Erwachsenenalter existiert hier jedoch nicht.
Klinik beim Erwachsenen
Eine Studie der WHO in zehn verschiedenen Ländern hat ergeben, dass 3,5% der erwachsenen arbeitenden Bevölkerung im Alter von 18 bis 44 Jahren von ADHS betroffen sind [21]. Es ist aber anzunehmen, dass in der Patientengruppe, die sich in psychiatrischer oder nervenärztlicher Behandlung befindet, die Rate deutlich höher sein dürfte [43]. Bislang gibt es jedoch diesbezüglich in Deutschland keine Untersuchungen. Für die behandelnden Ärzte stellt sich die Situation insofern noch komplexer dar, als davon ausgegangen werden muss, dass Patienten mit ADHS zu etwa 50 bis 75% an komorbiden psychiatrischen Störungen [6, 34, 35] leiden, unter anderem auch Borderline-Persönlichkeitsstörungen [30], die die Symptome der ADHS maskieren können [29]. Über 30% der ADHS-Patienten wiesen mehr als eine Komorbidität auf [38]. Auch können andere Erkrankungen, wie eine bipolare Störung, Abhängigkeits- oder Angsterkrankungen eine fälschliche ADHS-Diagnose nahelegen [6].
Weitere Folgen der Störung können sowohl für den Patienten belastend und beeinträchtigend sein als auch hohe Kosten für die sozialen Systeme hervorrufen: Arbeitnehmer mit einer ADHS haben deutlich mehr Fehltage am Arbeitsplatz als Personen ohne ADHS [21], eine um 4 bis 5% geminderte Arbeitsproduktivität [36] und eine erhöhte psychosoziale Belastung. Letztere ist bei undiagnostizierten Patienten höher als bei Patienten mit bekannter ADHS [1]. Sobanski und Kollegen konnten nachweisen, dass ADHS-Patienten nicht nur mehr Strafmandate im Straßenverkehr erhalten, sondern auch häufiger in Verkehrsunfälle mit schwereren Verletzungsfolgen verwickelt sind [48]. Die NICE(National Institute for Clinical Excellence)-Leitlinien für ADHS führen aus, dass ADHS-Betroffene deutlich mehr Kosten im Gesundheitssystem erzeugen als nicht betroffene Individuen [50]. Aber auch andere gesellschaftliche Folgekosten einer unerkannten und/oder unbehandelten ADHS sollten nicht außer Acht gelassen werden. Bei bis zu 50% der Insassen in Anstalten des Strafvollzugs besteht eine ADHS [37]. Hier kann auch ein Zusammenhang mit der ebenfalls häufiger komorbid vorhandenen antisozialen Persönlichkeitsstörung diskutiert werden [37]. Darüber hinaus erhöht die ADHS die Wahrscheinlichkeit für frühere und ungeschützte sexuelle Aktivitäten sowie ungewollte Schwangerschaften [12]. Diesem Aspekt sollte bei der Bewertung der individuellen und gesellschaftlichen Relevanz der Diagnose ADHS möglicherweise mehr Beachtung geschenkt werden als bei anderen psychiatrischen Erkrankungen.
Pathomechanismen und Genetik der ADHS
Nach dem momentanen Kenntnisstand muss man davon ausgehen, dass die ADHS zu mehr als 70% genetisch determiniert ist. Hinweise auf diese ausgeprägte genetische Komponente ergeben sich unter anderem aus der Beobachtung, dass biologische Verwandte von ADHS-Betroffenen häufiger hyperkinetisch sind als adoptierte [27]. Zwillingsstudien zeigen eine mittlere Erblichkeit von 75% und mehr [28]. Multiple Umweltfaktoren, wie perinatale Exposition mit Alkohol oder Zigarettenrauch, aber auch Mangelernährung sind beschrieben worden, die die Ausprägung einer ADHS fördern können [20]. In Bezug auf die pathophysiologischen Bedingungen verdichten sich die Hinweise, dass der ADHS Störungen des Cingulum sowie fronto-parietaler Netzwerke zugrunde liegen. Diese haben Folgen für Kognition und Aufmerksamkeit, motorische Systeme, Belohnungs- und Feedback-Systeme [15]. Studien mit Bildgebungsverfahren zeigen bei Patienten mit ADHS unter anderem eine verzögerte Hirnreifung, kleinere Hirnvolumina im Bereich des Corpus callosum, des Cortex und in weiteren Arealen [20]. Auch eine Dysfunktion des noradrenergen und des dopaminergen Systems besteht [16]. Diese Transmittersysteme stellen derzeit die Ziele für eine pharmakologische Behandlung der ADHS dar.
Pharmakotherapie der ADHS
Deutsche Leitlinien empfehlen bei Vorhandensein einer schweren Beeinträchtigung in mindestens einem Lebensbereich oder leichterer Beeinträchtigungen in mindestens zwei Lebensbereichen, die sicher durch die ADHS-Symptomatik verursacht sind, einen multimodalen Therapieansatz bestehend aus Pharmakotherapie und Psychotherapie. In begründeten Fällen, je nach Therapieschwerpunkt und Ressourcen des Patienten, kann auch eine rein pharmakologische Behandlung erfolgen [24].
In der Pharmakotherapie der kindlichen ADHS sind die Psychostimulanzien seit Jahrzehnten etabliert. In Deutschland sind neben DL-Amfetaminsaft, der jedoch nicht als Fertigarzneimittel zur Verfügung steht, und dem 2012 eingeführten Lisdexamfetamin (Elvanse®) eine Reihe von Methylphenidat-Präparaten zugelassen. Da Methylphenidat eine relativ kurze Halbwertszeit und Wirkdauer hat, stehen neben Präparaten mit Methylphenidat in unretardierter Form (z.B. Ritalin®) auch mehrere retardierte Formulierungen (z.B. Ritalin®LA) zur Verfügung, die je nach Präparat eine Wirkdauer von 8 bis 12 Stunden aufweisen [11].
In Deutschland war die medikamentöse Behandlung der ADHS im Erwachsenenalter dadurch erschwert, dass lange keines dieser Präparate für die Behandlung von Erwachsenen zugelassen war. Die Behandlung musste unter entsprechender Dokumentation und Aufklärung off Label als „individueller Heilversuch“ erfolgen. Erst 2011 erhielt ein retardiertes Methylphenidat-Präparat (Medikinet® adult) die Zulassung zur Behandlung einer seit der Kindheit fortbestehenden ADHS im Erwachsenenalter [25].
Mit Atomoxetin (ATX, Strattera®) wurde 2003 in den USA und 2004 in Deutschland das erste ADHS-Arzneimittel eingeführt, das nicht zur pharmakologischen Gruppe der Stimulanzien gehört. Mittlerweile steht es in mehr als 30 Ländern zur Verfügung. Im Gegensatz zu den USA und einigen anderen Ländern, in denen Atomoxetin seit Einführung sowohl für die Behandlung der ADHS im Kindes- und Jugendalter als auch im Erwachsenenalter zugelassen ist, erfolgte in Deutschland die Zulassung für den Behandlungsbeginn im Erwachsenenalter im Juni 2013. Atomoxetin ist seit Beginn jedoch für die Fortführung der Behandlung in das Erwachsenenalter hinein zugelassen, wenn Jugendliche, bei denen die Symptomatik fortbesteht, eindeutig von der Behandlung mit Atomoxetin profitiert haben. Relevante Daten für diese Zulassungserweiterung lieferte eine Langzeitstudie mit erwachsenen ADHS-Patienten, in der mehrheitlich Patienten aus europäischen Ländern untersucht wurden und die als Teil des Zulassungsantrags für Europa konzipiert wurde [52, 53].
Pharmakodynamik von Atomoxetin
Atomoxetin ist ein selektiver Noradrenalin-(NA-)Wiederaufnahmehemmer mit einer hohen Spezifität für den NA-Transporter. Die Affinität zu anderen neuronalen Transmittersystemen (muskarinerg, cholinerg, histaminerg, serotonerg, alpha-1- oder alpha-2-adrenerg) ist nur gering [49]. Ebenfalls deutlich geringere Affinität wurde für eine Anzahl weiterer Rezeptoren und Transporter beschrieben, darunter auch Kappa-Opioid-Rezeptoren, für die eine Bindung des Metaboliten 4-Hydroxyatomoxetin in der Zellkultur gezeigt worden war [49]. Dabei ist auch zu beachten, dass die Cmax für diesen Metaboliten etwa um den Faktor 100 geringer ist als für die Muttersubstanz [46].
Bymaster et al. [16] konnten in Mikrodialysestudien an Ratten zeigen, dass therapeutische Dosen von Atomoxetin die Konzentration von NA im präfrontalen Cortex (PFC) um das 3-Fache erhöhen. Konzentrationserhöhungen etwa gleichen Ausmaßes wurden im PFC auch für Dopamin (DA) gefunden. Nicht erhöht dagegen waren die DA-Konzentrationen im Striatum und im Nucleus accumbens (NclA). Im Unterschied hierzu führte Methylphenidat in diesen Untersuchungen sowohl zu einer Erhöhung von NA und DA im PFC als auch zu einer Erhöhung der DA-Konzentration in Striatum und NclA. Es wird vermutet, dass die Erhöhung der Catecholamine im PFC, einer Region, die mit Aufmerksamkeit und Gedächtnis in Verbindung gebracht wird, den therapeutischen Effekt von Atomoxetin und Methylphenidat erklärt. Die Beobachtung, dass Atomoxetin nicht die DA-Konzentration im Belohnungszentrum NclA erhöht, weist darauf hin, dass es keine Eigenschaften im Sinne eines Psychostimulans hat [16].
Missbrauchspotenzial
Diese tierexperimentellen Befunde mit Hinweis auf ein geringes – falls überhaupt vorhandenes – Missbrauchspotenzial von Atomoxetin wurden in zwei Studien an erwachsenen Probanden mit einer Missbrauchsproblematik überprüft. Es fand sich jedoch kein Hinweis auf ein Missbrauchspotenzial, sogar in dieser gefährdeten Population [32, 33]. Atomoxetin unterschied sich im Gegensatz zu Methylphenidat nicht vom Plazebo hinsichtlich der subjektiven Wahrnehmung eines stimulierenden Effekts [32]. Gleiche Befunde zeigte eine zweite Studie [33], in der Probanden untersucht wurden, die vorzugsweise Amphetamine missbräuchlich verwendeten. Ergänzend wurde in dieser Studie der mögliche „Straßenverkaufswert“ im The Street Value Assessment Questionnaire [17] ermittelt. Im Gegensatz zu Methylphenidat und dem Amphetaminderivat Phentermin unterschied sich der Preis von Atomoxetin, den die Probanden bereit gewesen wären zu bezahlen, wenn sie die gerade eingenommene Substanz auf der Straße kaufen könnten, nicht von Plazebo [33]. Diese Befunde führten dazu, dass Atomoxetin, im Gegensatz zu allen anderen in Deutschland zugelassenen ADHS-Arzneimitteln, nicht unter die Regelungen des Betäubungsmittelgesetzes fällt und keiner Sonderverordnung (BtM-Rezept) bedarf.
Tab. 1. Übersicht der Studien zur Wirksamkeit von Atomoxetin
|
Studie |
Primäre Fragestellung |
Design |
Fallzahlen |
Dosierung mg/Tag (Regime) |
Veränderung der ADHS-Symptomatik |
|
Akutstudien |
|||||
|
Michelson et al. 2003, Studie 1 [42] |
Überlegenheit ATX vs. PBO in der Verbesserung der ADHS-Symptomatik |
RCT 10 Wochena |
ATX =133 PBO =134 |
60–120 (2-mal tägl.) |
Mittlere Veränderung vom Ausgangswert (CAARS-Inv): ATX –9,5; PBO –6,0; p=0,006 Effektstärke =0,35 |
|
Michelson et al. 2003, Studie 2 [42] |
Überlegenheit ATX vs. PBO in der Verbesserung der ADHS-Symptomatik |
RCT 10 Wochena |
ATX =124 PBO =124 |
60–120 (2-mal tägl.) |
Mittlere Veränderung vom Ausgangswert (CAARS-Inv): ATX –10,5; PBO –6,7; p=0,002 Effektstärke =0,40 |
|
Wilens et al. |
Überlegenheit ATX vs. PBO in der Verbesserung der ADHS-Symptomatik bei Patienten mit einem komorbiden Alkoholmissbrauch |
RCT 12 Wochen |
ATX =72 PBO =75 |
40–100 MW: 89,9 (1-mal tägl.)b |
Mittlere Veränderung vom Ausgangswert (AISRS): ATX –13,6; PBO –8,3; p=0,007 Effektstärke =0,48 |
|
Adler et al. |
Überlegenheit ATX vs. PBO in der Verbesserung der ADHS-Symptomatik bei Patienten mit einer komorbiden Sozialphobie oder GAD |
RCT 14 Wochena |
ATX =176 PBO =166 |
40–100 MW: 82,9 (2-mal tägl.) |
Mittlere Veränderung vom Ausgangswert (CAARS-Inv): ATX –8,7; PBO –5,6; p<0,001 Effektstärke =0,47 |
|
Durell et al. |
Überlegenheit ATX vs. PBO in der Verbesserung der ADHS-Symptomatik und Lebensqualität |
RCT 12 Wochen |
ATX=220 PBO=225 |
40–100 (2-mal tägl.) |
Mittlere Veränderung vom Ausgangswert (CAARS-Inv): ATX –13,6; PBO –9,3; p<0,001 |
|
Langzeitstudien |
|||||
|
Adler et al. |
Überlegenheit ATX vs. PBO in der Verbesserung der Arbeitsproduktivität |
RCT 6 Monate |
ATX =271 PBO =139 |
40–100 MW: 85,2 (1-mal tägl.)c |
Kein statistisch signifikanter Unterschied ATX vs. PBO bzgl. des primären (EWPS) und der meisten sekundären Endpunkte |
|
Adler et al. |
Überlegenheit ATX vs. PBO in der Verbesserung der ADHS-Symptomatik |
RCT 6 Monate |
ATX =250 PBO =251 |
25–100 MW: 84,5 (1-mal tägl.) |
Mittlere Veränderung vom Ausgangswert (CAARS-Inv): ATX –13,2; PBO –10,2; p=0,005 |
|
Young et al. |
Überlegenheit ATX vs. PBO in der Verbesserung der ADHS-Symptomatik |
RCT 6 Monate |
ATX =268 PBO =234 |
60–100 MW: 90,3 (1-mal tägl.) |
Mittlere Veränderung vom Ausgangswert (CAARS-Inv): ATX –14,3; PBO –8,3; p<0,001 Effektstärke =0,57 |
|
Adler et al. |
Langzeitstudie zur Wirksamkeit, Sicherheit und Verträglichkeit von ATX bei Patienten, die zuvor an einer ATX-Akutstudie teilgenommen haben |
Offen 4 Jahre |
ATX =384 |
25–120 (1- bis 2-mal tägl.) |
Mittlere Veränderung vom Ausgangswert (CAARS-Inv): –8,8; p<0,001 Keine Hinweise auf signifikante Unterschiede im Vergleich zu den Akutstudien hinsichtlich Art und Häufigkeit der behandlungsbedingten unerwünschten Ereignisse. |
|
Weitere Studien |
|||||
|
Upadhyaya et al. |
Überlegenheit ATX vs. PBO in der Aufrechterhaltung der Response bei Patienten, die in einer 3-monatigen offenen und einer 3-monatigen verblindeten Phase unter Therapie mit ATX respondiert haben |
RCT 6 Monate (zuvor 3 Monate offen und 3 Monate verblindet) |
ATXd =2017 ATXe =266 PBOe =258 |
80 oder 100 (1-mal tägl.)c |
Überlegenheit ATX vs. PBO in der Aufrechterhaltung der Response: ATX 64,3%; PBO 50,0%; p<0,001 |
AISRS: Adult ADHD Investigator Symptoms Rating Scale; ATX: Atomoxetin; CAARS-Inv: Conners’ Adult ADHD Rating Scale-Investigator Rated; EWPS: Endicott Work Productivity Scale; LSAS: Liebowitz Social Anxiety Scale; GAD: generalisierte Angststörung; MW: Mittelwert, RCT: randomisierte klinische Studie; PBO: Plazebo.
a Nach 2-wöchiger verblindeter Plazebo-Einführungsphase
b 80 mg oder 100 mg auch als 2-mal tägl. Gabe möglich
c Auch als 2-mal tägl. Gabe möglich
d Initiale offene Studienphase
e Nach Randomisierung
Wirksamkeit von Atomoxetin bei Erwachsenen mit ADHS (Tab. 1)
Eine erste Pilotstudie zur Wirksamkeit und Verträglichkeit von Atomoxetin bei Erwachsenen mit ADHS wurde Ende der 90er-Jahre von Spencer und Mitarbeitern durchgeführt [49]. In der Plazebo-kontrollierten doppelblinden Cross-over-Studie mit 22 Männern und Frauen im Alter von 19 bis 60 Jahren zeigte sich Atomoxetin bei einer Ansprechrate von etwa 52% derart wirksam und verträglich, dass weitere Studien mit größeren Patientenpopulationen durchgeführt werden konnten.
Danach wurden sechs weitere multizentrische Plazebo-kontrollierte doppelblinde Akutstudien mit einer Dauer von 10, 12 und 16 Wochen an 1962 Männern und Frauen mit ADHS durchgeführt [3, 10, 42, 51, 55]. Primäre Zielgröße zur Beurteilung der Wirksamkeit in diesen Studien war entweder der Summenwert der ADHS-Subskalen der Conners’ Adult ADHD Rating Scale-Investigator Rated: Screening Version (CAARS-Inv) [18] oder in einer der Studien die ADHD Investigator Symptom Rating Scale (AISRS) [2]. Beides sind Instrumente zur Beurteilung der 18 Kernsymptome der ADHS nach DSM-IV-TR [8] durch den Untersucher. Die Behandlung mit Atomoxetin wurde in diesen Studien mit 25 bis 60 mg/Tag begonnen und auf bis zu 100 bis 120 mg/Tag erhöht. Je nach Studie wurde die Dosis einmal oder zweimal täglich oder wahlweise gegeben. In jeder dieser Studien war Atomoxetin dem Plazebo bezüglich der Verbesserung der Symptomatik statistisch signifikant überlegen [3, 42, 51, 55]. Eine Überlegenheit gegenüber Plazebo konnte auch für die subjektive Einschätzung der Symptomverbesserung mittels Selbstbeurteilungs-Skalen gezeigt werden [42, 51, 55].
In einer Post-hoc-Analyse zweier Studien [44] wurden die Domänen Affektlabilität, Temperament, emotionale Überreagibilität (Stressintoleranz) und Impulsivität der Wender-Reimherr Adult Attention Deficit Disorder Scale (WRAADDS) [54] untersucht. Diese Domänen können unter dem Überbegriff der emotionalen Dysregulation zusammengefasst werden und als Bestandteil der breiteren Psychopathologie der ADHS angesehen werden. Die Kriterien für das Vorhandensein einer zusätzlichen emotionalen Dysregulation wurden von 32% der Studienteilnehmer erfüllt. Sie wiesen eine höhere Symptomausprägung der ADHS auf, waren psychosozial stärker beeinträchtigt und zeigten ein geringes Ansprechen auf Plazebo und eine größere Ansprechrate auf Atomoxetin als diejenigen ohne emotionale Dysregulation. Der Behandlungseffekt auf die emotionale Dysregulation war mindestens ebenso groß wie der auf die ADHS-Symptomatik und erreichte eine Effektstärke von 0,6 [44].
Im Gegensatz zu den pädiatrischen Studien wurden in den Studien bei Erwachsenen Unterschiede hinsichtlich Symptomausprägung und Therapieerfolg für Frauen und Männer beobachtet [45]. Frauen wiesen eine stärkere ADHS-Symptomatik auf und erfüllten häufiger die Kriterien für eine zusätzliche emotionale Dysregulation. Sie zeigten sowohl auf die ADHS- als auch auf die emotionale Symptomatik numerisch einen größeren Behandlungseffekt. Dieser Unterschied war statistisch signifikant für die emotionale Dysregulation. Auch hinsichtlich des Alters wurden Unterschiede für die Wirksamkeit festgestellt [23]. Jüngere Erwachsene von 18 bis 25 Jahren (mittleres Alter 21,6 Jahre) zeigten einen größeren Behandlungseffekt als Studienteilnehmer über 25 Jahre (mittleres Alter 43,4 Jahre). Im CAARS-Inv wurde für die jüngeren Erwachsenen eine Effektstärke von 0,80, für die älteren eine Effektstärke von 0,33 ermittelt. Die Responseraten betrugen 56,4% für die jüngeren und 47,8% für die älteren Studienteilnehmer.
Wirksamkeit von Atomoxetin bei Vorliegen komorbider Störungen
Um zu demonstrieren, dass der Effekt von Atomoxetin auf die ADHS unabhängig von möglichen Effekten auf komorbide Störungen ist, waren Patienten mit Komorbiditäten wie einer Depression oder Angststörung von den Studien in der Regel ausgeschlossen. In jeweils einer Studie wurden dagegen spezielle Patientengruppen untersucht, die eine komorbide Alkoholmissbrauchsproblematik oder eine komorbide Angststörung (Soziophobie) aufwiesen und in denen der Einfluss von Atomoxetin auf den Rückfall in den Alkoholkonsum bzw. die Verschlechterung der Angstsymptomatik als sekundärer Endpunkt vordefiniert war [3, 55].
Bei Alkoholmissbrauch
Auch bei Patienten mit ADHS und komorbidem Alkoholmissbrauch, die seit mindestens vier und maximal 30 Tagen abstinent waren, war Atomoxetin dem Plazebo in der Verbesserung der ADHS-Symptomatik signifikant überlegen (p=0,007). Keinen Unterschied zeigten die Behandlungsgruppen hinsichtlich der Zeit bis zum Rückfall in einen massiven Alkoholkonsum (p=0,93). Eine Post-hoc-Analyse ergab jedoch, dass Atomoxetin im Vergleich zu Plazebo die Anzahl der Tage, an denen im Studienverlauf von 12 Wochen massiv Alkohol konsumiert wurde, um 26% reduzierte (Event-Ratio 0,74; p=0,023) [55].
Bei Angststörung
Eine zweite Studie in einem ADHS-Patientenkollektiv mit einer komorbiden Angststörung zeigte, dass sich bei Patienten mit einer zusätzlichen sozialen Phobie sowohl die ADHS-Symptomatik als auch die Soziophobie im Vergleich zu Plazebo statistisch signifikant besserte, jedoch nicht die generalisierte Angststörung [3]. Dieser Befund ist relevant vor dem Hintergrund, dass bei Patienten mit ADHS häufig Angststörungen gefunden werden und dass eine Angstsymptomatik unter Stimulanzien-Therapie aggravieren kann [25].
Wirksamkeit von Atomoxetin in der längerfristigen Therapie
Neben den Akutstudien wurden drei Plazebo-kontrollierte doppelblinde Langzeitstudien mit einem Beobachtungszeitraum von sechs Monaten [4, 5, 57], eine offene Langzeitstudie mit vier Jahren Studiendauer [7] und eine doppelblinde randomisierte Plazebo-kontrollierte Studie zur Aufrechterhaltung der Response durchgeführt [52, 53]. In zwei der drei Studien mit einer Studiendauer von 24 Wochen war die Reduktion der ADHS-Symptomatik im Vergleich zu Plazebo die primäre Fragestellung. In beiden Studien war Atomoxetin dem Plazebo sowohl nach 10, 12 als auch nach 24 Wochen statistisch signifikant überlegen (Abb. 1) [4, 57].
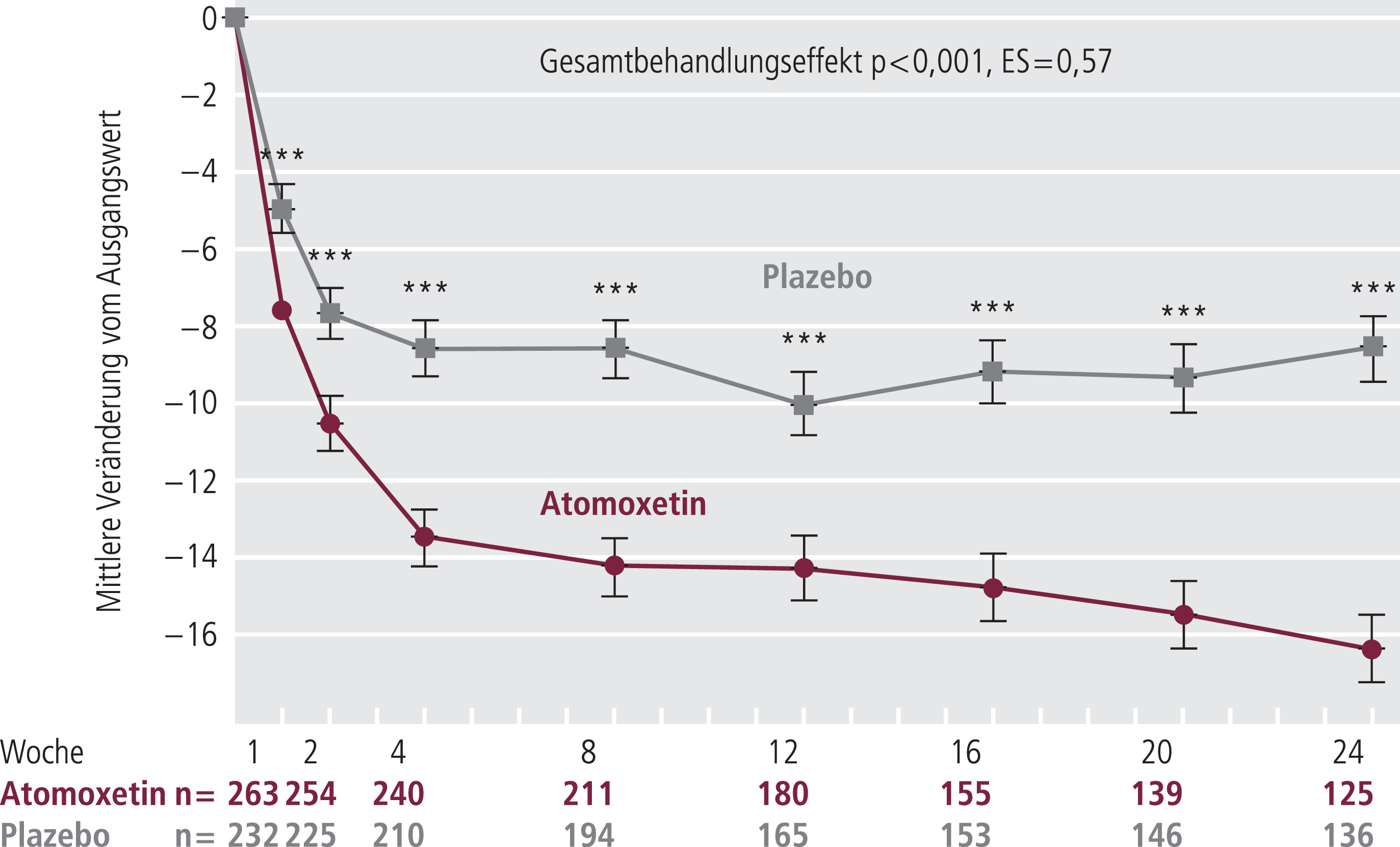
Abb. 1. Verbesserung der ADHS-Kernsymptomatik (CAARS-Inv) mit Atomoxetin im zeitlichen Verlauf von 24 Wochen (***p<0,001, ES =Effektstärke) [mod. nach 57]
In einer dieser Studien wurde besonderes Augenmerk auf die abendliche Symptomatik gelegt. In der Selbst- und Fremdbeurteilung demonstrierte Atomoxetin bei einer einmal täglichen Gabe am Morgen signifikante Wirksamkeit, die bis in die Abendstunden anhielt (p<0,001) [4]. Die im Vergleich zu den Stimulanzien lange Wirkdauer von Atomoxetin, die den gesamten Tag umfasst, kann von möglichem Vorteil sein, da Stimulanzien gegebenenfalls mehrfach täglich eingenommen werden müssen und Rebound-Phänomene auftreten können. In der Selbstbeurteilung der Lebensqualität, die mittels der Adult ADHD Quality of Life Scale (AAQol) [14] erhoben wurde, konnte unter Behandlung mit Atomoxetin im Vergleich zum Plazebo bereits nach zehn Wochen eine signifikante Verbesserung beobachtet werden. Am Studienende zeigte Atomoxetin sowohl im Gesamtwert als auch in drei der vier Domänen der AAQol statistisch signifikant größere Verbesserungen als Plazebo (Abb. 2) [4].
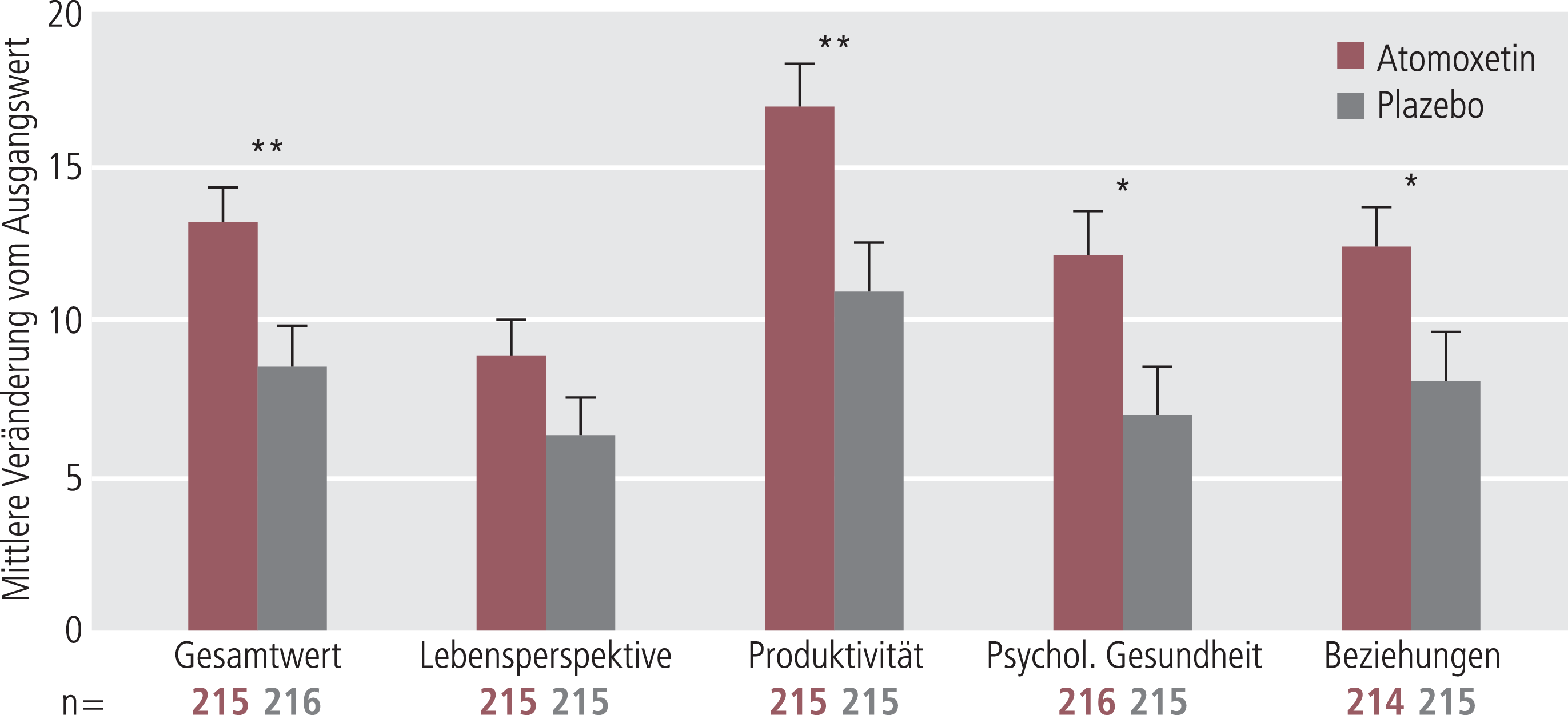
Abb. 2. Verbesserung der Lebensqualität (AAQoL) nach 24 Wochen Therapie mit Atomoxetin (*p<0,05; **p<0,01) [mod. nach 4]
In einer offene Langzeitstudie [7], in der Patienten nach Abschluss der doppelblinden Akutstudien über einen Zeitraum von bis zu vier Jahren nachverfolgt wurden, zeigten die Patienten im Vergleich zum Ausgangswert sowohl im CAARS-Inv eine weitere Verbesserung ihrer ADHS-Symptomatik um 30,2% (p<0,01) als auch eine Verbesserung des Funktionsniveaus auf der Sheehan Disability Scale [39] von 25,3% (p<0,001) [7].
Die doppelblinde, randomisierte, Plazebo-kontrollierte Studie zur Aufrechterhaltung der Response [52, 53] wurde mehrheitlich in Europa, auch unter deutlicher Beteiligung deutscher Zentren, durchgeführt und ist ein wesentlicher Bestandteil des europäischen Zulassungsantrags für die Indikationserweiterung von Atomoxetin zur Behandlung der ADHS im Erwachsenenalter. In dieser Studie wurden 2013 Patienten in einer ersten offenen Studienphase rund 12 Wochen mit Atomoxetin behandelt. Patienten, die die Responsekriterien erfüllten, wurden danach verblindet für weitere 12 Wochen mit Atomoxetin behandelt. In der letzten Studienphase wurden die Patienten, die in der offenen Phase zu Beginn der Studie respondiert und diese Response in der verblindeten Phase beibehalten hatten, mit der Fragestellung der Aufrechterhaltung der Response für weitere 25 Wochen erneut verblindet randomisiert, und zwar entweder auf Weiterbehandlung mit Atomoxetin oder Plazebo. Am Studienende (nach etwa einem Jahr) war die Weiterbehandlung mit Atomoxetin der mit Plazebo in der Aufrechterhaltung der Response statistisch signifikant überlegen (64,3% mit Atomoxetin vs. 50% mit Plazebo, p<0,001), womit die Hypothese dieser großen und komplexen Studie bestätigt wurde.
Verträglichkeit und unerwünschte Wirkungen von Atomoxetin bei Erwachsenen
Eine Analyse von 15 Studien mit insgesamt 4829 erwachsenen ADHS-Patienten, mit einer Gesamtbehandlungsdauer mit Atomoxetin von über 2152 Patientenjahren, ergab keine unerwarteten oder neuen signifikanten Erkenntnisse in Bezug auf das bereits bekannte Sicherheits- und Verträglichkeitsprofil von Atomoxetin [40].
Unter Behandlung mit Atomoxetin traten im Vergleich zum Plazebo häufiger die für noradrenerge Substanzen typischen unerwünschten Wirkungen auf (Übelkeit, Mundtrockenheit, Verstopfungen, abdominale Beschwerden, Müdigkeit, verminderter Appetit, Schwindel, Schläfrigkeit, Schlaflosigkeit, Harnverhalt, erektile Dysfunktion).
Hinsichtlich der Häufigkeit, der als schwerwiegend klassifizierten unerwünschten Ereignisse wurden keine Unterschiede zwischen den mit Atomoxetin und den mit Plazebo behandelten Patienten gesehen. Dabei wurde kein Ereignis gefunden, das unter Atomoxetin gehäuft auftrat oder einen Hinweis auf eine systematische Toxizität der Substanz lieferte.
Die Studienabbruchraten aufgrund von unerwünschten Ereignissen waren mit 8,9% in der Akutbehandlung (10 bis 16 Wochen) und 17,9% in der längerfristigen Behandlung (6 Monate) in der mit Atomoxetin behandelten Gruppe signifikant häufiger als mit Plazebo (4,0% bei Akutbehandlung bzw. 6,3% bei Langzeitbehandlung).
Unter Behandlung mit Atomoxetin wurde im Mittel eine Gewichtsreduktion beobachtet. Etwa ein Drittel der Patienten, die mindestens ein Jahr mit Atomoxetin behandelt wurden, zeigte eine Gewichtreduktion von ≥7%. Diese Patienten waren zu Studienbeginn im Mittel übergewichtig und schwerer als diejenigen, die eine geringere oder keine Gewichtsreduktion aufwiesen.
Es wurden keine klinisch relevanten Veränderungen der Laborwertparameter gefunden. Einzelne Patienten zeigten über die Norm erhöhte Leberwerte, ohne dass Unterschiede zwischen den mit Atomoxetin oder den mit Plazebo behandelten Patienten gefunden wurden.
Wie pharmakologisch zu erwarten, hat Atomoxetin einen noradrenergen Effekt auf kardiovaskuläre Parameter. In den Akut- und Langzeitstudien kam es zu moderaten mittleren Erhöhungen der Herzfrequenz von <10 Schlägen/Minute und des Blutdrucks (systolisch und diastolisch) von <5 mmHg. Bei einigen Patienten (etwa 6 bis 12%) können klinisch relevante Erhöhungen auftreten, die bei 15 bis 32% der davon betroffenen Patienten bei Fortführung der Therapie mit Atomoxetin bestehen bleiben können. Daher sollten Herzfrequenz- und Blutdruckmessungen bei Patienten unter Atomoxetin-Therapie entsprechend den Vorgaben der Fachinformation durchgeführt werden [26].
Ein systematischer Zusammenhang zwischen Atomoxetin und klinisch signifikanten unerwünschten Effekten auf die kardiale Repolarisationszeit (QTc-Intervall) wurde nicht gefunden [41]. Die Möglichkeit eines erhöhten Risikos für eine QT-Zeit-Verlängerung besteht aber, wenn Atomoxetin zusammen mit anderen Arzneimitteln eingenommen wird, die das QT-Intervall verlängern, den Elektrolythaushalt stören oder CYP2D6 inhibieren [26]. In einer großen retrospektiven Fallkontrollstudie auf Basis von Daten von Krankenkassen, Krankenakten und Sterberegistern wurden mehr als 150000 erwachsene Patienten, die mit ADHS-Arzneimitteln (Stimulanzien, Atomoxetin) behandelt wurden, mit Kontrollen verglichen. Die medikamentös behandelten Patienten unterschieden sich nicht von den Kontrollen hinsichtlich des Auftretens eines Myokardinfarkts, plötzlichen Herztods oder Schlaganfalls [31].
Die Fachinformation von Strattera® (Atomoxetin) enthält einen Warnhinweis auf ein Risiko für suizidale Gedanken und Handlungen [26]. Jedoch zeigen die Analysen der Studien mit erwachsenen Patienten, dass sich bei diesen Atomoxetin und Plazebo hinsichtlich des Risikos für suizidales oder selbstverletzendes Verhalten nicht signifikant unterschieden [40].
Fazit und Ausblick
Im letzten Jahrzehnt hat das öffentliche Interesse an ADHS deutlich zugenommen. Obwohl die Störung weiterhin ein Randgebiet darstellt, findet sie zunehmend Beachtung in der Erwachsenenpsychiatrie. Hier besteht die Gefahr, eine potenziell gut zu behandelnde Erkrankung zu übersehen, was angesichts der psychosozialen Konsequenzen einer ADHS langfristige Folgen für die Betroffenen haben kann.
Es ist zu begrüßen, dass sich durch die Verschreibungs- und Erstattungsfähigkeit einzelner ADHS-Arzneimittel die bislang unzureichende Versorgungssituation von erwachsenen Patienten mit ADHS verbessert hat. Weiterhin unzureichend ist in Europa die Verfügbarkeit psychotherapeutischer Versorgung von ADHS-Patienten, die derzeit noch vorwiegend in spezialisierten psychiatrischen Kliniken oder in psychosomatischen Rehabilitationskliniken angeboten wird.
Im Vergleich mit den Stimulanzien zeigt Atomoxetin einige Besonderheiten, die möglicherweise auf die unterschiedlichen pharmakologischen Angriffspunkte zurückzuführen sind. Der Arzneistoff hatte bereits seit Jahren eine Zulassung zur Behandlung der ADHS im Kindes- und Jugendalter und zur Fortführung in das Erwachsenenalter hinein.
Die Zulassung der Indikationserweiterung zum Behandlungsbeginn im Erwachsenenalter fußt auf einer vergleichsweise soliden Datenbasis. Neben den kurz- bis mittelfristigen Studien, die eine Überlegenheit von Atomoxetin gegenüber Plazebo zeigten, liegen insgesamt vier Langzeituntersuchungen über einen Therapieverlauf von bis zu vier Jahren vor sowie Studien zur Wirksamkeit bei ADHS mit komorbiden Erkrankungen. Interessant ist hierbei, dass sich im Langzeitverlauf der medikamentösen Therapie – über die initiale Wirksamkeit hinaus – Verbesserungen bezüglich der ADHS-Kernsymptomatik und im psychosozialen Funktionsniveau zeigten.
Des Weiteren ist von Interesse, dass Atomoxetin bei ADHS-Patienten mit Alkoholproblematik und bei komorbiden Angststörungen eingesetzt werden kann. Im Unterschied zur Behandlung mit Stimulanzien ist bei diesen Behandlungsgruppen eher von einer positiven Wirkung auf die Angstsymptomatik auszugehen.
Weitere Vorteile der Substanz liegen in der langen Wirkdauer, dem offenbar fehlenden Missbrauchspotenzial und der einfacheren Verschreibungsfähigkeit im Vergleich zu Stimulanzien. Mit Atomoxetin ist eine weitere Option vorhanden, die in der Therapiestrategie der ADHS im Kindes- und Jugendalter und der ADHS im Erwachsenenalter die Möglichkeiten erweitert, auf einzelne Patienten und deren individuelles Behandlungsbedürfnis einzugehen.
Interessenkonflikterklärung
CB, SK, ES sind Mitarbeiter bei Lilly Deutschland GmbH.
KK hat Honorare, Unterstützung oder Drittmittel von den folgenden Firmen erhalten: EliLilly, Servier, Lundbeck, Janssen-Cilag, Bristol-Myers Squibb.
Literatur
1. Able SL, Johnston JA, Adler LA, Swindle RW. Functional and psychological impairment in adults with undiagnosed ADHD. Psychol Med 2007;37:97–107.
2. Adler LA, Dietrich A, Reimherr FW, Taylor LV, et al. Safety and tolerability of once versus twice daily atomoxetine in adults with ADHD. Ann Clin Psychiatry 2006;18:107–13.
3. Adler LA, Liebowitz M, Kronenberger W, Qiao M, et al. Atomoxetine treatment in adults with attention-deficit/hyperactivity disorder and comorbid social anxiety disorder. Depress Anxiety 2009;26:212–21.
4. Adler LA, Spencer T, Brown TE, Holdnack J, et al. Once-daily atomoxetine for adult attention-deficit/hyperactivity disorder: a 6-month, double-blind trial. J Clin Psychopharmacol 2009;29:44–50.
5. Adler LA, Spencer TJ, Levine LR, Ramsey JL, et al. Functional outcomes in the treatment of adults with ADHD. J Atten Disord 2008;11:720–7.
6. Adler LA, Spencer TJ, Stein M, Newcorn JH. Best practices in adult ADHD: epidemiology, impairments, and differential diagnosis. CNS Spectrums 2008;13:1–19.
7. Adler LA, Spencer TJ, Williams DW, Moore RJ, et al. Long-term, open-label safety and efficacy of atomoxetine in adults with ADHD: final report of a 4-year study. J Atten Disord 2008;12:248–53.
8. American Psychiatric Association. Diagnostic and statistical manual of mental disorders: DSM-IV-TR. Washington, DC: American Psychiatric Press, 2000.
9. American Psychiatric Association. Diagnostic and statistical manual of mental disorders: DSM-5. Washington, DC: American Psychiatric Publishing, 2013.
10. Atomoxetine to treat Asian adult patients with attention-deficit/hyperactivity disorder. ClinicalTrials.gov identifier: NCT00962104. www.clinicaltrials.gov/ct2/show/NCT00962104?term=lyee&rank=1 (Zugriff am 5.11.2013).
11. Banaschewski T, Coghill D, Santosh P, Zuddas A, et al. Long-acting medications for the hyperkinetic disorders. A systematic review and European treatment guideline. Eur Child Adolesc Psychiatry 2006;15:476–95.
12. Barkley RA, Fischer M, Smallish L, Fletcher K. Young adult outcome of hyperactive children: adaptive functioning in major life activities. J Am Acad Child Adolesc Psychiatry 2006;45:192–202.
13. Berger M (Hrsg.). Psychiatrie und Psychotherapie. München: Urban & Schwarzenberg, 2000.
14. Brod M, Johnston J, Able S, Swindle R. Validation of the adult attention-deficit/hyperactivity disorder quality-of-life scale (AAQoL): a disease-specific quality-of-life measure. Qual Life Res 2006;15:117–29.
15. Bush G. Cingulate, frontal, and parietal cortical dysfunction in attention-deficit/hyperactivity disorder. Biol Psychiatry 2011;69:1160–7.
16. Bymaster FP, Katner JS, Nelson DL, Hemrick-Luecke SK, et al. Atomoxetine increases extracellular levels of norepinephrine and dopamine in prefrontal cortex of rat: a potential mechanism for efficacy in attention deficit/hyperactivity disorder. Neuropsychopharmacology 2002;27:699–711.
17. Cole JO, Levin A, Beake B, Kaiser PE, et al. Sibutramine: a new weight loss agent without evidence of the abuse potential associated with amphetamines. J Clin Psychopharmacol 1998;18:231–6.
18. Conners CK, Erhardt D, Sparrow E. Conners’ Adult ADHD Rating Scales (CAARS). Technical Manual. North Tonawanda, NY: Multi-Health Systems, 1999.
19. Creighton CJ, Ramabadran K, Ciccone PE, Liu J, et al. Synthesis and biological evaluation of the major metabolite of atomoxetine: elucidation of a partial kappa-opioid agonist effect. Bioorg Med Chem Lett 2004;14:4083–5.
20. Curatolo P, D’Agati E, Moavero R. The neurobiological basis of ADHD. Ital J Pediatr 2010;36:79.
21. de Graaf R, Kessler RC, Fayyad J, ten Have M, et al. The prevalence and effects of adult attention-deficit/hyperactivity disorder (ADHD) on the performance of workers: results from the WHO World Mental Health Survey Initiative. Occup Environ Med 2008;65:835–42.
22. Döpfner M. Persönliche Kommunikation. 15. Juni 2013.
23. Durell T, Adler L, Wilens T, Paczkowski M, et al. Atomoxetine treatment for ADHD: younger adults compared with older adults. J Atten Disord 2010;13:401–6.
24. Ebert D, Krause J, Roth-Sackenheim C. ADHS im Erwachsenenalter – Leitlinien auf Basis eines Expertenkonsensus mit Unterstützung der DGPPN. Nervenarzt 2003;74:939–46.
25. Fachinformation Medikinet® adult, Stand: Juni 2012.
26. Fachinformation Strattera®, Stand: Mai 2013.
27. Faraone SV, Mick E. Molecular genetics of attention deficit hyperactivity disorder. Psychiatr Clin of North Am 2010;33:159–80.
28. Faraone SV, Perlis RH, Doyle AE, Smoller JW, et al. Molecular genetics of attention-deficit/hyperactivity disorder. Biol Psychiatry 2005;57:1313–23.
29. Fayyad J, de Graaf R, Kessler R, Alonso J, et al. Cross-national prevalence and correlates of adult attention-deficit hyperactivity disorder. Br J Psychiatry 2007;190:402–9.
30. Ferrer M, Andión O, Matalí J, Valero S, et al. Comorbid attention-deficit/hyperactivity disorder in borderline patients defines an impulsive subtype of borderline personality disorder. J Pers Disord 2010;24:812–22.
31. Habel LA, Cooper WO, Sox CM, Chan KA, et al. ADHD medications and risk of serious cardiovascular events in young and middle-aged adults. JAMA 2011;306:2673–83.
32. Heil SH, Holmes HW, Bickel WK, Higgins ST, et al. Comparison of the subjective, physiological, and psychomotor effects of atomoxetine and methylphenidate in light drug users. Drug Alcohol Depend 2002;67:149–56.
33. Jasinski DR, Faries DE, Moore RJ, Schuh LM, et al. Abuse liability assessment of atomoxetine in a drug-abusing population. Drug Alcohol Depend 2008;95:140–6.
34. Kahl KG. ADHS: Komorbidität und Differentialdiagnose. In: Kahl KG, Puls JH, Schmid S (Hrsg.). Praxishandbuch ADHS. Stuttgart: Georg Thieme Verlag, 2012.
35. Kessler RC, Akiskal HS, Ames M, Birnbaum H, et al. Prevalence and effects of mood disorders on work performance in a nationally representative sample of U.S. workers. Am J Psychiatry 2006;163:1561–8.
36. Kessler RC, Lane M, Stang PE, Van Brunt DL. The prevalence and workplace costs of adult attention deficit hyperactivity disorder in a large manufacturing firm. Psychol Med 2009;39:137–47.
37. Klein RG, Mannuzza S, Olazagasti MA, Roizen E, et al. Clinical and functional outcome of childhood attention-deficit/hyperactivity disorder 33 years later. Arch Gen Psychiatry 2012;69:1295–303.
38. Kooij JJ, Huss M, Asherson P, Akehurst R, et al. Distinguishing comorbidity and successful management of adult ADHD. J Atten Disord 2012;16(Suppl 5):3S–19S.
39. Leon AC, Olfson M, Portera L, Farber L, et al. Assessing psychiatric impairment in primary care with the Sheehan Disability Scale. Int J Psychiatry Med 1997;27:93–105.
40. Lilly, data on file.
41. Loghin C, Haber H, Beasley CM, Kothare PA, et al. Effects of atomoxetine on the QT interval in healthy CYP2D6 poor metabolizers. Br J Clin Pharmacol 2012; doi: 10.1111/j.1365–2125.2012.04382.x [Epub ahead of print].
42. Michelson D, Adler L, Spencer T, Reimherr FW, et al. Atomoxetine in adults with ADHD: two randomized, placebo-controlled studies. Biol Psychiatry 2003;53:112–20.
43. Rao P, Place M. Prevalence of ADHD in four general adult outpatient clinics in north east England. Progress in Neurology and Psychiatry 2011;15:7–10.
44. Reimherr FW, Marchant BK, Strong RE, Hedges DW, et al. Emotional dysregulation in adult ADHD and response to atomoxetine. Biol Psychiatry 2005;58:125–31.
45. Robison RJ, Reimherr FW, Marchant BK, Faraone SV, et al. Gender differences in 2 clinical trials of adults with attention-deficit/hyperactivity disorder: a retrospective data analysis. J Clin Psychiatry 2008;69:213–21.
46. Sauer JM, Long AJ, Ring B, Gillespie JS, et al. Atomoxetine hydrochloride: clinical drug-drug interaction prediction and outcome. J Pharmacol Exp Ther 2004;308:410–8.
47. Schlack R, Hölling H, Kurth BM, Huss M. Die Prävalenz der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) bei Kindern und Jugendlichen in Deutschland. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2007;50:827–35.
48. Sobanski E, Sabljic D, Alm B, Skopp G, et al. Driving-related risks and impact of methylphenidate treatment on driving in adults with attention-deficit/hyperactivity disorder (ADHD). J Neural Transm 2008;115:347–56.
49. Spencer T, Biederman J, Wilens T, Prince J, et al. Effectiveness and tolerability of tomoxetine in adults with attention deficit hyperactivity disorder. Am J Psychiatry 1998; 155:693–5.
50. The British Psychological Society and the Royal College of Psychiatrists; National Collaborating Centre for Mental Health. Attention deficit disorder: the NICE guideline on diagnosis and management of ADHD in children, young people and adults. 2009 www.nice.org.uk/nicemedia/pdf/ADHDFullGuideline.pdf .
51. Durell TM, Adler LA, Williams A, Deldar A, et al. Atomoxetine treatment of attention deficit/hyperactivity disorder in young adults with assessment of functional outcomes: a randomized double-blind, placebo-controlled clinical trial. J Clin Psychopharmacol 2013;33:45–54.
52. Upadhyaya H, Ramos-Quiroga JA, Williams D, Tanaka Y, et al. Maintenance of response after open-label treatment with atomoxetine in adults with attention-deficit/hyperactivity disorder. J Euro Coll Neuropsychopharmacol 2012;22(Suppl 2):S427.
53. Upadhyaya H, William D, Lane J, Camporeale A, et al. Efficacy and safety of atomoxetine hydrochloride in a placebo-controlled randomized withdrawal study in adults with attention-deficit/hyperactivity disorder. Atten Defic Hyperact Disord 2013;5:222.
54. Wender PH, Reimherr FW, Wood D, Ward M. A controlled study of methylphenidate in the treatment of attention deficit disorder, residual type, in adults. Am J Psychiatry 1985;142:547–52.
55. Wilens TE, Adler LA, Weiss MD, Michelson D, et al. Atomoxetine treatment of adults with ADHD and comorbid alcohol use disorders. Drug Alcohol Depend 2008;96:145–54.
56. WHO-ICD10. http://apps.who.int/classifications/icd10/browse/2010/en (Zugriff am 5.11.2013).
57. Young JL, Sarkis E, Qiao M, Wietecha L, et al. Once-daily treatment with atomoxetine in adults with attention-deficit/hyperactivity disorder: a 24-week, randomized, double-blind, placebo-controlled trial. Clin Neuropharmacol 2011;34:51–60.
Dr. rer. nat. Christoph Bartel, Dr. med. Susanne Kraemer, Dr. med. Edith Schneider, Medizinische Abteilung ZNS, Lilly Deutschland GmbH, Werner-Reimers-Str. 2–4, 61350 Bad Homburg, E-Mail: bartel_christoph@lilly.com
Prof. Dr. med. Kai G. Kahl, Klinik für Psychiatrie, Sozialpsychiatrie und Psychotherapie, Medizinische Hochschule Hannover, Carl-Neuberg-Straße 1, 30161 Hannover, E-Mail: kahl.kai@mh-hannover.de
Atomoxetine for the treatment of attention deficit hyperactivity disorder (ADHD) in adults
The attention deficit hyperactivity disorder (ADHD) is a well-established diagnosis among children and adolescents. Symptoms of ADHD can persist well into adulthood. Abundant research and medical evidence support the diagnosis of ADHD in adults, but due to insufficient diagnostic criteria in the ICD-10 and DSM-IV-TR manuals, uncertainties exist regarding the validity and reliability of the diagnosis among this age group. DSM-5, published in May 2013 constitutes an advancement in this respect. Stimulants are the most common types of pharmacological treatment used in ADHD, but because they are controlled substances, their availability is restricted. Since several years, however, atomoxetine is available for the treatment of ADHD in children and adolescents. As a selective norepinephrine reuptake inhibitor, atomoxetine has a different mechanism of action from stimulant drugs, and is the only non-stimulant drug approved in Germany for the treatment of ADHD in pediatric patients. Based on data generated during the past years that establish the efficacy and safety of atomoxetine in adults, an extended indication has been granted in Germany in June 2013.
Key words: ADHD, adults, pharmacotherapy, atomoxetine
Psychopharmakotherapie 2013; 20(06)
