Dipl.-Biol. Anne Bleick, Stuttgart
Mehr als die Hälfte der Patienten mit multipler Sklerose (MS) entwickeln im Laufe der Erkrankung Symptome einer Spastik. Fast alle MS-Patienten mit Spastik leiden an Begleitsymptomen der Spastik. Hierzu zählen vor allem Fatigue, Blasenstörungen, Schmerzen und Sensibilitätsstörungen, aber auch Depressionen, kognitive Störungen, Sexualfunktionsstörungen und Stuhlinkontinenz. Für eine medikamentöse Therapie der Spastik werden bisher vor allem Baclofen, Tizanidin und Tetrazepam eingesetzt.
Neues Arzneimittel
Seit Mitte des Jahres steht für Patienten mit MS-induzierter Spastik, die auf andere antispastische Medikamente nicht angemessen ansprechen, eine neue Therapieoption zur Verfügung. Das Oromukosalspray (Sativex®) enthält Extrakte aus speziell gezüchteten Hanfpflanzen (Cannabis sativa) mit besonders hohem und reproduzierbarem Gehalt an den Cannabinoiden Delta-9-Tetrahydrocannabinol (THC) und Cannabidiol (CBD). In den USA wird die in diesem Arzneimittel enthaltene Wirkstoffkombination als Nabiximols bezeichnet, ein internationaler Freiname (INN) existiert hierfür nicht.
Nach Applikation des Sprays in der Mundhöhle werden die Cannabinoide rasch über die Mundschleimhaut resorbiert. Delta-9-Tetrahydrocannabinol wirkt antispastisch und schmerzlindernd, allerdings auch psychotrop. Cannabidiol wirkt ebenfalls analgetisch; ausgewählt wurde es aber vor allem, weil es den psychotropen Wirkungen von THC entgegenwirkt. Die Wirkung des Sprays beruht auf einer Modulation des körpereigenen Endocannabinoidsystems. Es gibt Patienten, die gut ansprechen (Responder), und solche, bei denen keine nennenswerten Verbesserungen erzielt werden (Nonresponder).
Das Cannabinoid-Spray ist erstattungsfähig; es muss auf einem Betäubungsmittel-Rezept verordnet werden. Vor Anbruch ist das Arzneimittel bei 2–8 °C zu lagern (z.B. in einem abschließbaren Kühlschrank), nach Anbruch kann es je nach Packungsgröße für 28 bis 42 Tage bei maximal 25 °C aufbewahrt werden.
Dosierung
Ein Sprühstoß (100 μl) enthält 2,7 mg THC und 2,5 mg CBD. Die pharmakokinetischen Parameter des oromukosal verabreichten Sprays können bei verschiedenen Patienten variieren, so dass eine individuelle Dosistitration nach einem vorgeschriebenen Schema über zwei Wochen notwendig ist. Die Gesamtzahl der Sprühstöße wird dabei von 1/Tag auf maximal 12/Tag erhöht, bis eine optimale Linderung der Symptome erreicht ist. Durchschnittlich werden von den Patienten 8 Sprühstöße pro Tag benötigt. Zwischen den einzelnen Sprühstößen sollten Abstände von mindestens 15 Minuten liegen.
Nach der Titrationsphase sollten die Patienten die optimale Dosis beibehalten und die Sprühstöße je nach individuellem Ansprechen und Verträglichkeit über den Tag verteilen.
Ist nach einem vierwöchigen Behandlungsversuch keine deutliche Verbesserung eingetreten, sollte die Anwendung des Sprays beendet werden.
Responderstudie
In die jüngste Zulassungsstudie von Novotna et al. wurden Patienten mit multipler Sklerose und einer Spastik, die mit einer bestehenden antispastischen Medikation nur unzureichend behandelt werden konnte, eingeschlossen. Um die Responder herauszufinden, erhielten zunächst alle Studienteilnehmer einfachblind das Cannabinoid-Spray über vier Wochen zusätzlich zur bestehenden antispastischen Medikation (Phase A). Von 572 Patienten in Phase A sprachen 272 (47,5%) auf die Behandlung an. Als Responder waren Patienten definiert, bei denen sich der Wert auf einer numerischen Selbstbeurteilungs-Skala (Numerical rating scale [NRS], Skala von 0 bis 10) um mindestens 20% verbesserte.
Von den Respondern gingen 241 Patienten in die 12-wöchige, doppelblinde, randomisierte, Plazebo-kontrollierte Parallelgruppenstudie über (Phase B). Die Veränderung des NRS-Spastizitäts-Scores, der primäre Wirksamkeitsendpunkt, unterschied sich in der Intention-to-treat-Analyse zwischen den beiden Gruppen um 0,83 Punkte signifikant zugunsten des Verums (Verum –0,19; Plazebo +0,64; p=0,0002; Abb. 1).
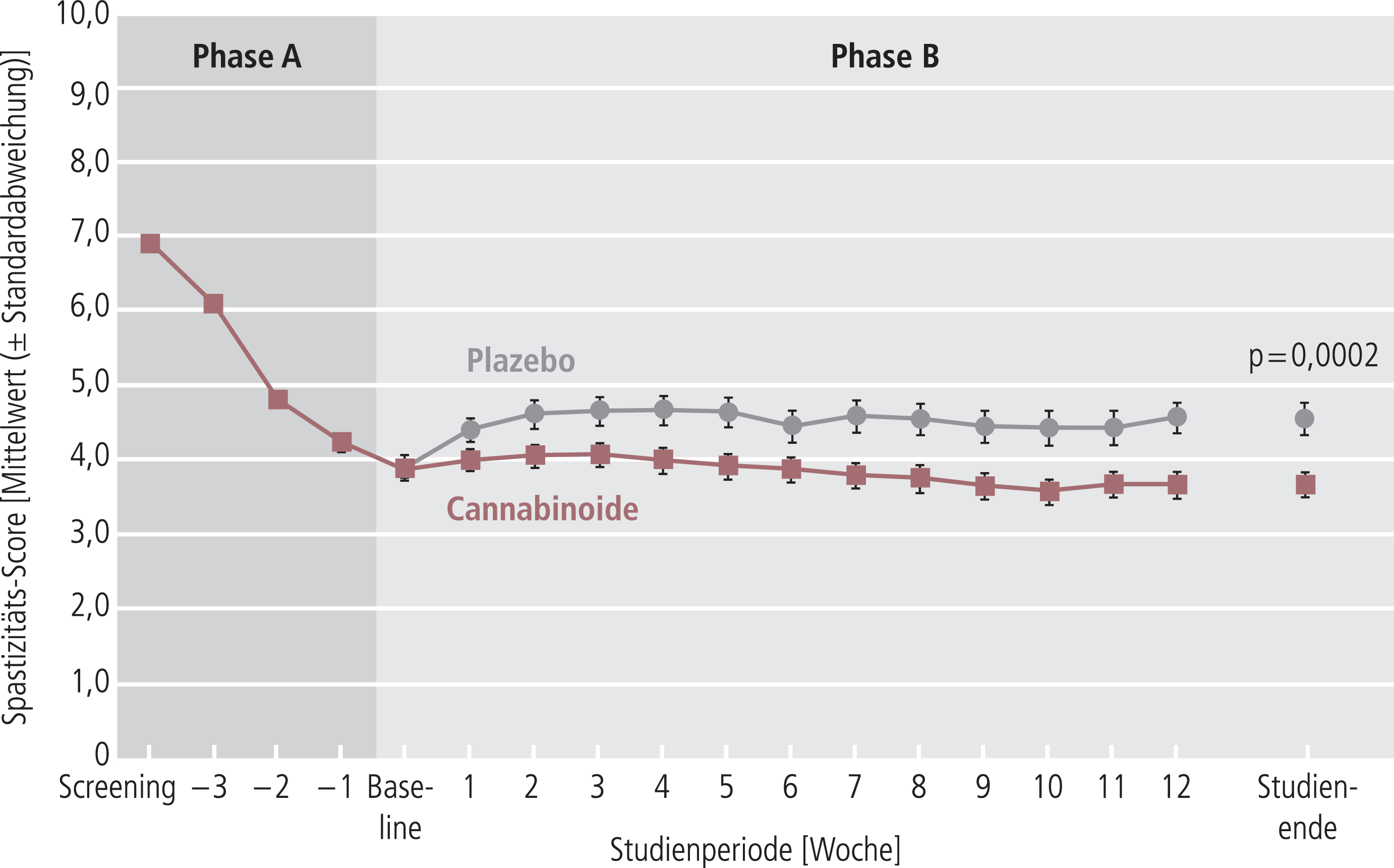
Abb. 1. Verlauf der Spastizität (ermittelt mithilfe einer numerischen Selbstbeurteilungsskala; 0–10) während der Responderstudie [Novotna et al]. Während Phase A wurden alle Teilnehmer einfachblind mit dem Cannabinoid-Spray behandelt, während Phase B erhielten die Responder aus Phase A randomisiert und doppelblind entweder Plazebo oder das Cannabinoid-Spray. Primärer Endpunkt war die Veränderung der Spastizität zwischen der Randomisierung („Baseline“) und dem Ende der Behandlung.
Auch bei den sekundären Wirksamkeitsendpunkten Häufigkeit der Spastik, Schlafunterbrechungen, Gesamteinschätzung der Veränderungen durch Ärzte, Betreuer und Patienten sowie Barthel-Index zu Aktivitäten des täglichen Lebens war das Verum dem Plazebo signifikant überlegen (Tab. 1).
Tab. 1. Ergebnisse sekundärer Endpunkte (Auswahl) in Phase B der Responderstudie (Intention-to-treat-Analyse) [Novotna et al.]
|
Cannabinoid-Spray |
Plazebo |
Differenz bzw. Verhältnis (95%-KI) |
p-Wert |
|
|
Häufigkeit der Spastik [Anzahl der Spastiken pro Tag] |
–0,03 |
2,56 |
–2,53 |
0,005 |
|
Schlafunterbrechungen [Wert auf einer numerischen Skala von 0 bis 10] |
–0,13 |
0,75 |
–0,88 |
<0,0001 |
|
Barthel Index (Aktivitäten des täglichen Lebens) |
2,04 (1,223–3,446) |
0,0067 |
||
|
Gesamteinschätzung der Veränderungen (GIC) |
||||
|
1,96 (1,232–3,112) |
0,005 |
||
|
2,40 (1,297–4,443) |
0,005 |
||
|
1,70 (1,075–2,698) |
0,023 |
||
KI: Konfidenzintervall; GIC: Global impression of change
74% der mit dem Cannabinoid-Spray behandelten Phase-B-Patienten zeigten eine Verbesserung der Spastik um ≥30% gegenüber dem Ausgangswert vor Beginn der Phase A (Plazebo: 51%; p=0,0003).
Verträglichkeit. In Phase A war die häufigste Nebenwirkung Schwindel (14%). In Phase B traten am häufigsten Harnwegsinfekte auf (Verum: 7%; Plazebo: 10%). Der Großteil der unerwünschten Wirkungen war leicht bis mäßig. Im Beck-Depressionstest (Beck depression inventory II) zeigten sich keine Unterschiede zwischen Verum- und Plazebo-Gruppe.
Insgesamt liegen für das Spray klinische Erfahrungen bei über 1500 Patienten mit mittelschwerer bis schwerer Spastik vor, was 1200 Patientenjahren entspricht. In den klinischen Studien wurden Dosierungen bis zu 48 Sprühstößen pro Tag untersucht.
Versorgungsforschung
Die Zwischenauswertung der noch laufenden Versorgungsstudie MOVE 1 (Mobility improvement in MS induced spasticity) ergab, dass nur 29% der MS-Patienten mit der Wirksamkeit ihrer antispastischen Medikamente zufrieden sind; von den Ärzten bewerteten sogar nur 7% die aktuellen medikamentösen Behandlungsmöglichkeiten gegen Spastik als zufriedenstellend. Diese Ergebnisse beruhen auf einer Auswertung von 276 Patienten. Insgesamt werden in die Studie 500 MS-Patienten mit Spastik aus 50 MS-Zentren in Deutschland eingeschlossen.
Zusätzlich läuft seit Juli 2011 eine multizentrische, prospektive Therapiebeobachtungsstudie (MOVE 2), bei der 500 Patienten, die das Cannabinoid-Spray als Therapieversuch erhalten, unabhängig vom ihrem Ansprechen über drei bis vier Monate mehrfach untersucht werden.
Fazit
- Die Zufriedenheit der Ärzte und Patienten mit der derzeitigen Spastiktherapie ist niedrig.
- Es gibt Evidenz für die klinische Wirksamkeit der standardisierten Fixkombination mit Delta-9-Tetrahydrocannabinol und Cannabidiol in der Therapie der MS-induzierten Spastik.
- Das oromukosale Spray wirkt sich zusätzlich positiv auf spastikassoziierte Parameter (z.B. Schlafqualität, Aktivitäten des täglichen Lebens) aus
- Nebenwirkungen wie Schwindel und Müdigkeit sind meist leicht bis mäßig, verschwinden in der Regel nach einigen Tagen und können durch langsame Titration vermieden werden.
- Zu Behandlungsbeginn ist eine zweiwöchige Titrationsphase zur individuellen Dosisanpassung erforderlich.
Quellen
Priv.-Doz. Dr. med. Peter Flachenecker, Bad Wildbad, Prof. Dr. med. Thomas Henze, Nittenau, Prof. Dr. med. Uwe Zettl, Rostock. Satellitensymposium „Neue Ansätze der symptomatischen Therapie bei Multipler Sklerose. Spastikbehandlung mit einem Endocannabinoidsystem-Modulator“, veranstaltet von der Almirall Hermal GmbH im Rahmen des 84. Kongresses der Deutschen Gesellschaft für Neurologie (DGN), Wiesbaden, 28. September 2011.
Novotna A, et al. A randomized, double-blind, placebo-controlled, parallel-group enriched-design study of nabiximols (Sativex®), as add-on therapy, in subjects with refractory spasticity caused by multiple sclerosis. Eur J Neurol 2011;18:1122–31.
Fachinformation Sativex®, Stand Juni 2011.
Psychopharmakotherapie 2011; 18(06)
