Hans-Peter Volz, Werneck
Bipolare Störungen
Bipolare Störungen gehören zu den häufigen affektiven Störungen, gleichzeitig aber auch zu den häufig unerkannten oder falsch diagnostizierten [17, 31]. Studien zeigen, dass im Durchschnitt fünf bis zehn Jahre zwischen einer ersten affektiven Episode und der Diagnose einer bipolaren Störung vergehen [15, 36]. Darüber hinaus wird vermutet, dass bipolare Störungen nur bei einem geringen Teil der Betroffenen überhaupt jemals korrekt diagnostiziert werden [9, 17].
Die Lebenszeitprävalenz für Bipolar-I-Störungen liegt bei etwa 1%; für das gesamte Spektrum der bipolaren Störungen liegt sie mit etwa 4 bis 5% deutlich höher (Übersicht bei Arolt und Behnken, 2006) [3]). Gleichzeitig sind bipolare Störungen durch eine hohe Komorbidität mit anderen psychiatrischen Erkrankungen gekennzeichnet, insbesondere mit Angst- und Suchterkrankungen; auch das Suizidrisiko ist bei Patienten mit bipolaren Störungen hoch [3]. Daneben spielen aber auch somatische Begleiterkrankungen eine Rolle: so wurde eine höhere Prävalenz metabolischer und kardiovaskulärer Erkrankungen bei Patienten mit bipolaren Störungen festgestellt als in der Allgemeinbevölkerung [5]. Dies führt nicht nur zu einem erheblichen Verlust an Lebensqualität der Erkrankten und ihrer Angehörigen, sondern auch zu hohen Krankheits- und volkswirtschaftlichen Folgekosten [16, 18, 31].
Diese negativen Folgen der bipolaren Störungen werden noch verstärkt durch die häufige Fehldiagnose und daraus resultierende Fehlbehandlungen [31].
Das breite Spektrum an Verlaufsformen und Schweregraden macht die Diagnosestellung und Behandlung bipolarer Störungen zu einer komplexen Aufgabe. Dabei sind Ätiologie und Neurobiologie der bipolaren Störungen noch weitgehend ungeklärt.
Behandlung manischer Episoden
Für die Akuttherapie manischer Episoden werden eine Reihe von Wirkstoffen eingesetzt: Lithiumsalze, die Antiepileptika Valproinsäure und Carbamazepin sowie typische und atypische Antipsychotika. Alle diese Substanzen sind bei einem Teil der Patienten wirksam, bergen aber jeweils auch Schwierigkeiten in der Anwendung (z.B. Spiegelkontrollen bei Lithium) und typische Nebenwirkungsprofile (z.B. Gewichtszunahme [Valproinsäure, Lithium, Olanzapin, Quetiapin], Neurotoxizität und erhebliche Interaktionsproblematik [Carbamazepin]). Eine gute Zusammenfassung geben Miklowitz und Johnson [27]. Typische Antipsychotika, die Dopamin-Rezeptoren besonders effizient blockieren, sind gut wirksam, führen aber häufig zu extrapyramidalen Symptomen (EPS) [20] und zur Erhöhung des Prolactinspiegels [22].
In den letzten Jahren werden zunehmend atypische Antipsychotika zur Behandlung von akuten manischen Episoden und zur Phasenprophylaxe eingesetzt, beispielsweise Olanzapin oder Quetiapin. Die atypischen Antipsychotika wirken nicht ausschließlich als D2-Rezeptorblocker, sondern besitzen ein komplexes, je nach Substanz unterschiedliches Wirkspektrum auf verschiedene Rezeptoren wie zusätzliche Affinität zu verschiedenen serotonergen Rezeptoren (z.B. 5-HT2A), zu weiteren Dopamin-Rezeptortypen, zusätzliche Wirkung an α-adrenergen, histaminergen oder muskarinergen Rezeptoren. Die atypische Antipsychotika sind somit keine homogene Substanzklasse; gemeinsam ist den meisten jedoch die gleichzeitige Blockade von D2- und 5-HT2A-Rezeptoren (zusammengefasst in [34]). Der hemmenden Wirkung am 5-HT2A-Rezeptor wird das im Allgemeinen geringere EPS-Risiko zugeschrieben. Daneben werden aber auch stimmungsstabilisierende Effekte durch die serotonerge Modulation des Dopaminsystems diskutiert [1, 27].
Im Vergleich zu den typischen Antipsychotika ist bei den atypische Antipsychotika die Gefahr von EPS und tardiven Dyskinesien geringer ausgeprägt. Jedoch haben auch die atypischen Antipsychotika ein breites Spektrum an Nebenwirkungen, das von Substanz zu Substanz unterschiedlich ausfällt. Besonders kritisch in dieser Arzneistoffgruppe sind Gewichtszunahme (s.o.), kardiale Nebenwirkungen sowie Veränderungen im Glucose- und Lipidstoffwechsel; insbesondere wurde Olanzapin mit Gewichtszunahme und metabolischen Störungen in Verbindung gebracht [20, 21].
Ein großes Problem bei der Behandlung bipolarer Störungen ist die hohe Rate an Non-Compliance oder Therapieabbrüchen, die bei 20 bis 40% der Patienten registriert werden. Diese hohe Rate an Non-Compliance ist zum Teil bedingt durch die Grunderkrankung und ihre Komplikationen, aber auch mangelnde Wirksamkeit und/oder die zahlreichen Nebenwirkungen der eingesetzten Medikamente tragen erheblich dazu bei [32].
Asenapin
Pharmakologie
Seit September 2010 ist in Deutschland mit Asenapin (Sycrest®; Abb. 1) ein neues Antipsychotikum der zweiten Generation zur Behandlung von manischen Episoden der Bipolar-I-Störung zugelassen. Asenapin wirkt über die gleichzeitige Blockade von D2- und 5-HT2A-Rezeptoren, wie In-vitro-Studien mit geklonten humanen Rezeptoren zeigten [34]. Darüber hinaus hat Asenapin ein individuelles Muster von Rezeptor-Affinitäten und -Aktivitäten, das diese Substanz deutlich von anderen atypischen Antipsychotika unterscheidet (Tab. 1). Zusammengefasst werden die publizierten Informationen zu den Rezeptor-Affinitäten und -Aktivitäten in einem Übersichtsartikel von Shahid et al. (2009) [34]. Neben einer moderaten Affinität für D2-Dopaminrezeptoren wurden starke Bindungsaffinitäten für die D3- und D4-Rezeptoren festgestellt. Asenapin hat ebenfalls eine hohe Affinität für eine große Anzahl von serotonergen Rezeptoren, insbesondere 5-HT2A, 5-HT2B, 5-HT2C, 5-HT6 und 5-HT7, eine Reihe von adrenergen α2-Rezeptoren und die Histamin-Rezeptoren H1 und H2. Dagegen besteht kaum Affinität für muskarinerge Rezeptoren. Die funktionelle Analyse zeigte, dass Asenapin an diesen serotonergen, dopaminergen, α2-adrenergen und histaminergen Rezeptoren in erster Linie antagonistisch wirkt [34].
Abb. 1. Asenapin
Tab. 1. Affinitäten (pKi) verschiedener Atypika an Serotonin (5-HT)-, Dopamin-, Alpha-, Histamin- und Muscarin-Rezeptoren [34]
|
Rezeptor |
Asenapin |
Aripiprazol |
Ziprasidon |
Quetiapin |
Olanzapin |
Risperidon |
|
5-HT1A 5-HT1B |
8,60 8,40 |
8,57 8,55 |
9,01 9,05 |
6,78 <6,50 |
5,82 6,60 |
6,75 7,29 |
|
5-HT2A 5-HT2B 5-HT2C |
10,15 9,75 10,46 |
8,02 9,59 7,55 |
9,51 9,08 9,01 |
6,81 7,33 5,98 |
8,88 8,41 8,41 |
9,69 7,99 8,17 |
|
5-HT5A |
8,84 |
6,05 |
5,95 |
5,70 |
7,00 |
7,23 |
|
5-HT6 5-HT7 |
9,60 9,94 |
6,64 7,46 |
6,78 8,60 |
5,64 7,25 |
8,49 7,43 |
5,66 9,13 |
|
D1 |
8,85 |
6,09 |
8,45 |
6,71 |
7,93 |
7,68 |
|
D2L D2S |
8,90 8,84 |
8,94 8,91 |
8,09 7,99 |
6,38 6,32 |
7,67 7,58 |
8,21 8,07 |
|
D3 |
9,38 |
8,85 |
8,35 |
6,41 |
7,46 |
8,16 |
|
D4 |
8,95 |
6,89 |
7,33 |
5,85 |
7,75 |
8,21 |
|
α1A |
8,93 |
6,49 |
7,81 |
7,19 |
7,65 |
8,29 |
|
α2A α2B α2C |
8,9 9,49 8,91 |
7,16 6,72 7,93 |
6,59 6,62 7,38 |
6,25 7,08 7,42 |
6,83 6,48 7,39 |
8,09 8,02 8,74 |
|
H1 H2 |
9,00 8,21 |
7,69 5,15 |
6,89 4,55 |
7,96 5,18 |
8,47 5,50 |
7,09 6,32 |
|
M1 M2 M3 M4 |
5,09 4,50 4,67 5,04 |
5,41 4,92 5,11 5,23 |
<5,00 <5,00 <5,00 <5,00 |
6,55 6,22 6,29 6,61 |
7,92 7,40 7,47 7,65 |
4,57 4,41 4,60 4,97 |
Eine zu starke Blockade der D2-Rezeptoren konnte mit extrapyramidal-motorischen Nebenwirkungen und Hyperprolactinämie in Verbindung gebracht werden; es wird aber angenommen, dass diese Blockade durch das Serotonin-Transmittersystem moduliert wird [34]. Eine hohe Affinität zu serotonergen Rezeptoren, insbesondere 5-HT2A, relativ zur D2-Affinität gilt daher als gute Voraussetzung für ein niedriges Potenzial, EPS auszulösen. Für Asenapin liegt dieses Verhältnis sehr günstig: die Affinität zu 5-HT2A-Rezeptoren ist 19-fach höher als die zu D2-Rezeptoren [34].
Noch weitere Zusammenhänge zwischen Rezeptor-Affinitäten und bestimmten Nebenwirkungen werden diskutiert: Eine hohe Affinität für muskarinerge Rezeptoren, wie sie beispielsweise Clozapin und Olanzapin im Gegensatz zu Asenapin besitzen, wird mit anticholinergen (z.B. kognitiven Störungen) und metabolischen Nebenwirkungen in Verbindung gebracht, eine Affinität zu H1- und α1-Rezeptoren mit Gewichtszunahme, Diabetes mellitus und kardiovaskulären Nebenwirkungen. Als positiv wird eine hohe Affinität zu verschiedenen serotonergen Rezeptoren angesehen; diese Eigenschaft wird mit kognitiven Verbesserungen, Stimmungsstabilisierung und Verbesserung negativer Symptome in der Behandlung der Schizophrenie in Verbindung gebracht (zusammengefasst in [34]). Diese pharmakologischen Wirkungen von Asenapin haben Einfluss auf die Wirksamkeit und Verträglichkeit, wie Studien bestätigt haben.
Pharmakokinetik
Da die Bioverfügbarkeit von Asenapin bei oraler Anwendung sehr gering ist (<2%), wird Asenapin in einer sublingualen Formulierung verwendet; damit beträgt die Bioverfügbarkeit etwa 35% [12]. Die geringe Bioverfügbarkeit bei oraler Aufnahme wird verursacht durch einen hohen First-Pass-Metabolismus in der Leber und wahrscheinlich auch im Darm [13], der durch die sublinguale Anwendung umgangen wird.
Die Pharmakokinetik von Asenapin nach sublingualer Anwendung beim Menschen wurde in mehreren Studien mit gesunden Probanden sowie mit Patienten mit eingeschränkter Nieren- oder Leberfunktion untersucht [11, 14, 19, 20, 30]. Asenapin wird bei sublingualer Gabe schnell resorbiert, maximale Plasmakonzentrationen wurden bei gesunden Probanden nach 0,5 bis 1,5 Stunden erreicht [12].
Rauchen hatte keinen Einfluss auf die Pharmakokinetik von Asenapin [12, 19], im Gegensatz zu Wasser- und Nahrungsaufnahme: Das Trinken von Flüssigkeit innerhalb von zehn Minuten nach sublingualer Anwendung von Asenapin verringert die Bioverfügbarkeit. Probanden, die zwei Minuten nach der Anwendung Wasser tranken, hatten einen um 19% verringerten Asenapin-Plasmaspiegel [13, 19]. Nach der Anwendung von Asenapin sollen Patienten daher für zehn Minuten weder Flüssigkeit noch Nahrung zu sich nehmen.
Eine leichte Beeinträchtigung der Leberfunktion (Child-Pugh A) hatte keinen nennenswerten Einfluss auf die Asenapin-Konzentration [30]. Bei einer mäßigen Beeinträchtigung (Child-Pugh B) kann eine Erhöhung des Asenapin-Plasmaspiegels eintreten [12]. Schwere Leberfunktionsstörungen (Child-Pugh C) führten im Vergleich zu gesunden Probanden zu einer etwa 7-fach erhöhten Asenapin-Konzentration [30]. Patienten mit Nierenfunktionsstörungen unterschiedlicher Schweregrade zeigten nach einmaliger Gabe von Asenapin eine ähnliche Pharmakokinetik wie gesunde Probanden [13], allerdings gibt es keine Erfahrung bei Patienten mit stark eingeschränkter Nierenfunktion, deren Creatinin-Clearance weniger als 15 ml/min beträgt. Für die Anwendung von Asenapin bei Patienten mit mäßiger oder schwerer Beeinträchtigung der Nieren- oder Leberfunktion ist daher Vorsicht geboten [12]. Bei leicht eingeschränkter Nieren- oder Leberfunktion ist keine Dosisanpassung nötig.
Asenapin wird zu einem beträchtlichen Teil metabolisiert, in erster Linie durch direkte Glukuronidierung durch Uridin-Diphosphoglucuronyl-Transferasen (UGT) und oxidativen Metabolismus durch Cytochrom-P450-(CYP-)Isoenzyme. In-vitro-Studien zeigten, dass Asenapin ein Substrat für UGT1A4 und CYP1A2 ist und in geringerem Maße auch für CYP3A4 und CYP2D6. Asenapin ist ein schwacher Inhibitor von CYP2D6. CYP1A2 und CYP3A4 werden durch Asenapin nicht induziert [3]. In vivo hatte die gemeinsame Anwendung von Asenapin mit den CYP450-Modulatoren Carbamazepin, Cimetidin und Paroxetin keine klinisch relevanten Änderungen der Asenapin-Pharmakokinetik zur Folge [11, 20]. Die Paroxetin-Konzentration wurde bei der gleichzeitigen Anwendung mit Asenapin annähernd verdoppelt [13, 20]. Die Plasmaspitzenkonzentration und die Fläche unter der Plasmakonzentrations-Zeit-Kurve von Asenapin wurden durch gleichzeitige Verabreichung des UGT-Inhibitors Valproinsäure nicht beeinflusst [14, 20]. Fluvoxamin, ein starker CYP1A2-Inhibitor, führte bei gemeinsamer Anwendung mit Asenapin zu deutlich erhöhten Asenapin-Plasmakonzentrationen, daher ist bei der gleichzeitigen Anwendung dieser beiden Wirkstoffe Vorsicht geboten [12, 13, 20].
Klinische Studien – Wirksamkeit
Die Wirksamkeit von Asenapin sublingual als Monotherapie bei manischen Episoden einer Bipolar-I-Störung wurde in zwei gleich angelegten, randomisierten, Plazebo-kontrollierten, doppelblinden Kurzzeitstudien im direkten Vergleich zu Plazebo geprüft. Eine dritte Patientengruppe wurde mit Olanzapin als Aktivkontrolle zur Validierung des Studiendesigns behandelt [23, 25].
Die Studiendauer betrug drei Wochen, eingeschlossen wurden erwachsene Patienten mit akuten manischen oder gemischten Episoden und einem Gesamtwert der Young Mania Rating Scale (YMRS) von ≥20. Primäres Zielkriterium war die Veränderung der YMRS-Gesamtwerte; sekundäre Zielkriterien waren die Response- und Remissionsrate gemessen anhand der YMRS-Skala, Veränderungen des klinischen Gesamteindrucks (Clinical Global Impression for Bipolar Disorder [CGI-BP] Scale), Veränderungen depressiver Symptome gemäß Montgomery-Åsberg Depression Rating Scale (MADRS) sowie die Arzneimittelsicherheit.
Insgesamt wurden 977 Patienten für diese beiden Studien randomisiert (Tab. 2). Die Analyse des primären Zielkriteriums zeigte, dass die Veränderung des YMRS-Gesamtwerts von Studienbeginn bis Tag 21 für Asenapin signifikant größer war als unter Plazebo; die Überlegenheit gegenüber Plazebo zeigte sich bereits am zweiten Behandlungstag. Dieses Resultat wurde bestätigt durch die Veränderungen der Werte der CGI-BP-Skala, die für Asenapin signifikant höher waren als für Plazebo. Die Response- und Remissionsraten (YMRS) waren für Asenapin in einer der Studien signifikant höher als unter Plazebo. Die mittlere Tagesdosis Asenapin in beiden Studien betrug 18 bis 19 mg [23, 25].
Tab. 2. Demographische Daten der Kurzzeitstudien mit Asenapin zur Therapie manischer Episoden bei Bipolar-I-Studien [23, 25, 29]
|
Charakteristiken |
Plazebo (n=202) |
Asenapin 10 oder 5 mg 2-mal täglich (n=379) |
Olanzapin 5–20 mg 1-mal täglich (n=395) |
|
Geschlecht [% männlich] |
50 |
54 |
58 |
|
Alter [Jahre]: Mittelwert (SD) |
39 (12) |
39 (12) |
39 (11) |
|
Gewicht [kg]: Mittelwert (SD) |
78 (19) |
77 (19) |
79 (20) |
|
Hauptdiagnose [%]
|
67 33 |
71 29 |
69 32 |
|
Tagesdosis [mg]: Mittelwert (SD) |
– |
18 (3) |
16 (3) |
AST (All Subjects Treated)-Patientengruppe; n=976; SD: standard deviation (Standardabweichung)
Auch unter Olanzapin zeigten sich von Studienbeginn bis Tag 21 signifikant höhere Veränderungen des YMRS-Gesamtwerts und der Werte der CGI-BP-Skala als unter Plazebo, mit Einsetzen der Überlegenheit ab dem zweiten Behandlungstag. Die YMRS-Response- und Remissionsraten waren für Olanzapin in beiden Studien signifikant höher als für Plazebo. Nur bei Behandlung mit Olanzapin kam es zu einer signifikanten Verbesserung der MADRS-Werte im Vergleich zu Plazebo [23, 25].
In Abbildung 2 sind die Ergebnisse der Studie von McIntyre et al. [25] exemplarisch dargestellt. Asenapin zeigte hier eine rasch eintretende statistisch signifikante Verbesserung der manischen und gemischten Episoden einer Bipolar-Störung. Die Ergebnisse der LOCF(Last observation carried forward)-Analyse bestätigten sich bei der MMRM(Mixed-effects model repeated measures)-Analyse der Daten [25].
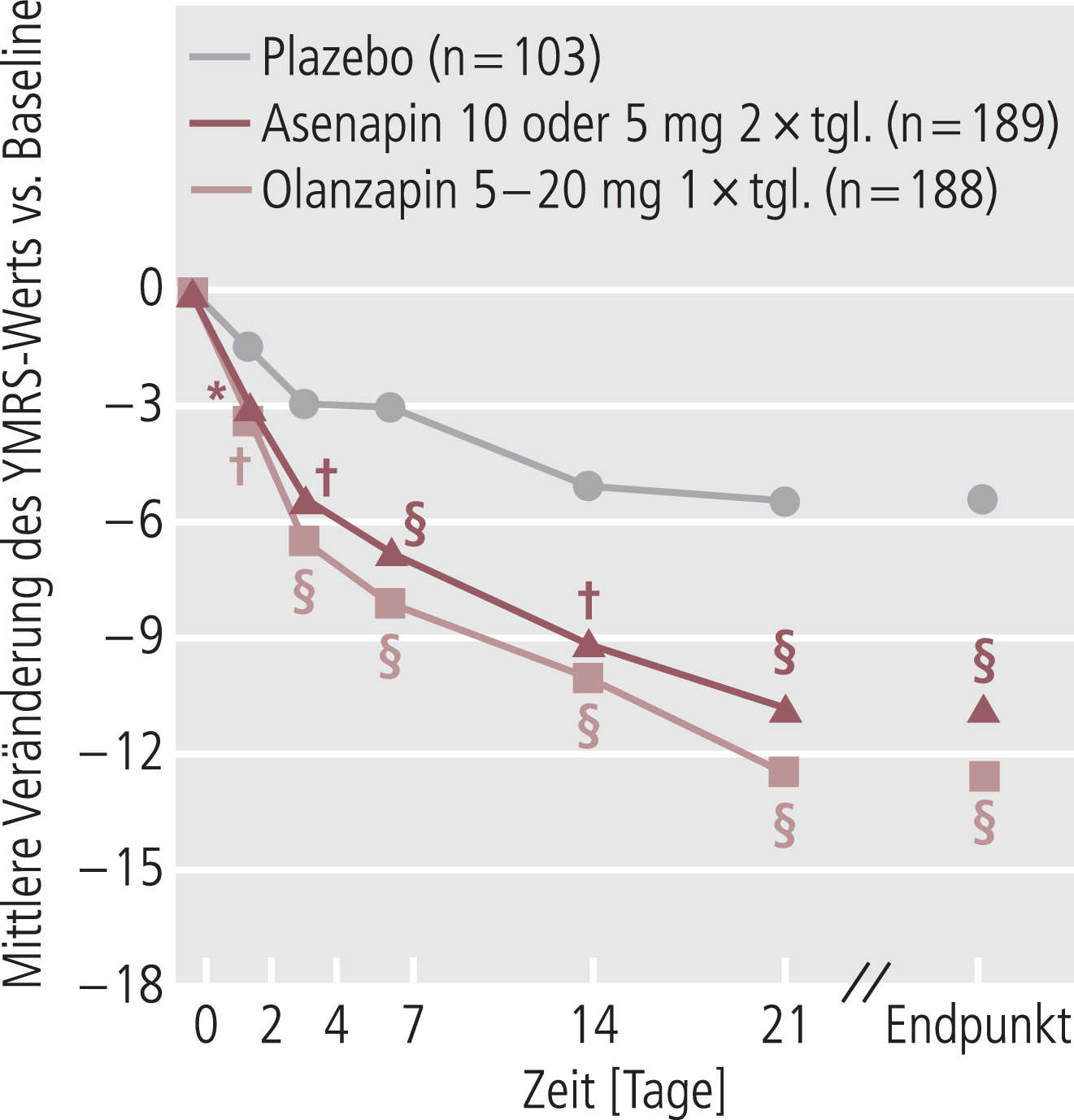
Abb. 2. Rasche Besserung der Symptome von manischen und gemischten Episoden einer Bipolar-I-Störung durch Behandlung mit Asenapin; *p<0,01 vs. Plazebo, †p<0,001 vs. Plazebo, §p<0,0001 vs. Plazebo (ITT-Population, LOCF-Analyse) [23, 29]
Patienten der beiden Kurzzeitstudien konnten anschließend an einer 9-wöchigen [26] (n=504) und danach an einer 40-wöchigen Verlängerungsstudie (n=218) [24] teilnehmen. Das primäre Ziel der 9-wöchigen Verlängerungsstudie war der Wirksamkeitsvergleich von Asenapin mit Olanzapin in einem „Nicht-Unterlegenheits-Design“, während in der 40-wöchigen Verlängerungsstudie in erster Linie die Sicherheit und Verträglichkeit untersucht werden sollte. Patienten der beiden mit Verum behandelten Gruppen wurden ohne Entblindung mit derselben Dosis weiterbehandelt; Patienten, die ursprünglich Plazebo erhalten hatten, wurden einfachblind mit Asenapin weiterbehandelt und nur in die Verträglichkeitsanalyse einbezogen.
Die mittleren YMRS-Gesamtwerte nahmen in diesen Verlängerungsstudien bis zur Woche 52 weiter ab, dabei gab es keinen signifikanten Unterschied zwischen der Asenapin- und der Olanzapin-Gruppe (Asenapin –24,4 Punkte auf der YMRS nach 12 Wochen, –28,6 nach 52 Wochen; Olanzapin –23,9 nach 12 Wochen, –28,2 nach 52 Wochen). Ebenso waren die YMRS-Response- und Remissionsraten für beide Studienmedikationen ähnlich (Asenapin 97,8%; Olanzapin 98,4%) und auch die Raten der Studienabbrüche aufgrund von unerwünschten Ereignissen (UE) bzw. mangelnder Wirksamkeit waren nicht signifikant unterschiedlich [24].
Asenapin als adjunktive Therapie wurde in einer randomisierten, Plazebo-kontrollierten, doppelblinden Studie über 12 Wochen untersucht, deren Ergebnisse als Poster beim 163. Jahrestreffen der American Psychiatric Association veröffentlicht wurden [6]. Die Teilnehmer waren Patienten mit akuten manischen oder gemischten Episoden einer Bipolar-I-Störung, die auf eine Behandlung mit Lithium oder Valproinsäure nur teilweise angesprochen hatten. Die Patienten erhielten zusätzlich zu ihrer ursprünglichen Therapie eine flexible Dosis Asenapin sublingual (n=155) oder Plazebo (n=163). Primäres Zielkriterium war die Veränderung der YMRS-Gesamtwerte. Nach drei Wochen zeigte Asenapin als Add-on-Therapie eine signifikant höhere Reduktion der YMRS-Gesamtwerte als Plazebo (–10,3 vs. –7,9) (Abb. 3). Diese Verbesserung fiel nach 12 Wochen (–12,7 vs. –9,3) noch etwas deutlicher aus. Auch YMRS-Response- und Remissionsraten sowie Verbesserungen auf der CGI-BP-Skala waren unter adjunktivem Asenapin signifikant höher als unter Plazebo [6].
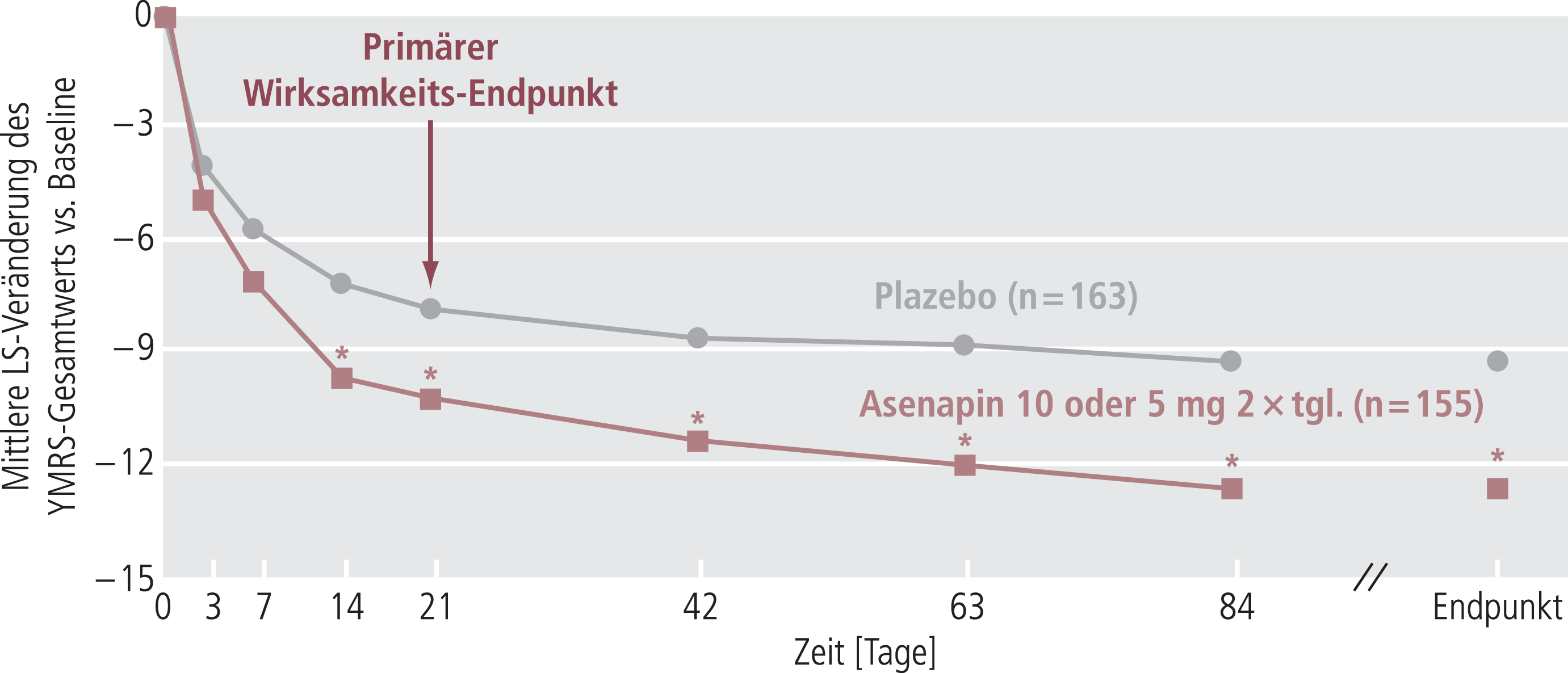
Abb. 3. Wirksamkeit von Asenapin in Kombination mit Lithium oder Valproinsäure bei Patienten mit Bipolar-I-Störung, die auf die vorangehende Behandlung mit Lithium oder Valproinsäure nur teilweise angesprochen hatten (YMRS-Gesamtwert bei Baseline: 28,2 [Plazebo] bzw. 28,0 [Asenapin]); *p<0,05 vs. Plazebo (ITT-Population, LOCF-Analyse); LS: least squares [6, 29]
Weitere Studien mit Asenapin wurden zur Behandlung der akuten Schizophrenie durchgeführt, eine Indikation, für die Asenapin in den USA zugelassen ist. Die Ergebnisse dieser Studien wurden von Citrome zusammengefasst (2009) [7]. Hier war Asenapin in zwei von vier randomisierten, Plazebo-/Verum-kontrollierten Studien signifikant effektiver als Plazebo.
Klinische Studien – Verträglichkeit
Insgesamt wurde Asenapin in den klinischen Studien gut vertragen. Unerwünschte Ereignisse (UE), die in den Plazebo-kontrollierten Kurzzeitstudien mit Asenapin bei mindestens 5% der Patienten auftraten und mehr als doppelt so häufig wie unter Plazebo waren, waren Sedierung, Schwindel, Schläfrigkeit, Erschöpfung, orale Hypoästhesie, Erbrechen und Gewichtszunahme. Die Inzidenz aller EPS-basierten UE unter Asenapin betrug in den beiden Studien 7,2% bzw. 10,3% gegenüber jeweils 3% in der Plazebo-Gruppe, jedoch trat kein einzelnes Symptom bei mehr als 5% der Patienten auf. Eine Auswertung mit EPS-spezifischen Skalen (Barnes Akathisia Rating Scale, Abnormal Involuntary Movement Scale und Simpson-Angus Scale) zeigte keine signifikante Verschlechterung unter Asenapin im Vergleich mit Plazebo.
Es gab keine klinisch signifikanten Veränderungen von Laborparametern oder EKGs [23, 25]. Eine klinisch signifikante Gewichtszunahme (≥7% im Vergleich zu Studienbeginn) wurde in den beiden Kurzzeitstudien verzeichnet für 6% bzw. 7,2% in der Asenapin-Gruppe und 0% bzw. 1,2% der Patienten in der Plazebo-Gruppe [23, 25].
Die Verlängerungsstudien über 9 und 40 Wochen (insgesamt Behandlung über 52 Wochen) hatten keinen Plazebo-Arm. Hier wurde die Inzidenz von UE unter Behandlung mit Asenapin oder Olanzapin verglichen. Die Rate der Studienabbrüche aufgrund von UE war für beide Substanzen vergleichbar und relativ niedrig (Asenapin 8,9% vs. Olanzapin 8,4%), ebenso wie die Anzahl schwerwiegender UE (Asenapin 3,8% vs. Olanzapin 2,8%). Während Gewichtszunahme unter Olanzapin häufiger berichtet wurde als unter Asenapin (Abb. 4), waren die Meldungen von EPS in beiden Gruppen ähnlich häufig (Asenapin 17,7% vs. Olanzapin 16,2%) [6, 24, 26, 29].
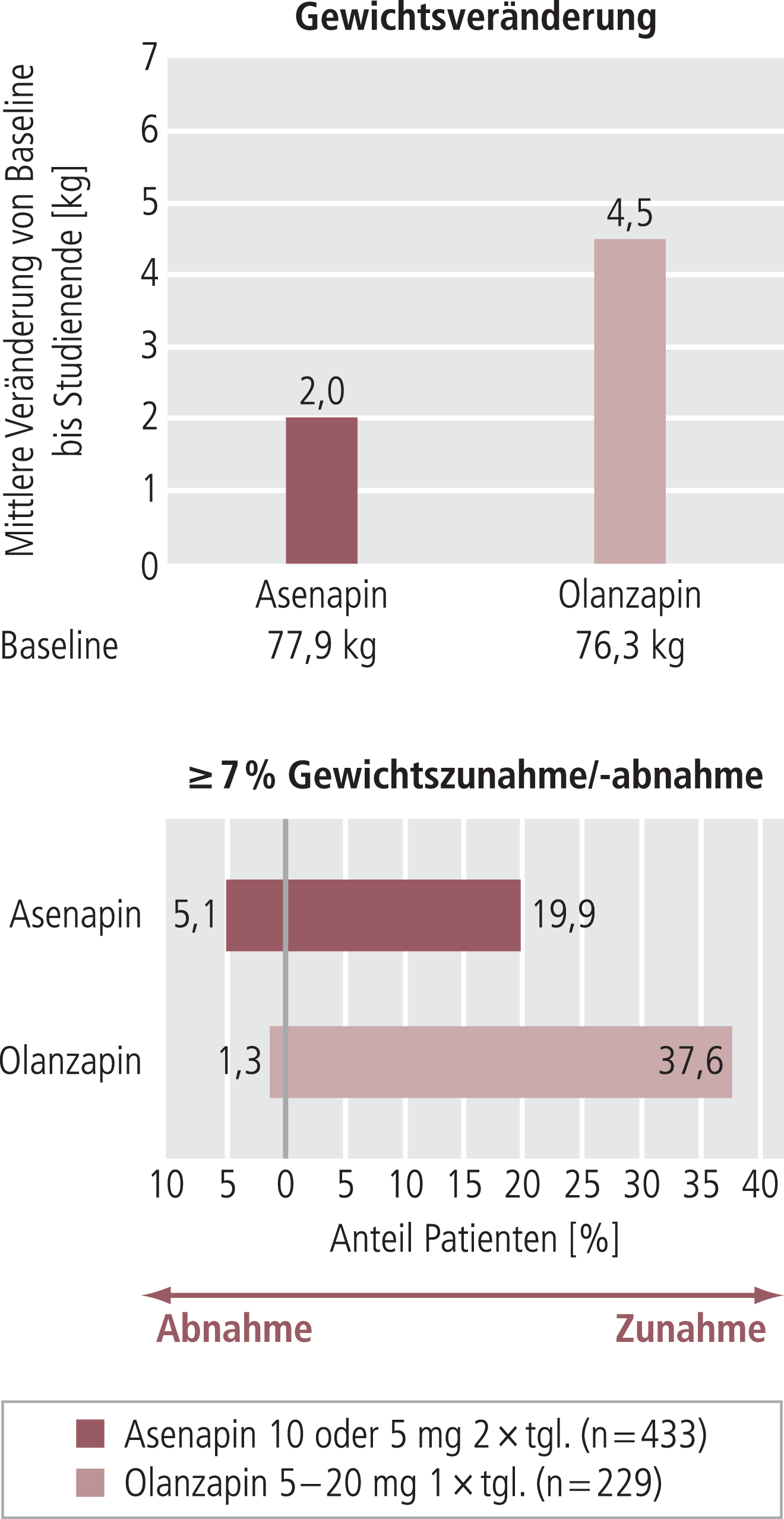
Abb. 4. Sicherheit in Langzeitstudien mit Asenapin bei Bipolar-I-Störung – Gewichtsveränderung [6, 24, 26, 29]
Nach der Verlängerungsstudie zeigte sich eine klinisch signifikante Gewichtszunahme (≥7% im Vergleich zu Studienbeginn) bei 39,2% der Patienten in der Asenapin-Gruppe und 55,1% der Patienten in der Olanzapin-Gruppe. Der durchschnittliche Anstieg des Körpergewichts im Vergleich zu Studienbeginn betrug 3,5 kg unter Asenapin und 6 kg unter Olanzapin. Veränderungen von Laborparametern gegenüber Studienbeginn waren allgemein gering und wurden nicht als klinisch signifikant angesehen. Die durchschnittliche Erhöhung der Prolactinwerte gegenüber Studienbeginn betrug in der Asenapin-Gruppe 0,47 ng/ml und in der Olanzapin-Gruppe 4,20 ng/ml; erhöhte Prolactinwerte wurden aber in keinem Fall als UE berichtet. Die Inzidenz von UE, die durch eine Prolactinerhöhung verursacht sein könnten (z.B. Dysmenorrhö, Hyperinsulinämie, erektile Dysfunktion), betrug 5,1% für Asenapin und 6,5% für Olanzapin. Im Ganzen ergab sich ein ähnliches Bild wie nach den Kurzzeitstudien [24].
Citrome [7], der auch Studien zu Asenapin bei Schizophrenie in seine Auswertung mit einbezog, kam – auch unter Zuhilfenahme indirekter Vergleiche – zu dem Ergebnis, dass die Körpergewichtszunahme unter Asenapin geringer ausfällt als unter einigen anderen atypischen Antipsychotika, insbesondere Olanzapin. Die Gewichtszunahme unter Asenapin scheint nicht dosisabhängig zu sein, sondern umgekehrt proportional dem Body-Mass-Index [7].
Da EPS-basierte Nebenwirkungen ein besonders kritisches Thema für Antipsychotika sind, wurden UE aus dieser Kategorie differenziert ausgewertet und die Patienten zusätzlich mit EPS-Skalen beurteilt (Barnes Akathisia Rating Scale [BARS], Abnormal Involuntary Movement Scale [AIMS] und Simpson-Angus Scale [SAS]). Die Auswertung der EPS-Skalen ergab, dass die durchschnittlichen Veränderungen auf diesen Skalen gegenüber Studienbeginn minimal waren und keine großen Unterschiede zwischen Asenapin- und Olanzapin-behandelten Patienten zeigten (BARS: –0,1 [Asenapin] vs. –0,1 [Olanzapin], nicht signifikant; AIMS: 0,0 [Asenapin] vs. –0,1 [Olanzapin], nicht signifikant; SAS –0,1 [Asenapin] vs. –0,3 [Olanzapin], nicht signifikant) [24].
Atypische Antipsychotika werden häufig und mit gutem Erfolg in Kombination mit anderen stimmungsstabilisierenden Medikamenten angewendet [33, 35]. Die Verträglichkeit von Asenapin wurde in erster Linie in Monotherapie-Studien geprüft; in einer Studie wurde Asenapin zusätzlich zu Valproinsäure oder Lithium angewendet [6] und zeigte gute Verträglichkeit. Auch die Ergebnisse von Studien mit gesunden Probanden gaben keine Hinweise auf mögliche Probleme bei der gemeinsamen Anwendung von Asenapin mit Carbamazepin oder Valproinsäure [11, 13, 14, 20].
Diskussion
Betrachtet man die wenigen vorliegenden Informationen zur Ätiologie und Neurobiologie bipolarer Störungen, wird klar, dass es sich um eine komplexe Erkrankung handelt, mit einer großen Bandbreite von Krankheitsbildern und Verlaufsformen, wahrscheinlich heterogen in Entstehung und Pathophysiologie. Die Patienten reagieren unterschiedlich auf die verfügbaren Medikamente und die Therapie muss individuell angepasst werden.
Vor diesem Hintergrund erhofft man sich von einem neuen Arzneistoff neben guter Wirksamkeit und Verträglichkeit auch Unterschiede zu den bisherigen Behandlungsmöglichkeiten bezüglich Wirkungsmechanismus oder Anwendung.
Einen solchen Unterschied bietet Asenapin, das ein neues und individuelles Profil von Rezeptor-Affinitäten und -Aktivitäten aufweist, wie eingangs ausgeführt.
Asenapin ist das einzige atypische Antipsychotikum, das ausschließlich sublingual verabreicht wird. Ein Vorteil dieser Art der Darreichung ist die schnelle Resorption des Wirkstoffs.
Die Studien mit Asenapin zur Behandlung mäßiger bis schwerer manischer und gemischter Episoden der Bipolar-I-Störung demonstrierten eine signifikant bessere Effektivität als Plazebo. Dabei setzte die Wirkung rasch ein, bereits nach zwei Behandlungstagen war eine signifikante Verbesserung der Symptome festzustellen.
Olanzapin hatte in den Asenapin-Kurzzeitstudien die Funktion, das Studiendesign zu validieren. Insofern sind Unterschiede in Bezug auf die primären und sekundären Endpunkte (z.B. Response und Remission) differenziert zu betrachten. In der vorliegenden Publikation kann die Differenzierung Olanzapin versus Asenapin daher nicht abschließend beurteilt werden, sondern muss gesondert in einer angestrebten Metaanalyse verifiziert werden.
Insgesamt zeigte Asenapin in klinischen Studien eine gute Verträglichkeit bei der Behandlung manischer und gemischter Episoden der Bipolar-I-Störung, insbesondere gab es nur eine geringe Tendenz zu Nebenwirkungen bezüglich Metabolismus und Prolactinspiegel.
Einen vergleichenden Überblick über die Inzidenz der häufigsten Nebenwirkungen verschiedener Antipsychotika gibt Tabelle 3. Die Hauptkategorien von UE bei den atypischen Antipsychotika sind ZNS-Symptome (z.B. Sedierung/Somnolenz), Körpergewichtszunahme, metabolische Veränderungen, Kardiotoxiziät und Neurotoxizität (insbesondere EPS). In allen diesen Kategorien hatte Asenapin entweder keine klinisch relevanten oder nur geringe Effekte. Mit Ausnahme der oralen Hypoästhesien, die wahrscheinlich durch die sublinguale Darreichungsform bedingt sind, zeigte Asenapin keine in dieser Medikamentenklasse neuen Nebenwirkungen. Obwohl die oralen Hypoästhesien in den Studien relativ häufig (ca. 5%) auftraten, führte dies nur selten zum Studienabbruch.
Tab. 3. Nebenwirkungen von Asenapin im Vergleich zu anderen Antipsychotika (aus Bishara und Taylor (2009) [4])
|
Substanz |
QTc-Verlängerung |
Sedierung |
Gewichtszunahme |
Diabetes mellitus |
EPS |
Anticholinerge Effekte |
Prolactinerhöhung |
|
Amisulprid |
+ |
– |
+ |
+ |
+ |
– |
+++ |
|
Aripiprazol |
– |
– |
+/– |
– |
+ |
– |
– |
|
Asenapin |
+ |
+ |
+/– |
– |
+ |
– |
+/– |
|
Chlorpromazin |
++ |
+++ |
++ |
++ |
++ |
++ |
++ |
|
Clozapin |
+ |
+++ |
+++ |
+++ |
– |
+++ |
– |
|
Haloperidol |
+ |
+ |
+ |
+ |
+++ |
– |
+++ |
|
Olanzapin |
+ |
++ |
+++ |
+++ |
+/– |
+ |
+ |
|
Quetiapin |
++ |
++ |
++ |
++ |
– |
– |
– |
|
Risperidon |
+ |
+ |
++ |
++ |
+ |
+ |
+++ |
|
Sulpirid |
+ |
– |
+ |
+ |
+ |
– |
+++ |
|
Ziprasidon |
++ |
+ |
+/– |
– |
+/– |
– |
+/– |
+++: Inzidenz/Schweregrad hoch; ++: Inzidenz/Schweregrad mittel; +: Inzidenz/Schweregrad niedrig; –: Inzidenz/Schweregrad sehr niedrig; EPS: extrapyramidal-motorische Symptome
Im Praxisalltag werden atypische Antipsychotika häufig zusammen mit anderen Medikamenten eingesetzt. In einer Studie wurde Asenapin zusätzlich zu Valproinsäure oder Lithium angewendet und zeigte auch hier eine gute Verträglichkeit [6]. Studien mit gesunden Probanden zeigten aber, dass bei der gemeinsamen Anwendung von Asenapin mit Fluvoxamin (Erhöhung der Asenapin-Plasmaspiegel) oder Paroxetin (Erhöhung der Paroxetin-Plasmaspiegel) Vorsicht geboten ist [12].
Die in Studien gewonnenen Informationen über Asenapin belegen gute Voraussetzungen für den Einsatz im Praxisalltag: Asenapin bringt ein neues Profil von Rezeptor-Affinitäten und -Aktivitäten mit und ist bei guter Verträglichkeit sowohl in der Monotherapie als auch in der Kombinationstherapie deutlich wirksamer als Plazebo [6, 24–27]. Die besondere Stärke des schnell wirksamen Asenapins könnte in der Zukunft unter anderem in der Behandlung von Bipolar-I-Patienten mit metabolischen Problemen liegen.
Literatur
1. Alex KD, Pehek EA. Pharmacologic mechanisms of serotonergic regulation of dopamine neurotransmission. Pharmacol Ther 2007;113:296–320.
2. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders DSM-IV-TR. 4th edition. Text revision. Washington DC: American Psychiatric Association, 2000.
3. Arolt V, Behnken A. Epidemiologie. In: Deutsche Gesellschaft für Bipolare Störungen e.V. (Hrsg.). Weißbuch. Bipolare Störungen in Deutschland. 2. überarbeitete Auflage. Nordersted: BOD, 2006:15–36.
4. Bishara D, Taylor D. Asenapine monotherapy in the acute treatment of both schizophrenia and bipolar I disorder. Neuropsychiatr Dis Treat 2009;5:483–90.
5. Bobes J. The general problem of increased somatic comorbidity in bipolar patients. Ann Gen Psychiatry 2010;9(Suppl 1):S32. www.ncbi.nlm.nih.gov/pmc/articles/PMC2991943/ (Zugriff am 23.8.2011).
6. Calabrese JR, Stet L, Kothari H, et al. Asenapine as adjunctive treatment for bipolar mania: results of a placebo-controlled 12-week study and 40-week extension. Poster presented at American Psychiatric Association’s (APA) 62nd Institute on Psychiatric Services. October 2010; Boston, MA, USA.
7. Citrome L. Asenapine for schizophrenia and bipolar disorder: a review of the efficacy and safety profile for this newly approved sublingually absorbed second-generation antipsychotic. Int J Clin Pract 2009;63:1762–84.
8. Colom F, Vieta E, Tacchi MJ, et al. Identifying and improving non-adherence in bipolar disorders. Bipolar Disord 2005;7(Suppl 5):24–31.
9. Das AK, Olfson M, Gameroff MJ, et al. Screening for bipolar disorder in a primary care practice. JAMA 2005;293:956–63.
10. Dogterom P, Hulskotte E, Gerrits M, et al. Asenapine pharmacokinetics: influence of cytochrome p450 modulators and udp-glucuronyltransferase inhibition (abstract no. P.3.d.008). Eur Neuropsychopharmacol 2008;18(Suppl 4):S452–3.
11. Dogterom P, Schnabel PG, Timmer C, et al. Effect of carbamazepine on asenapine pharmacokinetics (abstract no. PII-44). Clin Pharmacol Ther 2008;83(Suppl 1):S55.
12. Fachinformation (Zusammenfassung der Merkmale des Arzneimittels). Sycrest® 5 mg Sublingualtabletten. Organon, September 2010.
13. FDA Psychopharmacologic Drugs Advisory Committee Meeting Saphris® (asenapine) Sublingual Tablets (NDA 22-117). July 30, 2009. Advisory Committee Briefing Materials: Available for Public Release. Schering-Plough Research Institute, a Division of Schering Corporation. Kenilworth, NJ. www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/ Drugs/PsychopharmacologicDrugsAdvisoryCommittee/UCM173876.pdf (Zugriff am 23.8.2011).
14. Gerrits M, Doorstam DP, Spaans E, et al. Effect of valproate on the glucuronidation of asenapine (abstract no. PI-68). Clin Pharmacol Ther 2008;83(Suppl 1):S29.
15. Ghaemi SN, Boiman E, Goodwin FK. Diagnosing bipolar disorder and the effect of antidepressants. A naturalistic study. J Clin Psychiatry 2000;61:804–8.
16. Gonzalez-Pinto AM, Dardennes R, de Zélicourt M, et al. Inpatient care costs of patients with bipolar I disorder: a comparison between two European centers. J Affect Disord 2010;121:152–5.
17. Grunze H, Severus E. Bipolare Störungen erkennen. Die Kunst der korrekten Diagnose. DNP 2005;Sonderheft 1:8–9.
18. Hirschfeld RM, Vornik LA. Bipolar disorder – costs and comorbidity. Am J Manag Care 2005;11(Suppl 3):S85–90.
19. Hulskotte E, Spaans E, Timmer C, et al. Effects of water intake and smoking on the absorption of sublingually administered asenapine (abstract no. NR1-040). 162nd Annual Meeting of the American Psychiatric Association 2009; San Francisco.
20. Johnsen E, Jørgensen HA. Effectiveness of second generation antipsychotics: a systematic review of randomized trials. BMC Psychiatry 2008;8:31. doi: 10.1186/1471-244X-8-31.
21. Mathews M, Muzina DJ. Atypical antipsychotics: new drugs, new challenges. Cleve Clin J Med 2007;74:597–606.
22. Meltzer HY, Fang VS. The effect of neuroleptics on serum prolactin in schizophrenic patients. Arch Gen Psychiatry 1976;33:279–86.
23. McIntyre RS, Cohen M, Zhao J, et al. A 3-week, randomized, placebo-controlled trial of asenapine in the treatment of acute mania in bipolar mania and mixed states. Bipolar Disord 2009;11:673–86.
24. McIntyre RS, Cohen M, Zhao J, et al. Asenapine for long-term treatment of bipolar disorder: a double-blind 40-week extension study. J Affect Disord 2010;126:358–65.
25. McIntyre RS, Cohen M, Zhao J, et al. Asenapine in the treatment of acute mania in bipolar I disorder: a randomized, double-blind, placebo-controlled trial. J Affect Disord 2010;122:27–38.
26. McIntyre RS, Cohen M, Zhao J, et al. Asenapine versus olanzapine in acute mania: a double-blind extension study. Bipolar Disord 2009;11:815–26.
27. Miklowitz DJ, Johnson SL. The psychopathology and treatment of bipolar disorder. Annu Rev Clin Psychol 2006;2:199–235.
28. Montoya A, Pérez Sánchez Toledo J, Gilaberte I, et al. Patterns of drug treatment for manic episode in the clinical practice. Outcomes of the Spanish sample in the EMBLEM Study. Actas Esp Psiquiatr 2007;35:315–22.
29. Organon, Data on file
30. Peeters P, Bockbrader H, Spaans E, et al. Asenapine pharmacokinetics: influence of hepatic and renal impairment (abstract no. NR4-081). 161st Annual Meeting of the American Psychiatric Association 2008; Washington, DC.
31. Perlis RH. Misdiagnosis of bipolar disorder. Am J Manag Care 2005;11(Suppl 9):S271–4.
32. Sajatovic M, Ignacio RV, West JA, et al. Predictors of non-adherence among individuals with bipolar disorder receiving treatment in a community mental health clinic. Compr Psychiatry 2009;50:100–7.
33. Scherk H, Pajonk FG, Leucht S. Second-generation antipsychotic agents in the treatment of acute mania: a systematic review and meta-analysis of randomized controlled trials. Arch Gen Psychiatry 2007;64:442–55.
34. Shahid M, Walker GB, Zorn SH, Wong EH. Asenapine: a novel psychopharmacologic agent with a unique human receptor signature. J Psychopharmacol 2009;23:65–73.
35. Smith LA, Cornelius V, Warnock A, et al. Acute bipolar mania: a systematic review and meta-analysis of co-therapy vs. monotherapy. Acta Psychiatr Scand 2007;115:12–20.
36. Suppes T, Leverich GS, Keck PE, et al. The Stanley Foundation Bipolar Treatment Outcome Network. II. Demographics and illness characteristics of the first 261 patients. J Affect Disord 2001;67:45–59.
Prof. Dr. Hans-Peter Volz, Krankenhaus für Psychiatrie, Psychotherapie und Psychosomatische Medizin, Schloß Werneck, Balthasar-Neumann-Platz 1, 97440 Werneck, E-Mail: hans-peter.volz@kh-schloss-werneck.de
Asenapine. A new atypical antipsychotic for the treatment of moderate up to severe manic episodes of bipolar-I-disorder in adults
Asenapine is a new atypical antipsychotic for the treatment of acute manic episodes of bipolar I disorder in adults. In clinical trials of monotherapy with asenapine the efficacy was significantly higher than that of placebo and combined with a good safety and tolerability profile. Improvements of total scores of the Young Mania Rating Scale (YMRS) seen after 12 weeks were sustained up to 52 weeks.
Adjunctive asenapine was also significantly more effective than placebo in improving YMRS total scores. The clinical trials with asenapine showed a favourable profile of side effects: the risk for extrapyramidal symptoms (EPS) is comparatively low, as is the potential to cause metabolic abnormalities and the risk of increased body weight; the risk for prolactin elevation is very low. Asenapine has a unique profile of receptor affinities and activities. It is an antagonist with strong affinity for a number of serotonergic (5-HT2A, 5-HT2B, 5-HT2C, 5-HT6 und 5-HT7), adrenergic (α2) and dopaminergic (e.g. D3 und D4) receptors, but has no affinity for muscarinergic receptors.
In addition the affinity of asenapine for the 5-HT2A receptor is 19-fold that of its affinity for the D2 receptor, which is regarded as predictor of a low EPS risk. With these properties asenapine is a useful alternative in the treatment of bipolar mania. It has a fast onset of action: first effects are visible on the second day of treatment. Asenapine may be of particular use for patients at risk of metabolic abnormalities.
Key words: Asenapine, atypical antipsychotics, bipolar disorder I, acute mania
Psychopharmakotherapie 2011; 18(05)
