Gerd Laux, Carsten Steinmann, Wasserburg, und Thomas Glaser, Leverkusen, für die Studiengruppe
Mit den Antipsychotika der ersten Generation (First generation antipsychotics, FGA) und zweiten Generation (Second generation antipsychotics, SGA) steht heute eine Vielzahl von Medikamenten zur Behandlung schizophrener Patienten zur Verfügung. Der Mangel valider Prädiktoren, mit Hilfe derer eine individuell abgestimmte Wahl des für einen Patienten geeigneten Antipsychotikums erfolgen könnte, führt zu Kontroversen über die relevanten Auswahlkriterien. Mit der Einführung der Zweitgenerations-Antipsychotika in den 90er Jahren des vergangenen Jahrhunderts ist deren Verordnung aufgrund des im Vergleich zu den Erstgenerations-Antipsychotika vermeintlich besseren Verträglichkeitsprofils stark gestiegen [49]. Daten aus deutschen Kliniken zeigen, dass in den Jahren 1997 bis 1998 etwa 48%, zwischen 2004 und 2007 etwa 63% der schizophrenen Patienten mit Zweitgenerations-Antipsychotika behandelt wurden [11, 25]. Auf Basis kontrollierter Studien wurden unter anderem eine bessere extrapyramidal-motorische Verträglichkeit, höhere Wirksamkeit auf Negativsymptomatik und kognitive Funktionen sowie eine geringere Beeinflussung des Prolactin-Spiegels postuliert [5, 36]. Die Gruppe der Zweitgenerations-Antipsychotika stellt jedoch keine einheitliche Substanzklasse dar, sondern ist pharmakologisch sowie hinsichtlich Wirksamkeit und Verträglichkeit (wie auch die FGA) sehr heterogen [10, 16, 28, 29]. Dies bedeutet, dass die Auswahl eines für den jeweiligen Patienten geeigneten Medikaments nicht auf Basis einer Klassenzugehörigkeit erfolgen sollte, sondern auf Basis einer differenzierten Nutzen-Risiko-Abwägung (unabhängig davon, ob FGA oder SGA).
Hohe Verordnungszahlen und hoher Preis der Zweitgenerations-Antipsychotika und der infolgedessen starke Kostenanstieg für die Schizophreniebehandlung haben die Debatte über die Existenz einer Überlegenheit der Zweitgenerations-Antipsychotika gegenüber Erstgenerations-Antipsychotika und über Berechtigung und Sinnhaftigkeit ihres breiten Einsatzes entfacht [5, 14, 21]. Mehrere Studien und Metaanalysen mit unterschiedlichen Ansätzen sind zu dieser Thematik durchgeführt worden. Die Ergebnisse dieser Metaanalysen ergeben kein einheitliches Bild. Während in zwei Metaanalysen [14, 21] keine überlegene Wirksamkeit der Zweitgenerations-Antipsychotika im Vergleich zu den Erstgenerations-Antipsychotika (meist Haloperidol) in der Akutbehandlung schizophrener Patienten gezeigt werden konnte, kamen andere zu dem Schluss, dass einige Zweitgenerations-Antipsychotika den Erstgenerations-Antipsychotika in der Wirksamkeit überlegen, andere vergleichbar seien [5, 29, 51].
Die in den vergangenen Jahren publizierten großen Vergleichsstudien bestätigen auch unter Berücksichtigung methodischer Mängel [36], dass Wirksamkeit, Verträglichkeit, Kosteneffektivität und Effekte auf Lebensqualität und Behandlungszufriedenheit von Erst- und Zweitgenerations-Antipsychotika nicht grundsätzlich verschieden sind [6, 10, 20, 30, 32, 45]. Prospektive [40] und retrospektive [8] naturalistische Studien kommen zu ähnlichen Ergebnissen.
Ein grundlegendes Problem der kontrollierten Vergleichsstudien und damit auch der Metaanalysen ist, dass in der Mehrzahl der Studien Haloperidol als Vergleichssubstanz aus der Gruppe der Erstgenerations-Antipsychotika verwendet wurde [5]. Nur in wenigen Studien kamen andere Substanzen wie beispielsweise Chlorpromazin, Perphenazin, Fluphenazin und Perazin zum Einsatz [29]. Flupentixol, ein Erstgenerations-Antipsychotikum aus der Klasse der Thioxanthene, wurde in insgesamt drei kontrollierten Studien mit einem Zweitgenerations-Antipsychotikum verglichen, nämlich mit Amisulprid [52], Risperidon [43, 46] und Olanzapin [13]. Die Ergebnisse zeigen eine vergleichbare antipsychotische Wirksamkeit von Flupentixol und dem jeweiligen Zweitgenerations-Antipsychotikum auf Positiv- und Negativsymptomatik. Auch bei der Verträglichkeit insgesamt fanden sich keine Unterschiede, der Anteil anticholinerger Begleitmedikation war jedoch im Flupentixol-Arm in den Studien versus Risperidon [43] und Olanzapin [13] signifikant höher.
In diesen drei Studien wurde Flupentixol in Tablettenform verwendet. Im klinischen Alltag wird Flupentixol jedoch bevorzugt in Form des Decanoat-Esters (Fluanxol® Depot) eingesetzt. Flupentixoldecanoat (FD) ist in den 1970/1980er Jahren in einer Vielzahl von Studien untersucht worden, allerdings sind bisher keine dem heutigem Standard entsprechenden kontrollierten Studien bei schizophrenen Patienten durchgeführt worden. Aber auch aus prospektiven Phase-IV-Beobachtungsstudien, in denen Erfahrungen aus der breiten und unselektierten Anwendung eines Arzneimittels gesammelt werden, lassen sich wertvolle Daten zu Effektivität und Verträglichkeit gewinnen. In den nichtinterventionellen Studien von Kühn et al. [26] und Messer et al. [34] wurden 658 Patienten bzw. 128 Patienten mit Flupentixol über 10 Wochen bzw. bis zu 18 Monaten behandelt, etwa 65% davon mit Flupentixoldecanoat. In beiden Studien wurde im Rahmen eines Therapiewechsels eine Umstellung der antipsychotischen Medikation von entweder Risperidon oder Olanzapin auf Flupentixol vorgenommen. Wirksamkeit, Verträglichkeit und Compliance der Patienten wurde bei etwa 75% der Patienten als sehr gut oder gut beurteilt, die Lebensqualität, gemessen mit dem SWN-K, verbesserte sich deutlich.
Basierend vor allem auf beschriebenen negativen Effekten einiger Zweitgenerations-Antipsychotika auf metabolische Parameter stehen in neuester Zeit Berichte über das erhöhte Risiko für koronare Herzerkrankung, plötzlichen Herztod, Diabetes mellitus und Toxizität im Fokus [2, 3, 9, 22, 44, 48]. Die European Psychiatric Association (EPA) legte deshalb jüngst ein Positionspapier vor, das den behandelnden Ärzten die Beachtung und Kontrolle kardiovaskulärer und metabolischer Risikofaktoren bei der Behandlung schwer psychisch Kranker nahelegt [7].
Ziel der nachfolgend beschriebenen nichtinterventionellen, multizentrischen Studie war es, an einer mit Flupentixoldecanoat behandelten Gruppe chronisch schizophrener Patienten über einen Zeitraum von sechs Monaten Aspekte von Wirksamkeit und Verträglichkeit sowie der subjektiven Befindlichkeit zu untersuchen sowie Hinweise auf Rückfallquoten, Rehospitalisierungen und Compliance zu erhalten.
Patienten und Methoden
Die prospektive, nichtinterventionelle Kohortenstudie bei Patienten mit chronischer Schizophrenie wurde von Januar 2006 bis Dezember 2008 an zehn Zentren in Deutschland und Österreich durchgeführt. Dabei handelte es sich um sieben psychiatrische Kliniken und drei psychiatrisch-nervenärztliche Praxen. Die Studie wurde in Übereinstimmung mit den gesetzlichen und behördlichen Richtlinien durchgeführt.
Die Diagnostik der chronischen Schizophrenie erfolgte nach ICD-10. Sowohl Patienten mit antipsychotischer Vorbehandlung (unabhängig von der eingesetzten Medikation und Darreichungsform) als auch solche ohne Vorbehandlung konnten eingeschlossen werden. Flupentixoldecanoat kam im Rahmen der praxisüblichen Therapie auf Grundlage der Therapieentscheidung des behandelnden Arztes zum Einsatz. Ausschlusskriterien waren lediglich Kontraindikationen zum Einsatz von Fluanxol® Depot gemäß Fachinformation sowie bekannte Drogen- und Alkoholabhängigkeit. Weitere Kriterien waren nicht vorgegeben, da der routinemäßige Einsatz in Klinik und Praxis widergespiegelt werden sollte.
Bei Studieneinschluss erfolgte zunächst eine Anamnese, die Klassifikation der Erkrankung sowie die Erhebung der vorgegebenen demographischen Daten. Für die Verordnung von Flupentixoldecanoat war die Herstellerempfehlung heranzuziehen, wobei die individuelle Dosierung im Rahmen der Dosierungsvorgaben bedarfsorientiert adaptiert werden konnte. Die Beobachtungsdauer betrug insgesamt 24 Wochen. Nach der Basiserhebung waren drei Folgeuntersuchungen (FU) vorgesehen: nach vier bis sechs Wochen, nach 12 und nach 24 Wochen.
Die Erfassung der Psychopathologie erfolgte mit der Brief Psychiatric Rating Scale (BPRS, [41]). Hierbei wird die Positivsymptomatik anhand der vier Kernsymptome (Zerfall des Denkens, Halluzinationen, Misstrauen und ungewöhnliche Denkinhalte) erfasst. Der Krankheitsgrad („leicht“ – „mäßig“ – „deutlich“ – „schwer“ – „extrem schwer“) sowie die Veränderung des psychopathologischen Zustandsbildes („gebessert“ – „unverändert“ – „verschlechtert“) unter der Behandlung wurden mit dem Clinical Global Impression (CGI, [39]) dokumentiert.
Zusätzlich zu BPRS und CGI wurden das subjektive Wohlbefinden (SWN-K, [38]) und der allgemeine Gesundheitszustand bei den Patienten erhoben. Die Einschätzung des Letzteren erfolgte über die graduierte visuelle Analogskala (VAS) des EuroQol [24] von 0 bis 100, wobei 0 den am schlechtesten denkbaren und 100 den besten denkbaren Gesundheitszustand darstellen. Die Patienten konnten in dieser Skala ihre persönliche Beurteilung zu ihrem aktuellen Gesundheitszustand durch eine entsprechende Markierung eintragen. Zur Bewertung des subjektiven Wohlbefindens (SWN) unter der Medikation gab es einen Fragebogen mit 20 Fragen zum persönlichen Empfinden, die jeweils mit „überhaupt nicht“, „sehr wenig“, „wenig“, „deutlich“, „stark“ und „sehr stark“ beurteilt werden konnten.
Zur Bewertung der Verträglichkeit der Medikation wurden unerwünschte Ereignisse (AE) fortlaufend dokumentiert. Zur Quantifizierung extrapyramidaler Störungen kam die Skala zur Fremdbeurteilung extrapyramidaler Symptome nach Simpson und Angus [50] zum Einsatz. Diese ist ein Instrument zur Beurteilung der Parkinson-Symptomatik im Rahmen von Neuroleptika-Behandlungen. In dieser Skala sind zehn Symptome (Items: Gang, Herunterfallen der Arme, Rigidität in den Schultern, Rigidität im Ellbogengelenk, Rigidität im Handgelenk, Pendelbewegungen der Beine, Rigidität der Nackenmuskulatur, Glabella-Reflex, Tremor, Speichelsekretion) aufgeführt, die entsprechend ihrer Ausprägung auf einer 5-stufigen Skala von 0 bis 4 beurteilt werden. Ein Wert von 0 wird bei vollständigem Fehlen der Symptomatik vergeben, ein Wert von 4 zeigt den am stärksten ausgeprägten Schweregrad an. Zur Berechnung des Gesamtwerts werden die einzelnen Itembewertungen aufaddiert und durch die Anzahl der bewerteten Items dividiert. Der Schweregrad wird folgendermaßen beurteilt: bis 0,3 – minimal; 0,4 bis 1,0 – leicht; 1,1 bis 1,5 – mittel; 1,6 und höher – ausgeprägt.
BPRS, CGI, SWN-K, VAS, Gewicht/Body-Mass-Index, extrapyramidal-motorische Symptome und unerwünschte Ereignisse wurden jeweils in der Basisuntersuchung und zu den drei Folgeuntersuchungen erhoben. In der dritten Folgeuntersuchung, der Abschlussuntersuchung, erfolgte zusätzlich die globale Bewertung der Wirksamkeit und Verträglichkeit der Medikation sowie der Patienten-Compliance.
Statistik
Alle Patienten, die zumindest einmal eine Injektion von Flupentixoldecanoat im Beobachtungszeitraum erhalten hatten (n=96), wurden in die Auswertung zu Wirksamkeit und Verträglichkeit eingeschlossen. Unter Verwendung von Summenstatistiken für kategoriale und quantitative Daten mittels SAS (Version 9.1) wurde eine deskriptive und explorative Auswertung durchgeführt. Für jeden Beobachtungszeitpunkt wurden die Summenscores für BPRS, SWN-K sowie die EPS-Skala gebildet. Für die visuelle Analogskala wurden die Werte für die jeweilige Visite ermittelt. Schweregrad und Zustandsänderung der Erkrankung wurden mit den vorgegebenen Bewertungsmaßstäben im CGI verfolgt. Berechnet wurden jeweils: Medianwert, Mittelwert, Standardabweichung, Minimal- und Maximalwert, erstes Quartil (Q1), drittes Quartil (Q3), P5%, P95%, P1%, P99% und 95%-Konfidenzintervalle. Für die Bestimmung von statistischen Signifikanzen wurden p-Werte berechnet.
Zur Charakterisierung von Einflussgrößen und Risikofaktoren wurden Subgruppen gebildet und stratifizierte Analysen explorativ durchgeführt, beispielsweise zur Flupentixoldecanoat-Dosierung (<2 mg; ≥2–5 mg; ≥5–10 mg; ≥10–20 mg, ≥20 mg).
Unerwünschte Ereignisse wurden als Absolutzahl und in Prozent angegeben und die Kausalität zur Behandlung mit Flupentixoldecanoat beurteilt.
Ergebnisse
Studienpopulation
96 Patienten wurden in die Beobachtungsstudie über 24 Wochen eingeschlossen, 12 (12,5%) davon beendeten die Studie vor Ablauf der 24 Wochen Beobachtungsdauer. Dies geschah wegen mangelnder Compliance (50%), ungenügender Wirksamkeit und Verträglichkeit (33%), unerwünschter Ereignisse (25%) und aus anderen Gründen.
Die meisten Patienten (65%) waren zwischen 40 und 60 Jahre alt (Abb. 1). Die Altersklasse der 20- bis 40-Jährigen machte 25% aus. Der Anteil der Männer war größer (57,3%) als der der Frauen (40,6%; Rest: keine Angabe). Weitere Basisdaten können der Tabelle 1 entnommen werden.
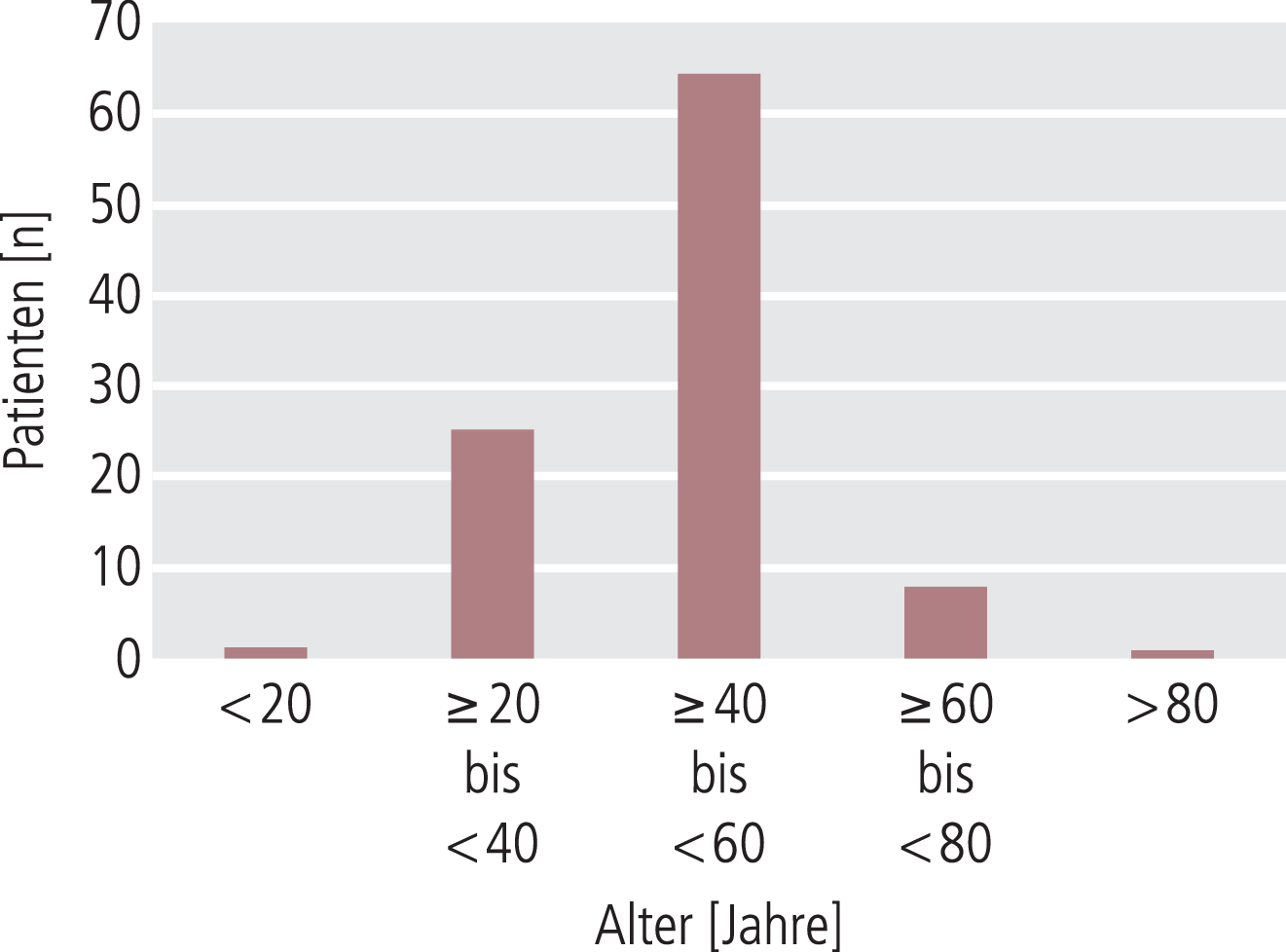
Abb. 1. Altersverteilung der Patienten zu Studienbeginn
Tab. 1. Demographische Daten der Studienpopulation: Alter, Größe, Gewicht/Body-Mass-Index (BMI)
|
Männlich |
Weiblich |
Gesamt |
||||
|
n |
[%] |
n |
[%] |
n |
[%] |
|
|
Anzahl [%] der Patienten |
55 |
57,3 |
39 |
40,6 |
96* |
100 |
|
Alter [Jahre] |
|
|
|
|
|
|
|
Mittelwert (SD) |
43,9 (9,9) |
48,9 (13,4) |
46 (11,6) |
|||
|
Gewicht [kg] |
|
|
|
|||
|
BMI [kg/m2] |
|
|
|
|||
|
Größe [cm] |
|
|
|
|||
*Für zwei Patienten fehlen Angaben zum Geschlecht
Das mittlere Körpergewicht lag bei 82,4 kg und in Relation zur mittleren Größe von 172 cm bereits zu Beobachtungsbeginn relativ hoch. Daher trifft das auch für den BMI zu. Dies kann möglicherweise durch die lange Krankheitsdauer und die bereits über lange Zeit durchgeführte Behandlung mit verschiedenen Antipsychotika erklärt werden.
Mehr als die Hälfte der Patienten (55,2%) litten unter einer paranoiden Schizophrenie. Am zweithäufigsten war die residuale (17,7%) und am dritthäufigsten die hebephrene Schizophrenie (10,4%). Die anderen Formen traten mit deutlich geringerer Inzidenz auf (Tab. 2). Die mittlere Krankheitsdauer betrug in der Population 14,6 Jahre mit 7,6 Krankheitsepisoden in diesem Zeitraum. 84,4% der Patienten waren mit Antipsychotika vorbehandelt, die Vorbehandlung erfolgte im Mittel über 4,6 Jahre. 25% gaben an, auch Anticholinergika zu erhalten.
Tab. 2. Klassifikation der Schizophrenie, Erkrankungsdauer und Vorbehandlung in der Studienpopulation
|
Population |
n |
[%] |
|
|
Klassifikation der Schizophrenie (ICD-10)* |
Paranoide Schizophrenie |
53 |
55,2 |
|
Krankheitsdauer |
14,6 (10,9) Jahre |
96 |
|
|
Anzahl der Krankheitsepisoden seit Diagnose |
7,6 (6,8) |
70 |
|
|
Antipsychotische Vorbehandlung |
Vorbehandelt |
81 |
84,4 |
|
Dauer der antipsychotischen Vorbehandlung |
4,6 (5,5) Jahre |
||
|
Anticholinerge Vorbehandlung |
Vorbehandelt |
24** |
25 |
*Mehrfachnennungen möglich; **n=22 (22,9 %) waren mit Biperiden vorbehandelt
Vierzig Patienten waren mit Flupentixol (als Depot sowie in oraler Darreichungsform) als Monotherapie (n=33) oder in Kombination vorbehandelt, 12 (n=10) mit Risperidon als Monotherapie, 8 mit Haloperidol und je 7 mit Olanzapin und Quetiapin (Tab. 3). Bei den restlichen Patienten wurden andere Antipsychotika in geringerer Anzahl eingesetzt.
Tab. 3. Angaben zur neuroleptischen Vorbehandlung; von 81 Patienten erhielten 29 (44,4%) die Medikation oral und 51 (63%) als Depot, 1 Patient (1,2%) erhielt die Medikation parenteral
|
Medikament |
n |
[%] |
|
Insgesamt |
96 |
100,0 |
|
Keine Angaben |
16 |
16,7 |
|
Amisulprid |
1 |
1,0 |
|
Amisulprid + Flupentixol |
1 |
1,0 |
|
Aripiprazol |
2 |
2,1 |
|
Chlorprothixen + Flupentixol |
1 |
1,0 |
|
Clopenthixolhydrochlorid |
1 |
1,0 |
|
Clozapin + Flupentixol |
1 |
1,0 |
|
Flupentixol |
33 |
34,4 |
|
Flupentixol + Quetiapin |
2 |
2,0 |
|
Fluphenazin |
3 |
3,1 |
|
Haloperidol |
8 |
8,3 |
|
Olanzapin |
6 |
6,3 |
|
Olanzapin + Flupentixol |
1 |
1,0 |
|
Paliperidon |
1 |
1,0 |
|
Perazin |
1 |
1,0 |
|
Quetiapin |
4 |
4,2 |
|
Quetiapin + Aripiprazol |
1 |
1,0 |
|
Risperidon |
10 |
10,4 |
|
Risperidon + Aripiprazol |
1 |
1,0 |
|
Risperidon + Flupentixol |
1 |
1,0 |
|
Zuclopenthixol |
1 |
1,0 |
Daten zur Berufstätigkeit und Wohnsituation wurden bei Start und Ende der Studie erhoben. Zu Beginn waren 80,2% Selbstversorger, 15,6% nutzten betreutes Wohnen und 4,2% lebten im Wohnheim. Am Verlaufsende waren noch 72,9% Selbstversorger. Vier Patienten lebten inzwischen betreut, von dreien fehlten Angaben zur aktuellen Wohnsituation. Wie bei dieser schweren chronischen Erkrankung zu erwarten, gingen lediglich etwa ein Fünftel einer Berufstätigkeit nach, 72% waren entweder arbeitslos oder berufsunfähig. Während der Beobachtung schied ein weiterer Patient wegen Berufsunfähigkeit aus dem Arbeitsleben aus.
Etwa die Hälfte der Patienten waren Raucher und nahmen Alkohol zu sich (Tab. 4).
Tab. 4. Angaben zur Berufstätigkeit, Wohnsituation, zum Alkohol- und Nicotinkonsum
|
Merkmal [n (%)] |
Start |
Ende |
|
(N=96) |
(N=93*) |
|
|
Wohnsituation |
||
|
Selbstversorger |
77 (80,2) |
70 (72,9) |
|
Betreutes Wohnen |
15 (15,6) |
19 (19,8) |
|
Wohnheim |
4 (4,2) |
4 (4,2) |
|
Berufstätigkeit |
||
|
Ja |
21 (21,9) |
20 (20,8) |
|
Nein |
72 (75,0) |
73 (76,0) |
|
Keine Angaben |
3 (3,1) |
3 (3,1) |
|
Alkoholkonsum |
||
|
Ja, leicht Ja, moderat Ja, schwer |
35 (36,5) 14 (14,6) 4 (4,2) |
Nicht erhoben |
|
Nein |
40 (41,7) |
|
|
Keine Angaben |
3 (3,1) |
|
|
Nicotinkonsum |
||
|
Ja |
53 (55,2) |
Nicht erhoben |
|
Nein –Derzeit nicht –Früher Raucher |
42 (43,7) 34 (35,4) 8 (8,3) |
|
|
Keine Angabe |
1 (1,0) |
*n=3 keine Angaben verfügbar
Begleiterkrankungen und Begleitmedikation
Von den 96 Teilnehmern der Beobachtung wiesen 53 (55,2%) keine Begleiterkrankung auf. Bei den 43 Patienten mit Begleiterkrankungen dominierten nach der Häufigkeit endokrine (11,5%), kardiale (9,4%), psychiatrische (8,3%), vaskuläre (7,3%), metabolische (6,3%) und respiratorische (6,3%) Erkrankungen. 25% der Patienten hatten eine, 10,4% zwei, 6,3% drei und 3,1% mehr als drei Begleiterkrankungen. Infolgedessen war auch der Anteil von Patienten mit ein bis drei Begleitmedikationen entsprechend hoch (Abb. 2).
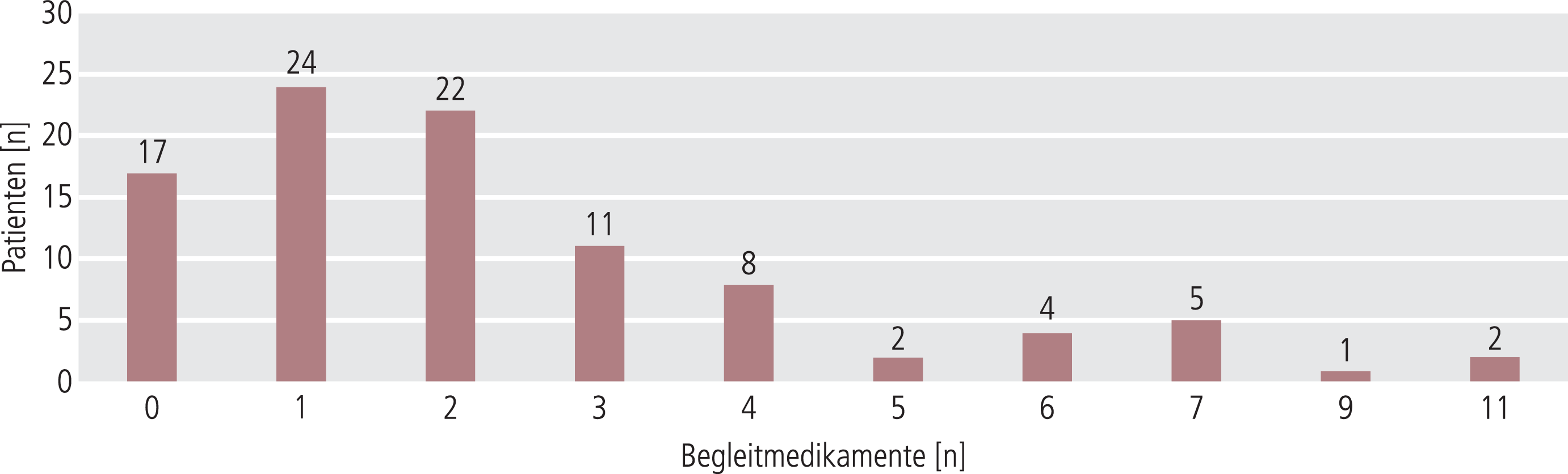
Abb. 2. Anzahl und Verteilung der Patienten mit Begleitmedikation
Psychopharmaka wurden als Begleitmedikationen häufig genannt: 39 Patienten erhielten Antidepressiva und 43 Neuroleptika. Benzodiazepine, Anxiolytika und Antiepileptika wurden deutlich weniger häufig gleichzeitig eingenommen. Die hohe Rate der Begleitmedikation mit weiteren Psychopharmaka spiegelt die Schwere der Erkrankung beziehungsweise Probleme bei der Behandlung wider. Von den 43 Patienten, die zusätzlich eine antipsychotisch wirksame Begleitmedikation verschrieben bekamen, erhielten 15 Patienten ein Zweitgenerations-Antipsychotikum, knapp die Hälfte davon (n=8) Quetiapin allein oder in Kombination mit Flupentixol (n=1) oder einem anderen Zweitgenerations-Antipsychotikum (n=1).
Medikation
Flupentixoldecanoat steht in zwei verschiedenen Stärken zur Verfügung, als 2%ige und 10%ige Lösung zur intramuskulären Injektion. 78 Patienten erhielten in der Beobachtungsstudie die 2%ige und 18 die 10%ige Injektionslösung. Die Verteilung der Anzahl der Injektionen pro Patient ist in Abbildung 3 dargestellt. Die meisten Patienten erhielten im Beobachtungszeitraum 9 bis 14 Injektionen. Das mittlere Injektionsvolumen betrug bei den Patienten, die Flupentixoldecanoat 2% erhielten, 1,5±0,8 ml (30±16 mg Wirkstoff), bei Gabe von Flupentixoldecanoat 10% 1,2±0,5 ml (120±50 mg). Das mittlere Injektionsintervall betrug 19,3±6,4 Tage, die mittlere Anzahl von Injektionen pro Patient war 10,4±3,3.
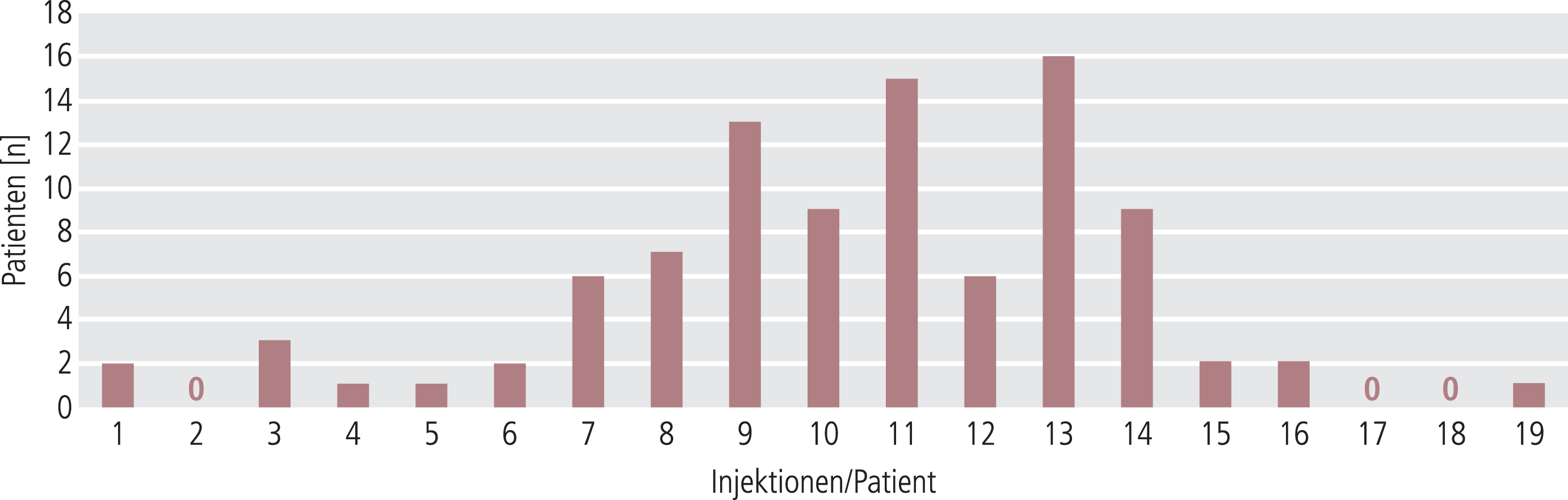
Abb. 3. Zahl der Injektionen pro Patient im Beobachtungszeitraum über 24 Wochen
Abbruchquote
Insgesamt 12 Patienten beendeten die Beobachtungsstudie vorzeitig. Als Gründe dafür wurden angegeben: mangelnde Compliance (50%), ungenügende Wirksamkeit (33,3%), Nebenwirkungen (25%), Therapiewechsel (8,3%), andere (16,7%).
Zeitraum zwischen Start und Folgeuntersuchungen
Geplant war eine erste Folgeuntersuchung 4 bis 6 Wochen nach dem Start der Studie, die zweite Folgeuntersuchung nach etwa 12 und die letzte nach 24 Wochen. Nach der statistischen Berechnung erfolgten die erste Folgeuntersuchung im Mittel nach 4,8±1,4, die zweite nach 12,6±1,9 und die dritte nach 24,1±5,8 Wochen.
Klinische Wirkung
Psychopathologie
BPRS-Summenscore. Im Beobachtungszeitraum verbesserte sich die Psychopathologie kontinuierlich gemäß BPRS insgesamt um 27,4% von 57,3±20,9 auf 41,6±14,1 Punkte (p<0,0001). Das Maximum der Verbesserung wurde bei der dritten Folgeuntersuchung nach etwa 24 Wochen erreicht (Abb. 4).
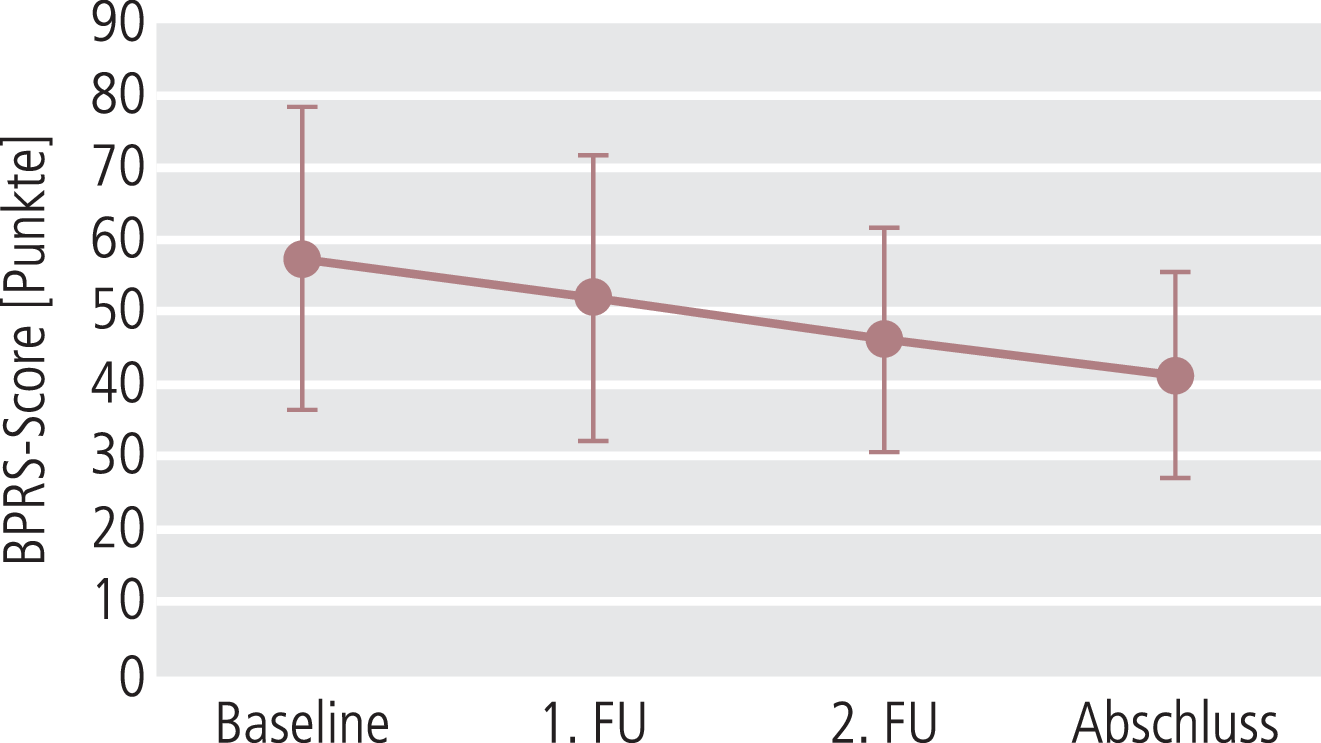
Abb. 4. BPRS im Verlauf der Beobachtung; p<0,0001; FU: Folgeuntersuchung
Rückfallquote. Im Beobachtungszeitraum erlitten 12 Patienten einen und zwei Patienten zwei Rückfälle. Die Rückfallquote betrug damit insgesamt 14,6%. In zwei Fällen stand der Rückfall in direktem Zusammenhang mit der vorzeitigen Beendigung der Pharmakotherapie. In sechs Fällen kam es aufgrund des Rückfalls zu einer Hospitalisierung mit einer durchschnittlichen Aufenthaltsdauer von 29,3±18,2 Tagen.
Klinische Gesamtbeurteilung (CGI)
Hinsichtlich des Schweregrads der Erkrankung wurden im CGI zu Beobachtungsbeginn 4 Patienten als leicht, 24 als mäßig, 39 als deutlich, 26 als schwer und 3 als extrem schwer krank eingestuft. Wie aus der Analyse der zugeordneten Initial-Dosierung ersichtlich ist (Abb. 5), erhielten leicht Kranke ausschließlich Dosierungen zwischen 2 und 5 mg/Tag, mäßig und deutlich Erkrankte dagegen von 2 bis mehr als 20 mg. Von den schwer kranken Patienten erhielten 11 eine Dosierung zwischen 2 und 5 mg/Tag, die anderen erhielten Dosierungen aus dem gesamten Dosisspektrum. Bei den als extrem krank eingestuften Patienten wurden initial Dosierungen zwischen 2 und 10 mg/Tag ausgewählt.
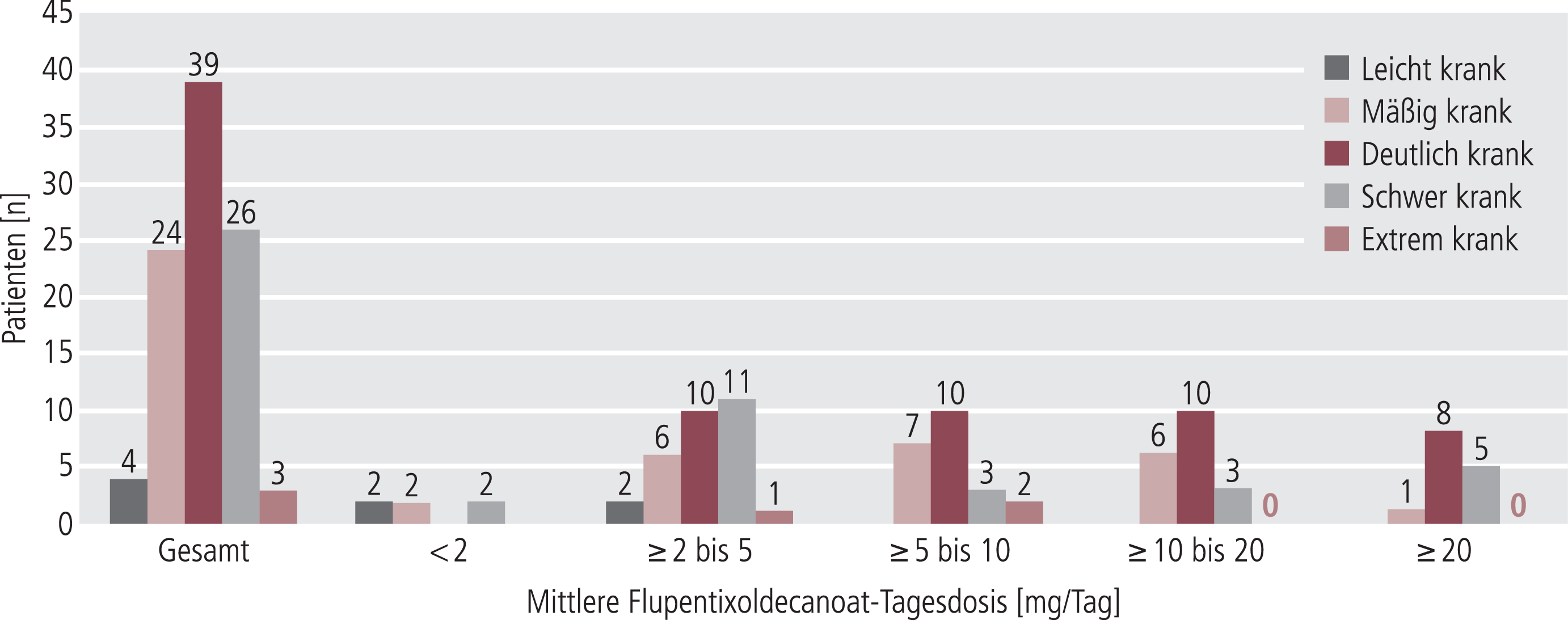
Abb. 5. Schweregrad der Erkrankung gemäß CGI bei Beobachtungsbeginn und Dosierungsbereiche von Flupentixoldecanoat
Bereits bei der ersten Folgeuntersuchung nach etwa fünf Wochen (Mittelwert 4,8±1,4 Wochen) ergab sich bei 52,2% der Patienten (n=48) eine Zustandsbesserung. Bis zum Ende der Beobachtung stieg dieser Anteil weiter auf 57,9%. Bei etwa 40% der Patienten blieb der Zustand im Wesentlichen unverändert. Der Anteil der Patienten mit einer Verschlechterung ihres Krankheitszustands schwankte zwischen 5,4% und 9,5% während des gesamten Beobachtungszeitraums (Tab. 5).
Tab. 5. Zustandsänderungen gemäß CGI im Beobachtungsverlauf; FU: Folgeuntersuchung
|
Beobachtungszeitpunkt |
Zahl der Patienten (N) |
Gebessert |
Unverändert |
Verschlechtert |
||||||
|
n |
[%] |
n |
[%] |
n |
[%] |
|||||
|
FU 1 |
92 |
48 |
52,2 |
37 |
40,2 |
7 |
7,6 |
|||
|
FU 2 |
92 |
51 |
53,3 |
36 |
39,1 |
5 |
5,4 |
|||
|
FU 3 |
87 |
52 |
59,8 |
27 |
31,1 |
8 |
9,1 |
|||
|
Abschluss |
96 |
55 |
57,9 |
31 |
32,6 |
9 |
9,5 |
|||
Zum Ende der Untersuchung war bei insgesamt 55 Patienten eine Verbesserung, bei 31 keine Veränderung sowie bei 9 eine Verschlechterung des Zustands eingetreten (von einem Patienten waren keine Follow-up-Daten verfügbar). Die Verbesserung war signifikant (p<0,0001). Eine Stratifizierung nach den eingesetzten Flupentixoldecanoat-Dosierungen ergab, dass sich die meisten Patienten unter einer Dosierung zwischen 2 und 5 mg verbesserten (Abb. 6). Die Patienten ohne Zustandsbesserung oder mit einer Verschlechterung wurden durchgängig mit höheren Dosierungen behandelt, vermutlich in dem Versuch, doch noch eine Response zu erreichen.
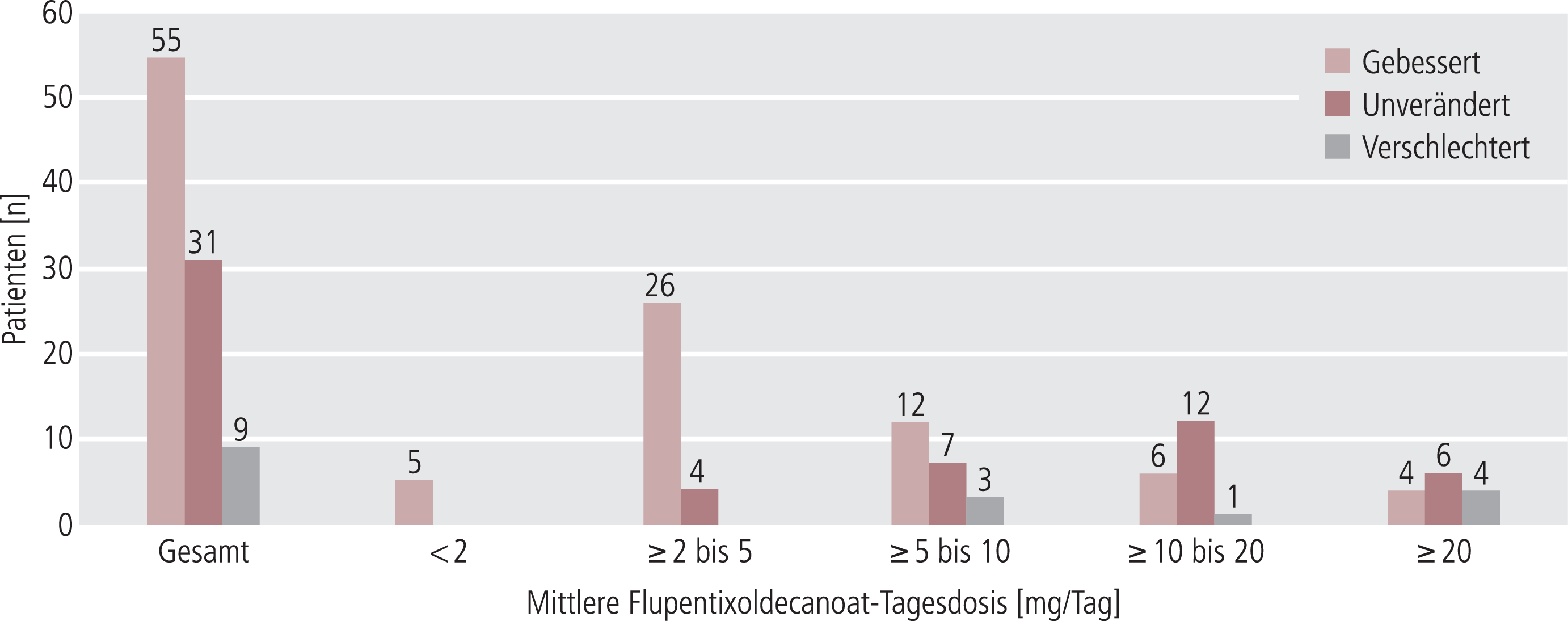
Abb. 6. Klinischer Gesamteindruck (CGI): Veränderung bei der Abschlussvisite
Patientenbefragung zum Gesundheitszustand und subjektiven Wohlbefinden
Gemäß VAS fand sich im Mittel eine signifikante Verbesserung des Gesundheitszustandes um 15,6 Punkte (p<0,0001) (Abb. 7).
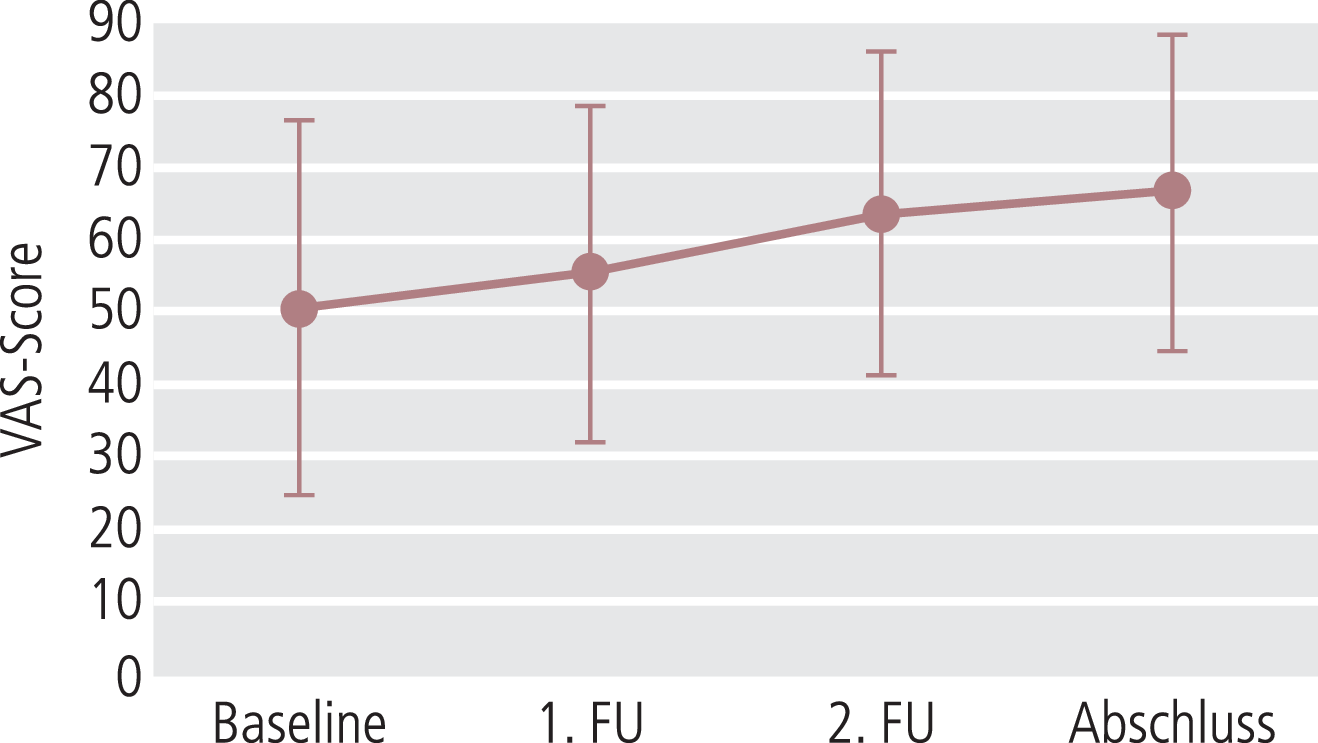
Abb. 7. Patientenfragebogen zum Gesundheitszustand im Verlauf (VAS; Mittelwerte ± SD); p<0,0001
Das subjektive Wohlbefinden, gemessen mit dem SWN-K, veränderte sich im Studienverlauf nicht. Der Skalenwert betrug zu Beginn 65,4 Punkte und blieb im Verlauf in einem Bereich zwischen 64,1 und 64,9 (nicht gezeigt).
Abschlussbeurteilung durch die behandelnden Ärzte
Bei 70 Patienten wurde die Wirksamkeit der Medikation generell als sehr gut bis gut beurteilt, bei 19 als ausreichend und bei 6 als ungenügend. Die Verträglichkeit bewerteten die Ärzte bei 78 Patienten als sehr gut und gut, bei 16 Patienten als ausreichend und bei 6 als ungenügend.
Die Compliance wurde durch die Ärzte wie folgt beurteilt: bei n=75 als sehr gut oder gut, bei n=14 als ausreichend und bei n=5 als ungenügend (Abb. 8). Die Compliance scheint somit in einem engen Zusammenhang mit der Wirksamkeit und Verträglichkeit und vice versa zu stehen.
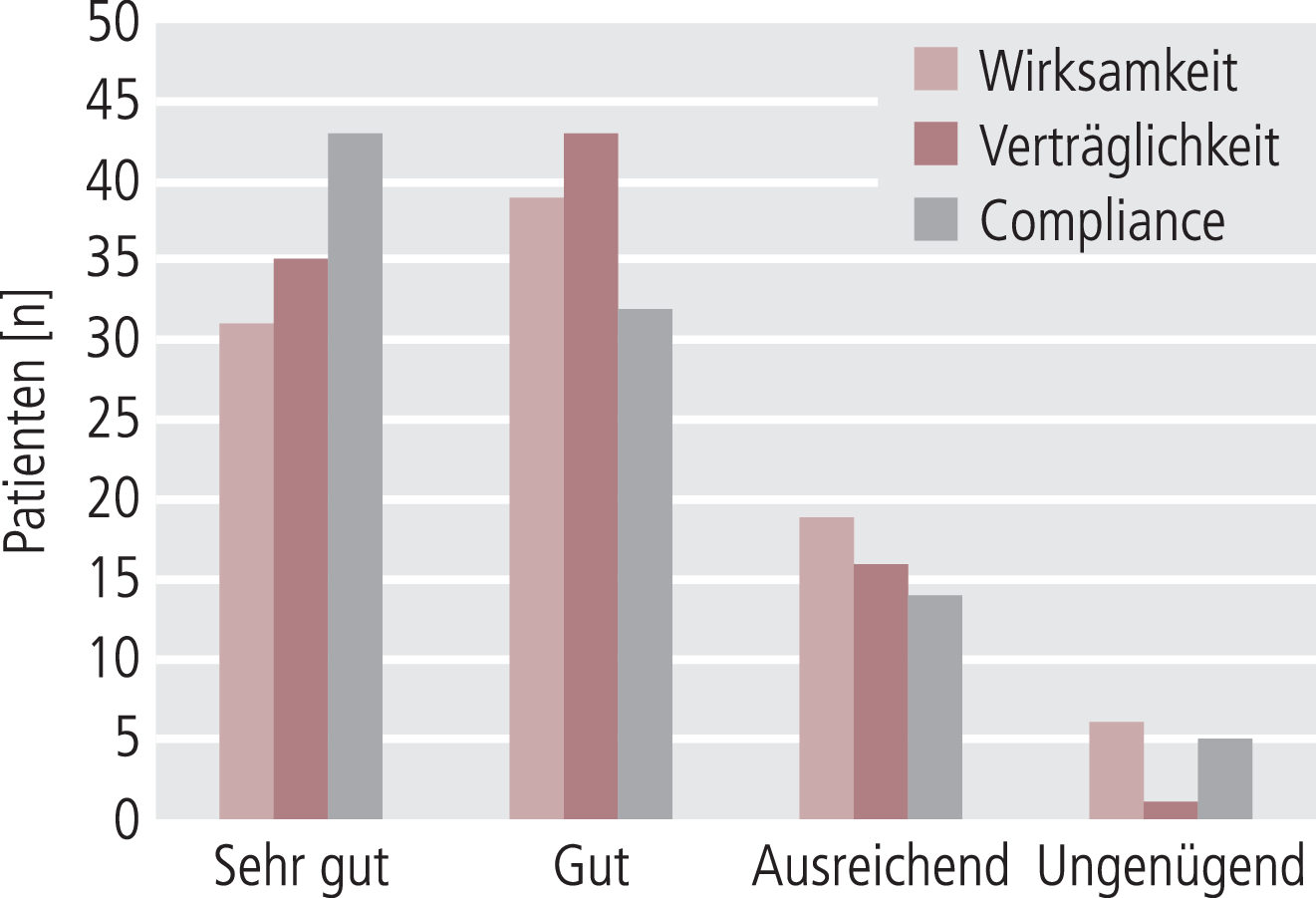
Abb. 8. Abschlussbeurteilung durch den Arzt
Bei 83 Patienten gaben die Ärzte an, die Behandlung mit Flupentixoldecanoat fortführen zu wollen, bei 67 Patienten mit Flupentixoldecanoat 2% und bei 11 Patienten mit Flupentixoldecanoat 10%; bei fünf Patienten sollte die Behandlung mit der oralen Darreichungsform fortgeführt werden. Als Gründe für die Beendigung der Therapie mit Flupentixoldecanoat (n=12) gaben die Ärzte vorwiegend ungenügende Compliance (n=6), unzureichende Wirksamkeit (n=4) und Nebenwirkungen (n=3) an (Mehrfachnennungen möglich).
Zum Ende der Verlaufsbeobachtung hatte ein weiterer Patient seine Berufstätigkeit aufgegeben. Vier Patienten, die zu Beginn noch Selbstversorger waren, wechselten zu betreutem Wohnen (siehe Tab. 4).
Verträglichkeit und Sicherheit
Unerwünschte Ereignisse
Patientenbezogen. Innerhalb der Beobachtungsstudie wurden bei 15 Patienten unerwünschte Ereignisse dokumentiert. Diese wurden bei sechs Patienten der Therapie mit Flupentixoldecanoat kausal zugeordnet und bei sieben nicht; bei zwei Patienten konnte keine Entscheidung über die Kausalität zur Medikation getroffen werden. Bei einem Großteil der Patienten (n=12) konnten die unerwünschten Ereignisse durch ärztliche Behandlung gebessert werden, nur bei einem verbesserte sich der Zustand nicht. Die restlichen blieben unverändert.
Sechs Patienten wurden aufgrund schwerer unerwünschter Ereignisse hospitalisiert. Ursachen hierfür waren in zwei Fällen Alkoholvergiftungen, in einem Fall eine vorbestehende Psoriasis und in den anderen Fällen psychiatrische Störungen.
Diese Hospitalisierungen standen nicht in Zusammenhang mit der Medikation.
Nebenwirkungsbezogen. Insgesamt wurden 26 unerwünschte Ereignisse (AEs) dokumentiert, wovon 11 als schwerwiegend und 14 als leicht beurteilt wurden (zu einem AE lag keine Angabe vor). Bei den 11 als schwerwiegend eingestuften unerwünschten Ereignissen kam es zur Hospitalisierung, sie standen jedoch nicht in kausalem Zusammenhang mit der Flupentixoldecanoat-Therapie. Bei den angegebenen leichten unerwünschten Ereignissen handelte es sich um muskuloskeletale (z.B. Muskelspasmen, Myalgie), extrapyramidal-motorische (Tremor, Parkinsonismus) und psychiatrische (z.B. Depression, Halluzinationen, Schlafstörungen) Symptome.
Sonstige Verträglichkeitsparameter
Extrapyramidale Symptomatik
Der mittlere EPS-Score lag bei Start der nichtinterventionellen Studie bei 3,1±3,7 Punkten in der Simpson-Angus-Skala und veränderte sich nicht wesentlich während der 24 Wochen Beobachtungsdauer (Abb. 9). Damit beträgt der Schweregrad 0,3 und ist als minimal zu beurteilen.
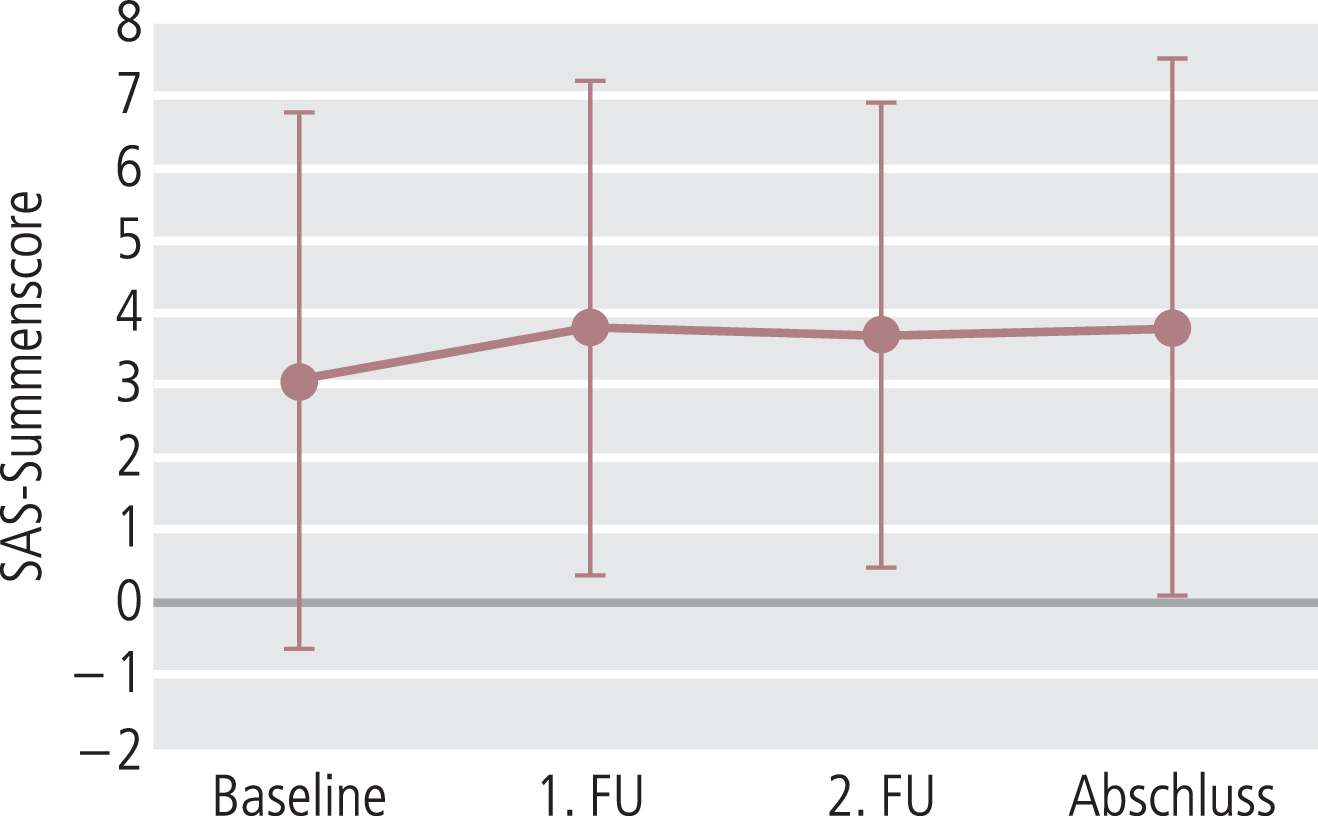
Abb. 9. Extrapyramidal-motorische Symptome: Summenscore der Simpson-Angus-Skala (SAS; Mittelwert ± SD)
Körpergewicht
Das Körpergewicht aller Patienten lag zu Studienbeginn, sowohl bei Männern als auch bei Frauen, um 80 kg. Entsprechend hoch war daher auch der mittlere BMI (28,0±5,7). Gewicht und BMI blieben während der Behandlung unabhängig vom Geschlecht des Patienten und der Dosierung von Flupentixoldecanoat stabil (Abb. 10).
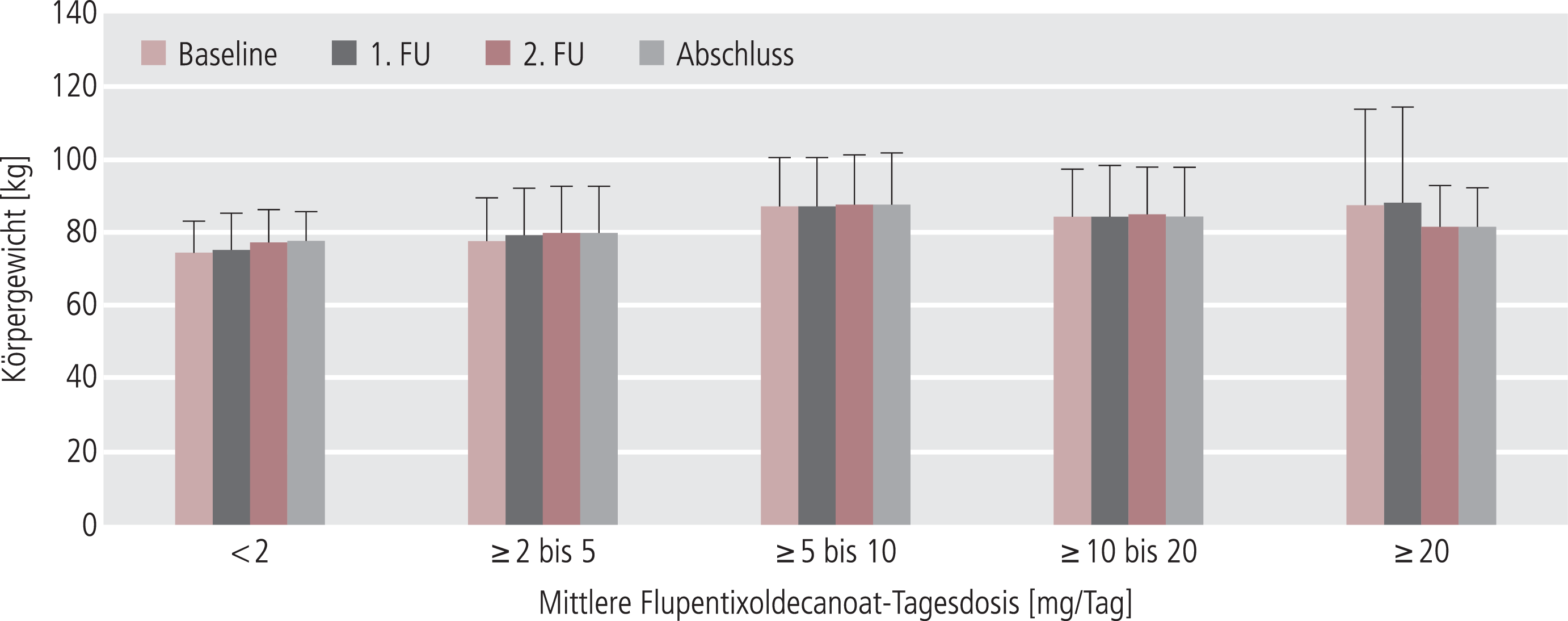
Abb. 10. Mittleres Körpergewicht (+ SD) in Abhängigkeit von der Flupentixoldecanoat-Tagesdosis im Studienverlauf (24 Wochen); FU: Folgeuntersuchung
Diskussion
Flupentixol ist ein Erstgenerations-Antipsychotikum, das in oraler Form wie auch als lang wirksames Depot seit mehr als vier Jahrzehnten auf dem Markt ist. In den 1960er bis1980er Jahren wurde Flupentixol in einer Vielzahl klinischer Studien in diversen psychiatrischen Indikationen untersucht [12, 34]. Seitdem hat die Zahl der mit Flupentixol durchgeführten Studien kontinuierlich abgenommen. Bei schizophrenen Erkrankungen sind jedoch einige wenige heutigem Qualitätsstandard entsprechende Studien durchgeführt worden [15]. Aufgrund der hohen Kosten für solche Studien ist die Bereitschaft, mit „alten Substanzen“, wie beispielsweise einem Erstgenerations-Antipsychotikum, derartige Studien durchzuführen, im Allgemeinen gering. Daher stellen nichtinterventionelle Beobachtungsstudien (NIS) eine wichtige Ergänzung zu kontrollierten klinischen Studien dar. NIS wie die vorliegende (früher als Anwendungsbeobachtungen bezeichnet) sind aufgrund ihres methodischen Designs, dem Fehlen von Randomisierung, Kontrollgruppe und Doppelblind-Design nicht geeignet, Aussagen zu klinischer Wirksamkeit zu belegen. Die Ergebnisse derartiger Studien sind daher anders zu bewerten als die Ergebnisse kontrollierter Studien. Die Stärke der NIS liegt darin, dass standardisierte Daten aus der täglichen klinischen Praxis zu unselektierten, „normalen“ Patienten gewonnen werden können, die zur Bewertung von Wirksamkeit und Verträglichkeit einer Substanz beitragen [31].
Compliance
In der vorliegenden Studie wurden Patienten dokumentiert, die über 24 Wochen mit Flupentixoldecanoat behandelt wurden. Nur 12 Patienten (12,5%) beendeten die Studie vorzeitig. Diese Abbruchquote ist damit niedriger als diejenigen, die in Anwendungsbeobachtungen zu Ziprasidon (17%, [37]), in der CATIE-Studie (etwa 30%, [30]) oder in klinischen Studien [51] gefunden wurden. Die Spanne der Abbruchquote bei vergleichbaren Studien mit Zweitgenerations-Antipsychotika ist breit und reicht von 12,5% nach sechs Monaten in der SOHO-Studie mit Olanzapin und anderen Zweitgenerations-Antipsychotika [27] bis zu 40,5% für Aripiprazol [23]. Zu der vergleichsweise niedrigen Abbruchrate in unserer Studie könnten verschiedene Faktoren beigetragen haben. So wurde zum einen Flupentixol als Depotformulierung verabreicht, was zu einer Verbesserung der Compliance beigetragen haben könnte. In mehreren Studien konnte gezeigt werden, dass die Gabe eines Antipsychotikums in Depotform im Vergleich zu oraler Verabreichung zu einer verbesserten Compliance führt [1, 17, 51]. Des Weiteren wurden keine akuten, sondern chronisch schizophrene Patienten evaluiert, die zum größten Teil bereits antipsychotische Medikation erhielten, davon etwa 33% Flupentixol, bevorzugt als Depot, etwa 27% ein Zweitgenerations-Antipsychotikum und 6% eine Kombination von beiden. Warum die Patienten von der bestehenden Medikation auf Flupentixoldecanoat umgestellt wurden, ist nicht erfasst worden. Dennoch liegt die Vermutung nahe, dass die Patienten bereits vor Einschluss in die NIS eine relativ gute Compliance besaßen. Andererseits waren hauptsächlich mangelnde Compliance (50%) und ungenügende Wirksamkeit (33%) Gründe für einen vorzeitigen Abbruch. Ähnliche Quoten wurden auch in anderen vergleichbaren Studien gefunden [37].
Dosierung
Die mittlere Dosis von Flupentixoldecanoat ist in guter Übereinstimmung mit Befunden aus klinischen Studien, bei denen eine mittlere Dosis von 20 bis 40 mg in zwei Wochen [19] bzw. 20 mg in zwei Wochen [42] empfohlen wird. In unserer Studie war das mittlere Injektionsintervall mit 19,3 Tagen jedoch deutlich länger als in den genannten Studien, was zu niedrigeren mittleren (kalkulierten) Tagesdosen von Flupentixol führte. Dennoch war die Rezidivquote mit 14,6% nominell niedriger als in der MARS-Studie (Multizentrische ambulante Rezidivprophylaxe schizophrener Patienten) [42], in der die rezidivprophylaktische Wirksamkeit von 10 mg (Rezidivrate 31,6%), 20 mg (24%) und einer freien Dosierung (im Mittel 22,4 mg; 16,7%) Flupentixoldecanoat untersucht wurde.
Charakteristisch für die in unserer Studie untersuchten Patienten ist auch eine (relativ) stabile und (relativ) niedrige Dosierung von Flupentixoldecanoat, verbunden mit einer guten Compliance. Im Mittel erhielt jeder Patient 10,4 (Median 11) Injektionen bei einem mittleren Injektionsintervall von 19,3 (Median 19,2) Tagen. Daraus ergibt sich, dass ein Patient im Mittel bei voller (= 100%) Compliance mindesten acht Injektionen erhielt. Mindestens acht oder mehr Injektionen (bei kürzeren [Injektions-]Intervallen) erhielten 80 Patienten. Das bedeutet, dass die überwiegende Mehrheit der Patienten compliant war. Dies bestätigt auch die globale Beurteilung der Compliance als sehr gut und gut bei 75 Patienten durch den behandelnden Arzt. Damit einher geht auch die in dieser Studie beobachtete relativ niedrige vorzeitige Abbruchquote.
Klinische Beurteilung
Klinische Langzeit-Studien mit Flupentixoldecanoat, die zeigen, dass die Depotform besonders für die Rezidivprophylaxe geeignet ist, wurden vorwiegend in den 1970er und 1980er Jahren durchgeführt, einige wenige in den 1990er Jahren [12, 34]. Die vorliegende Studie mit einer Beobachtungszeit von 24 Wochen bestätigt erneut, dass Flupentixoldecanoat, insbesondere das dafür zugelassene Flupentixoldecanoat 2%, ein wirksames, gut verträgliches und gewichtsneutrales Antipsychotikum für die Langzeitbehandlung und Rezidivprophylaxe schizophrener Patienten darstellt. Die klinische Beurteilung erfolgte mit Hilfe des CGI, der eine subjektive Einschätzung des Krankheitszustands durch den behandelnden Arzt wiedergibt. Danach waren insgesamt 55 Patienten am Studienende gebessert, 31 unverändert, 8 leicht und einer stark verschlechtert. Zu einem ähnlichen Ergebnis kommt die globale Abschlussbeurteilung von Wirksamkeit, Verträglichkeit und Compliance durch den Arzt. Diese Beurteilung ist wie auch der CGI nicht operationalisiert, sondern stellt vielmehr eine allgemeine und subjektive Beurteilung des Patienten dar. Die Aussagekraft dieser Ergebnisse mag dadurch einerseits limitiert sein, spiegelt andererseits aber die Behandlungsrealität im klinischen Alltag wider. Unterstützt werden diese Befunde durch die statistisch signifikante Abnahme des BPRS-Scores im Verlauf der Studie. Dementsprechend gibt es eine schwache (r=0,34) aber signifikante Korrelation zwischen CGI und BPRS.
Wohlbefinden
Die Verbesserung des psychopathologischen Zustands gemäß BPRS geht einher mit einem mittels der VAS erfassten signifikanten Anstieg des subjektiven Wohlbefindens (Korrelation r=0,54). Dieser Befund ist in guter Übereinstimmung mit den Ergebnissen aus einer kontrollierten, doppelblinden Vergleichsstudie mit Risperidon, die zum einen einen Anstieg in der allgemeinen Lebensqualität zeigen, zum anderen aber auch eine größere Zufriedenheit der Patienten mit der Flupentixol-Behandlung als mit der Risperidon-Behandlung [18, 43]. Der mittlere Summenscore des SWN-K veränderte sich im Studienverlauf hingegen nicht. Der Wert von etwa 65 (von maximal 120) deutet auf eine mittelgute Lebensqualität hin und liegt damit in Relation etwas niedriger als der VAS-Wert am Studienende (67 von 100). Dieser Unterschied mag dadurch erklärbar sein, dass mit der VAS ein momentaner Zustand spontan erfasst wird, während der SWN-K-Fragebogen mehr operationalisiert ist und damit den Zustand objektiver abbildet. Die Studienpopulation in der vorliegenden NIS bestand aus chronisch schizophrenen Patienten, die sowohl eine lange Krankheitsdauer aufwiesen als auch schon lange antipsychotisch behandelt wurden, viele davon mit Flupentixoldecanoat. Daher sind – anders als bei jüngeren und/oder kürzer erkrankten Patienten – keine großen Veränderungen in der Lebensqualität über einem Zeitraum von 24 Wochen zu erwarten. Die generelle Zufriedenheit der Mehrheit der Patienten mit der Therapie mit Flupentixoldecanoat zeigt sich darin, dass 82 von ihnen (85,4%) die Behandlung nach Ende der Studie fortsetzen wollten. Ebenfalls als krankheitsimmanent könnte – in Anbetracht des hohen Anteils an mit Flupentixol vorbehandelten Patienten – die klinisch-psychopathologische Besserung im Sinne eines Interventionsartefakts oder Spontanverlaufs interpretiert werden.
Verträglichkeit
Die dokumentierten unerwünschten Ereignisse unserer Studie entsprachen in Art und Schweregrad der Symptome dem für Flupentixoldecanoat bekannten Spektrum. Insgesamt wurde die Verträglichkeit als gut bewertet. Bei 15 Patienten wurden insgesamt 26 unerwünschte Ereignisse berichtet, 10 von ihnen im Zusammenhang mit der Flupentixoldecanoat-Behandlung. Bei drei Patienten wurde jeweils ein extrapyramidales Symptom berichtet, ein Ereignis (Agitation) stand im Zusammenhang mit der psychischen Grunderkrankung. Elf der unerwünschten Ereignisse wurden als schwerwiegend, aber nicht als durch Flupentixoldecanoat verursacht eingestuft. Diese schwerwiegenden unerwünschten Ereignisse waren Hospitalisierungen aufgrund einer psychotischen Symptomatik beziehungsweise einer dermatologischen Symptomatik und einer Suchtproblematik.
Der mittlere Summenscore der Simpson-Angus-Skala zur Erfassung von EPMS betrug bei Studienbeginn 3,1±3,7 und blieb im Verlauf konstant. Extrapyramidal-motorische Symptomatik ist gemäß der verwendeten Skala daher als nicht vorhanden bis minimal zu bewerten. Dieser Befund wird dadurch unterstützt, dass sich der Anteil von Patienten, der vor Studienbeginn eine anticholinerge Begleitmedikation erhielt (25%), im Studienverlauf nicht veränderte. Die gute extrapyramidal-motorische Verträglichkeit von Flupentixol, die sich bereits in klinischen Studien gezeigt hat [13, 43], wird hierdurch bestätigt. Es ist zu vermuten, dass die in der Studie verwendete niedrige mittlere Dosierung und das verlängerte Injektionsintervall (s. o.) dazu beigetragen haben.
Mono- und Kombinationstherapie
Obwohl die gültigen Therapiestandards für die pharmakologische Behandlung schizophrener Patienten eine Monotherapie empfehlen, wurden von den 96 an der Studie teilnehmenden Patienten nur 17 mit Flupentixoldecanoat als alleiniger Medikation behandelt. Alle anderen (n=79) erhielten bis zu 11 Begleitmedikamente, die meisten davon entweder eines (n=24) oder zwei (n=22). Mehr als die Hälfte der Patienten mit Begleitmedikation bekamen ein weiteres Antipsychotikum, in vielen Fällen ein niederpotentes Neuroleptikum, 15 davon ein Zweitgenerations-Antipsychotikum. Dies bestätigt einen auch in anderen „Real-life“-Untersuchungen beobachteten Trend hin zu einer antipsychotischen Kombinationstherapie. Die Ergebnisse von Metaanalysen kontrollierter klinischer Studien weisen auf eine überlegene antipsychotische Wirksamkeit der Kombination aus Erst- und Zweitgenerations-Antipsychotika gegenüber einer Monotherapie mit einem Erstgenerations-Antipsychotikum oder Zweitgenerations-Antipsychotikum hin, vor allem bei schwerer erkrankten Patienten [35]. Der Anteil der Patienten, die neben Flupentixoldecanoat ein weiteres Antipsychotikum erhielten, ist mit 45% in der vorliegenden Studie höher als in den Untersuchungen von Kühn et al. (23,4%, [26]) und Messer et al. (28,1%, [33]). Dieser Unterschied könnte dadurch erklärt werden, dass zum einen in den beiden letztgenannten Studien die Patienten von einer Olanzapin- oder Risperidon-Vormedikation auf eine Therapie mit Flupentixol umgestellt wurden und daher Kombinationen mit einem dieser beiden Zweitgenerations-Antipsychotika selten oder nicht vorkamen. Zum anderen waren zum Zeitpunkt der Durchführung dieser beiden Studien andere Zweitgenerations-Antipsychotika wie beispielsweise Quetiapin noch nicht lange oder noch gar nicht eingeführt, so dass Kombinationen mit diesen Zweitgenerations-Antipsychotika (noch) nicht üblich oder möglich waren.
Fazit
Die Ergebnisse der vorliegenden nichtinterventionellen Studie zu Flupentixoldecanoat bestätigen das aus den früheren und den wenigen neueren klinischen Studien bekannte Wirkungs- und Nebenwirkungsprofil von Flupentixol. Seine antipsychotische Wirksamkeit, die gute extrapyramidal-motorische Verträglichkeit und seine im Vergleich zu einigen Zweitgenerations-Antipsychotika vorhandenen Vorteile hinsichtlich Körpergewicht und metabolischem Syndrom machen Flupentixol zu einer auch unter ökonomischen Aspekten pharmakotherapeutischen Option im Spektrum der verfügbaren Antipsychotika zur Behandlung schizophrener Störungen. Als Depot (Flupentixoldecanoat) kommt es insbesondere für Patienten in Frage, für die aufgrund des Schweregrads ihrer Erkrankung und unzureichender Compliance ein langwirksames Antipsychotikum indiziert ist, das dazu beiträgt, die Therapietreue zu verbessern und damit das Risiko eines Rückfalls zu verringern.
Danksagung
Allen beteiligten Zentren, die zum Erfolg dieser Studie beigetragen haben, sei an dieser Stelle herzlich gedankt. Beteiligt waren:
Bezirkskrankenhaus Augsburg (Priv.-Doz. Dr. T. Messer), Klinikum Garmisch-Partenkirchen (Dr. J. Scherer), Bezirkskrankenhaus Landshut (Dr. E. Hausmann), Klinikum Elisabeth Herzberge, Berlin (Dr. U. Golombek), Asklepios Klinikum Teupitz (Prof. S. Kropp), Isar-Amper Klinikum Taufkirchen (Dr. S. Apelt), Praxis Dr. G. Roth, Ostfildern, Praxis Dr. F. v. Zitzewitz, Ludwigshafen, Praxis Dr. L. Saxer-Novotny, Wien.
Literatur
1. Adams CE, Fenton MK, Quraishi S, David AS. Systematic meta-review of depot antipsychotic drugs for people with schizophrenia. Br J Psychiatry 2001;179:290–9.
2. Ciranni MA, Kearney TE, Olson KR. Comparing acute toxicity of first- and second-generation antipsychotic drugs: a 10-year, retrospective cohort study. J Clin Psychiatry 2009;70:122–9.
3. Correll CU, Frederickson AM, Kane JM, Manu P. Metabolic syndrome and the risk of coronary heart disease in 367 patients treated with second-generation antipsychotic drugs. J Clin Psychiatry 2006;67:575–83.
4. Correll CU, Rummel-Kluge C, Corves C, Kane JM, et al. Antipsychotic combinations vs. monotherapy in schizophrenia: a meta-analysis of randomized controlled trials. Schizophr Bull 2009;35:443–57.
5. Davis JM, Chen N, Glick ID. A meta-analysis of the efficacy of second-generation antipsychotics. Arch Gen Psychiatry 2003;60:553–64.
6. Davies LM, Lewis PB, Jones TR, Barnes F, et al. Cost-effectiveness of first vs. second generation antipsychotic drugs: results from a randomized controlled trial in schizophrenia responding poorly to previous therapy. Br J Psychiatry 2007;191:14–22.
7. De Hert M, Dekker JM, Wood D, Kahl KG, et al. Eine Konsensus-Erklärung der European Psychiatric Association (EPA) zu kardiovaskulären Erkrankungen und Diabetes bei Patienten mit einer schweren psychischen Erkrankung. Psychopharmakotherapie 2010;17:3–13.
8. Dose M, Glaser T, Weinmüller B. Treating schizophrenia patients with antipsychotics in a naturalistic setting: A retrospective chart review. Psychiatrie 2008;12:197–200.
9. Drici MD, Priori S. Cardiovascular risks of atypical antipsychotic drug treatment. Pharmacoepidemiol Drug Saf 2007;16:882–90.
10. Fischer-Barnicol D, Lanquillon S, Haen E, Zöfel P, et al. Typical and atypical antipsychotics – the misleading dichotomy. Neuropsychobiology 2008;57:80–7.
11. Gaebel W, Riesbeck M, Kanssen B, et al. Atypical and typical neuroleptics in acute schizophrenia and related delusional disorders: drug choice, switching, and outcome under naturalistic treatment conditions. Eur Arch Psychiatry Clin Neurosci 2003;253:175–84.
12. Gartenmaier A, Gaese F, Soyka M. Effizienz von Flupentixol bei schizophrenen Erkrankungen. In: Glaser T, Soyka M (Hrsg.). Flupentixol – Typisches oder atypisches Wirkspektrum? Darmstadt: Steinkopff Verlag, 1998:35–65.
13. Gattaz WF, Geuppert MS, Hubrich P, Schmitt A, et al. Olanzapin versus flupentixol in the treatment of inpatients with schizophrenia: a randomized double-blind trial. Pharmacopsychiatry 2004;37:279–85.
14. Geddes J, Freemantle N, Harrison P, Bebbington P. Atypical antipsychotics in the treatment of schizophrenia: systematic overview and meta-regression analysis. Br Med J 2000;321:1371–6.
15. Glaser T. Vergleichsstudien von Flupentixol mit Antipsychotika der 2. Generation. In: Glaser T, Messer T (Hrsg.). Flupentixol – Ein Antipsychotikum mit Zukunft. Linkenheim-Hochstetten: Aesopus Verlag, 2006:35–41.
16. Gründer G, Vernaleken I, Benkert O. Welche Eigenschaften machen ein Neuroleptikum „atypisch“? Nervenarzt 2001;72:833–43.
17. Haddad PM, Taylor M, Niaz OS. First-generation antipsychotic long-acting injections vs. oral antipsychotics in schizophrenia: systematic review of randomized controlled trials and observational studies. Br J Psychiatry 2009;195:20–8.
18. Hertling I, Philipp M, Dvorak A, Glaser T, et al. Flupentixol vs risperidone: subjective quality of life as an important factor for compliance in chronic schizophrenic patients. Neuropsychobiology 2003;47:37–46.
19. Johnson DAW, Ludlow K, Street K, Taylor RDW. Double-blind comparison of half-dose and standard-dose flupenthixol decanoate in the maintenance treatment of stabilised out-patients with schizophrenia. Br J Psychiatry 1987;151:634–8.
20. Jones PB, Barnes TRE, Davies L, Dunn G, et al. Randomized controlled trial of the effect on quality of life of second vs. first generation antipsychotic drugs in schizophrenia. Arch Gen Psychiatry 2006;63:1079–87.
21. Kahn R, Fleischhacker WW, Boter H, Davidson M, et al. Effectiveness of antipsychotic drugs in first-episode schizophrenia and schizophreniform disorder: an open randomized clinical trial. Lancet 2008;371:1085–97.
22. Karlsson J, Wallerstedt SM, Star K, Bate A, et al. Sudden cardiac death in users of second-generation antipsychotics. J Clin Psychiatry 2009;70:1725–6.
23. Kerwin R, Millet B, Herman E, Banki CM, et al. A multicenter, randomized, naturalistic, open-label study between aripiprazol and standard of care in the management of community-treated schizophrenic patients. Schizophrenia trial of aripiprazol: (STAR) study. Eur Psychiatry 2007;22:433–43.
24. Kind P. The EuroQol Instrument: an index of health-related quality of life. In: Siker B (Hrsg.). Quality of life and pharmacoeconomics in clinical trials. Philadelphia: Lippincott-Raven Publishers, 1996;191–201.
25. König W, Artmann S. Klinische Verordnung von Psychopharmaka unter naturalistischen Bedingungen. Teil I: Antipsychotika in der Behandlung schizophrener Psychosen. Psychopharmakotherapie 2011. Im Druck.
26. Kühn KU, Quednow BB, Landen H, Riedel M, et al. Lebensqualität und Therapieerfolg in der ambulanten Schizophrenie-Therapie mit Flupentixol. Eine Anwendungsbeobachtung. Fortschr Neurol Psychiat 2004;72:397–403.
27. Lambert M, Haro JM, Novick D, Edgell ET, et al. Olanzapine vs. other antipsychotics in actual out-patient settings: six month tolerability results from the European schizophrenia out-patient health outcomes study. Acta Psychiatr Scand 2005;111:232–43.
28. Leucht S, Komossa K, Rummel-Kluge C, Corves C, et al. A meta-analysis of head-to-head comparisons of second-generation antipsychotics in the treatment of schizophrenia. Am J Psychiatry 2009;166:152–63.
29. Leucht S, Corves C, Arbter D, Engel RR, et al. Second generation versus first generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet 2009;373:31–41.
30. Lieberman JA, Stroup TS, McEvoy JP, Swartz MS, et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005;353:1209–23.
31. Linden M, Baier D, Beitinger H, et al. Leitlinien zur Durchführung von Anwendungsbeobachtungen (AWB) in der Psychopharmakotherapie. Nervenarzt 1994;65:638–44.
32. McCue RE, Waheed R, Urcuyo L, Orendain G, et al. Comparative effectiveness of second-generation antipsychotics and haloperidol in acute schizophrenia. Br J Psychiatry 2006;189:433–40.
33. Messer T, Glaser T, Landen H, Schmauss M. Long-term treatment with flupentixol: results of a post-marketing surveillance study. J Psychopharmacol 2009;23:805–13.
34. Messer T, Glaser T, Schmauss M. Therapeutischer Stellenwert von Flupentixol und Flupentixoldecanoat zur Therapie schizophrener Erkrankungen. Psychopharmakotherapie 2003;10:141–50.
35. Messer T, Tiltscher C, Schmauss M. Kombinationen von Psychopharmaka. In: Riederer P, Laux G (Hrsg.). Grundlagen der Neuro-Psychopharmakologie. Ein Therapiehandbuch. Wien: Springer, 2010:425–50.
36. Möller HJ. Neue Antipsychotika nicht besser als die klassischen Neuroleptika? Psychopharmakotherapie 2005;12:233–4.
37. Möller HJ, Riedel M, Karapanagiotou-Schenkel I, Kadus W. Ergebnisse einer großen Anwendungsbeobachtungsstudie zu Ziprasidon. Psychopharmakotherapie 2008;15:11–20.
38. Naber D, Moritz S, Lamber M, Pajonk FG, et al. Improvement of schizophrenic patients’ subjective well-being under atypical antipsychotic drugs. Schizophr Res 2001;50:79–88.
39. National CGI: Clinical Global Impressions. In: Guy W, Bonato RR (Hrsg.). Manual for ECDEU Assessment Battery. 2nd rev. ed. Chevy chase, Md: National Institute of Mental Health, 1970:12.1–12.6.
40. Neuner T, Schmid R, Binder H, Hausner H, et al. Lebensqualität, Befindlichkeit unter antipsychotischer Medikation und Behandlungszufriedenheit. Psychopharmakotherapie 2009;16:114–20.
41. Overall JE, Gorham DR. The Brief Psychiatric Rating Scale. Psychol Rep 1962;10:799–81.
42. Pach J, Osterheider M, Finkbeiner T, Greger J, et al. Differentielle Dosierung von Flupentixol-Decanoat in der Rezidivprophylaxe schizophrener Psychosen. Psychopharmakotherapie 1998;5:150–5.
43. Philipp M, Lesch OM, Walter H, Patras L, et al. Wirksamkeit von Flupentixol vs. Risperidon auf die Negativsymptomatik schizophrener Patienten. Psychopharmakotherapie 2002;9:67–74.
44. Ray WA, Chung CP, Murray KT, Hall K, et al. Atypical antipsychotic drugs and the risk of sudden cardiac death. N Engl J Med 2009;360:225–35.
45. Rosenheck RA, Leslie DL, Sindelar J, Miller EA, et al. Cost-effectiveness of second-generation antipsychotics and perphenazine in a randomized trial of treatment of chronic schizophrenia. Am J Psychiatry 2006;163:2080–9.
46. Ruhrmann S, Kissling W, Lesch OM, Schmauss M, et al. Efficacy of flupentixol and risperidone in chronic schizophrenia with predominantly negative symptoms. Prog Neuropsychopharmacol Biol Psychiatry 2007;31:1012–22.
47. Sanchez P, Ojeda N, Pena J, Elizagarate E, et al. Predictors of longitudinal changes in schizophrenia: the role of processing speed. J Clin Psychiatry 2009;70:888–96.
48. Schneeweiss S, Avorn J. Antipsychotic agents and sudden cardiac death – how should we manage the risk? N Engl J Med 2009;360:294–6.
49. Schwabe U, Paffrath D (Hrsg.). Arzneiverordnungsreport 2009. Heidelberg: Springer, 2009.
50. Simpson GM, Angus JWS. Extrapyramidale Symptom-Skala. In: Collegium Internationale Psychiatriae Scalarum (Hrsg.). Internationale Skalen für Psychiatrie. 5. Auflage. Göttingen: Beltz-Test, 2005.
51. Voruganti L, Cortese L, Oyewumi L, et al. Comparative evaluation of conventional and novel antipsychotic drugs with reference to their subjective tolerability, side-effect profile and impact on quality of life. Schizophr Res 2000;43:135–45.
52. Wetzel H, Gründer G, Hillert A, Philipp M. Amisulprid versus flupentixol in schizophrenia with predominantly positive symptomatology – a double-blind controlled study comparing a selective D2-like antagonist to a mixed D1-/D2-like antagonist. Psychopharmacology 1998;137:223–32.
Prof. Dr. med. Dipl.-Psych. Gerd Laux, Dr. med. Carsten Steinmann, Inn-Salzach-Klinikum gGmbH, Gabersee 7, 83512 Wasserburg a. Inn, E-Mail: g.laux-isk@t-online.de Dr. Thomas Glaser, BayerVital GmbH, Division Bayer Schering Pharma, Medizin Neurologie, Immunologie & Ophthalmologie, Geb. K 56, 51368 Leverkusen
Long term treatment of schizophrenic psychoses with flupentixol decanoate: Results of a non-interventional study
Flupentixol decanoate (Fluanxol® Depot, FD) was evaluated in a prospective, multicenter, non-interventional study in 96 chronic schizophrenic patients over 24 weeks for effectiveness, tolerability, relapse rate and subjective well-being.
Eighty-one of the 96 patients were switched from any antipsychotic premedication to FD. The mean age was 46 (SD±11.6) years, the mean duration of illness 14.6 (10.9) years, the mean body weight 82.4 (15.5) kg. On average, the patients received 10.4 (3.3) injections with a mean injection volume of 1.5 (0.8) ml FD 2% and 1.2 (0.5) ml FD 10%. The mean injection interval was 19.3 (6.4) days. Psychopathology as evaluated with the Brief Psychiatric Rating Scale improved significantly during the course of the study. Extrapyramidal symptoms were absent or of very low intensity. The subjective well being improved (Visual analogue scale) or remained stable (Subjective wellbeing under neuroleptics, short version). According to the Clinical Global Impression at study end, the condition of n=55 patients was rated as improved, of n=31 as unchanged, and of n=9 as worsened (n=1 lost to follow-up). No changes in body weight were detected. No drug-related serious adverse events were documented. The relapse rate was 14.6%.
The study results support the notion that FD is an effective and well tolerated treatment in chronic schizophrenia.
Key words: Schizophrenia treatment, depot, flupentixol, non-interventional study
Psychopharmakotherapie 2010; 17(06)
