Ekkehard Haen, Regensburg, Edith Schneider, Bad Homburg, und Barbara Waldeck, Ingelheim*
Die Depression gehört zu den Erkrankungen, die oft eine Langzeittherapie erfordern. Dabei spielen die unerwünschten Wirkungen eines Antidepressivums – insbesondere im Hinblick auf die Lebensqualität – eine große Rolle. Aber auch zu Beginn der Behandlung ist die Verträglichkeit oft entscheidend und maßgeblich für die weitere Compliance verantwortlich, vor allem da kein sofortiger positiver Effekt auf die Depression zu erwarten ist [27].
Die Nebenwirkungen bei der Therapie mit Antidepressiva sind zum großen Teil auf die unterschiedlichen Rezeptorprofile der Substanzen zurückzuführen [27].
Aufgrund deren antagonistischer Wirkung an einer Reihe von Rezeptoren (Tab. 1) entwickeln die mit trizyklischen Antidepressiva (TZA) behandelten Patienten häufig eine breite Palette von unerwünschten Arzneimittelwirkungen (Tab. 2). Als besonders problematisch bei der Behandlung mit TZA müssen dabei neben subjektiv belastenden Nebenwirkungen wie Mundtrockenheit, Sedierung und Gewichtszunahme vor allem mögliche kardiovaskuläre Nebenwirkungen (Tab. 3) und die hohe Toxizität bei Überdosierung angesehen werden [29].
Tab. 1. Rezeptorprofil verschiedener Antidepressiva
|
Hemmung |
Antagonismus |
||||||||
|
SR |
NR |
DR |
5-HT2A |
H1 |
M1 |
α1 |
α2 |
||
|
Trizyklika (TZA) |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
α2-Antagonisten |
– |
– |
– |
+ |
+ |
– |
– |
+ |
|
|
SSRI |
+ |
– |
– |
– |
– |
– |
– |
– |
|
|
SNRI |
– |
+ |
– |
– |
– |
– |
– |
– |
|
|
SSNRI |
+ |
+ |
– |
– |
– |
– |
– |
– |
|
|
SNDRI |
– |
+ |
+ |
– |
– |
– |
– |
– |
|
SR = Serotonin-Rückaufnahme, NR = Noradrenalin-Rückaufnahme, DR = Dopamin-Rückaufnahme, 5-HT = 5-Hydroxytryptamin, H = Histaminrezeptor, M = Muskarinrezeptor, α = Alpharezeptor SSRI = selektive Serotonin-Wiederaufnahmehemmer, SNRI = selektive Noradrenalin-Wiederaufnahme- hemmer, SSNRI = selektive Serotonin- und Noradrenalin-Wiederaufnahmehemmer, SNDRI = selektive Noradrenalin- und Dopamin-Wiederaufnahmehemmer
Tab. 2. Rezeptor-vermittelte UAW
|
5-HT2-Antagonismus |
RR↓ |
|
H1-Antagonismus |
Sedierung, Appetitzunahme (KG↑) |
|
M1-Antagonismus |
Herzfrequenz↑ |
|
α1-Antagonismus |
RR↓, Schwindel, Orthostaseprobleme, Schwellung der |
|
α2-Antagonismus |
RR↑ |
RR = Blutdruck, KG = Körpergewicht
Tab. 3. Nicht Rezeptor-vermittelte erwünschte und unerwünschte Neben- wirkungen
|
Herz-/Kreislaufsystem |
|
ZNS anregende Wirkung |
|
Blutbildstörungen |
|
Leberfunktionsstörungen |
RR = Blutdruck
Die neueren – selektiven – Antidepressiva (z. B. selektive Serotonin-Wiederaufnahmehemmer [SSRI]) sind im Vergleich zu den älteren TZA deutlich sicherer und verträglicher. Sie haben sich auch bei der Behandlung von Alters- und Risikopatienten bewährt. Zu den Vorteilen der selektiven Antidepressiva zählen vor allem die geringere Toxizität sowie die geringere Beeinträchtigung kognitiv-psychomotorischer Leistungsfähigkeit (z. B. Fahrtauglichkeit) [23, 24, 26, 27, 42].
Bei einer Behandlung mit selektiven Antidepressiva brechen signifikant weniger Patienten die Behandlung aufgrund von Nebenwirkungen ab als bei TZA [2, 24].
Duloxetin
Duloxetin ist ein selektiver Serotonin- und Noradrenalin-Wiederaufnahmehemmer (SSNRI). Es hemmt die Wiederaufnahme von Serotonin (5-HT) und Noradrenalin (NA) in verschiedenen Versuchsmodellen und steigert in vivo die extrazelluläre Konzentration von 5-HT und NA im Hypothalamus und im präfrontalen Kortex der Ratte [5, 42]. Die ausgewogene hohe Bindungsaffinität zu serotonergen und noradrenergen Transportproteinen verspricht eine duale Wirkungsweise bereits von Therapiebeginn an. Duloxetin zeigt dabei keine klinisch relevante Affinität zu histaminergen, dopaminergen, cholinergen oder adrenergen Rezeptoren [10, 19, 36].
Duloxetin zeichnet sich durch eine gute Wirksamkeit auf die psychischen und körperlichen Symptome der Depression aus, insbesondere auf Schmerzen im Rahmen der depressiven Erkrankung [11, 14]. Pfadanalysen zeigten, dass die analgetische Wirkung bei depressiven Patienten etwa zur Hälfte durch eine von der psychischen Besserung des Patienten unabhängige, direkte analgetische Wirkung zu erklären ist [11, 34]. Die direkte analgetische Wirkung von Duloxetin wird bestätigt durch die signifikante Schmerzreduktion bei nicht depressiven Patienten, die Duloxetin zur Behandlung ihrer Schmerzen im Rahmen einer diabetischen Polyneuropathie [11] oder Fibromyalgie [3] erhielten.
Duloxetin ist zur Behandlung von depressiven Episoden und zur Behandlung von Schmerzen bei diabetischer Polyneuropathie zugelassen.
Die Sicherheit und Verträglichkeit von Duloxetin wurde in unterschiedlichen Dosen (bei Patienten bis zu 120 mg/d) in Plazebo-kontrollierten und aktiven Vergleichsstudien sowie offenen Kurz- und Langzeitstudien untersucht. Darüber hinaus werden neue Daten und Spontanberichte nach der Markteinführung in die Bewertung der Verträglichkeit einbezogen.
Die Verträglichkeit von Duloxetin ist mit den neueren selektiv wirksamen Substanzen vergleichbar [9]. Im Gegensatz zu vielen älteren TZA wirkt Duloxetin nicht sedierend [4]. Es konnten keine signifikanten Unterschiede zwischen Männern und Frauen bezüglich des Auftretens von Nebenwirkungen gefunden werden [40]. Auch in höherem Alter (≥ 65) ist die Verträglichkeit vergleichbar zu jüngeren Patienten (18–64 Jahre) [47]; eine Dosisanpassung nur aufgrund des Alters ist nicht erforderlich. Eine Behandlung dieser Patientengruppe mit der Maximaldosis (120 mg/d) sollte jedoch mit Vorsicht erfolgen, da hierfür nur begrenzte Daten vorliegen [10].
Häufigste unerwünschte Wirkungen
Bei den modernen Antidepressiva werden vor allem serotonerge und/oder noradrenerge Nebenwirkungen beobachtet (Tab. 4). Ein Großteil der unerwünschten Wirkungen tritt in der Anfangsphase auf und klingt im Verlauf der Behandlung ab.
Tab. 4. Neurotransmitter-Wiederaufnahme-vermittelte UAW
|
Serotonin-Wiederaufnahmehemmung |
Übelkeit, Erbrechen, Unruhe, Schlafstörungen, eventuell |
|
Noradrenalin-Wiederaufnahmehemmung |
Verstärkung des sympathischen Tonus: |
|
Dopamin-Wiederaufnahmehemmung |
Übelkeit, Erbrechen |
Die gepoolten Daten von acht Plazebokontrollierten Studien bei depressiven Patienten zeigten, dass Übelkeit, Mundtrockenheit, Verstopfung, Schlaflosigkeit, Schwindel, Kopfschmerzen, Müdigkeit, Schläfrigkeit, vermehrtes Schwitzen und verminderter Appetit bei einer Duloxetin-Behandlung in einer Inzidenz ≥5% und signifikant unterschiedlich zu Plazebo auftraten [21].
Eine leichte bis moderate Übelkeit wurde am häufigsten berichtet. Die Inzidenz der Übelkeit war abhängig von der Initialdosis, nicht aber von der effektiven Behandlungsdosis. Die gepoolten Daten über den Dosisbereich von 40 bis 120 mg/d ergaben eine Inzidenz von ungefähr 20% bei einer Duloxetin- Behandlung, die Inzidenz war höher in Studien, in denen die Patienten eine Startdosis von 60 mg erhielten (ca. 38%). Über 90% der Patienten beschrieben jedoch die Übelkeit als leicht oder moderat (Abb. 1) [16, 25].
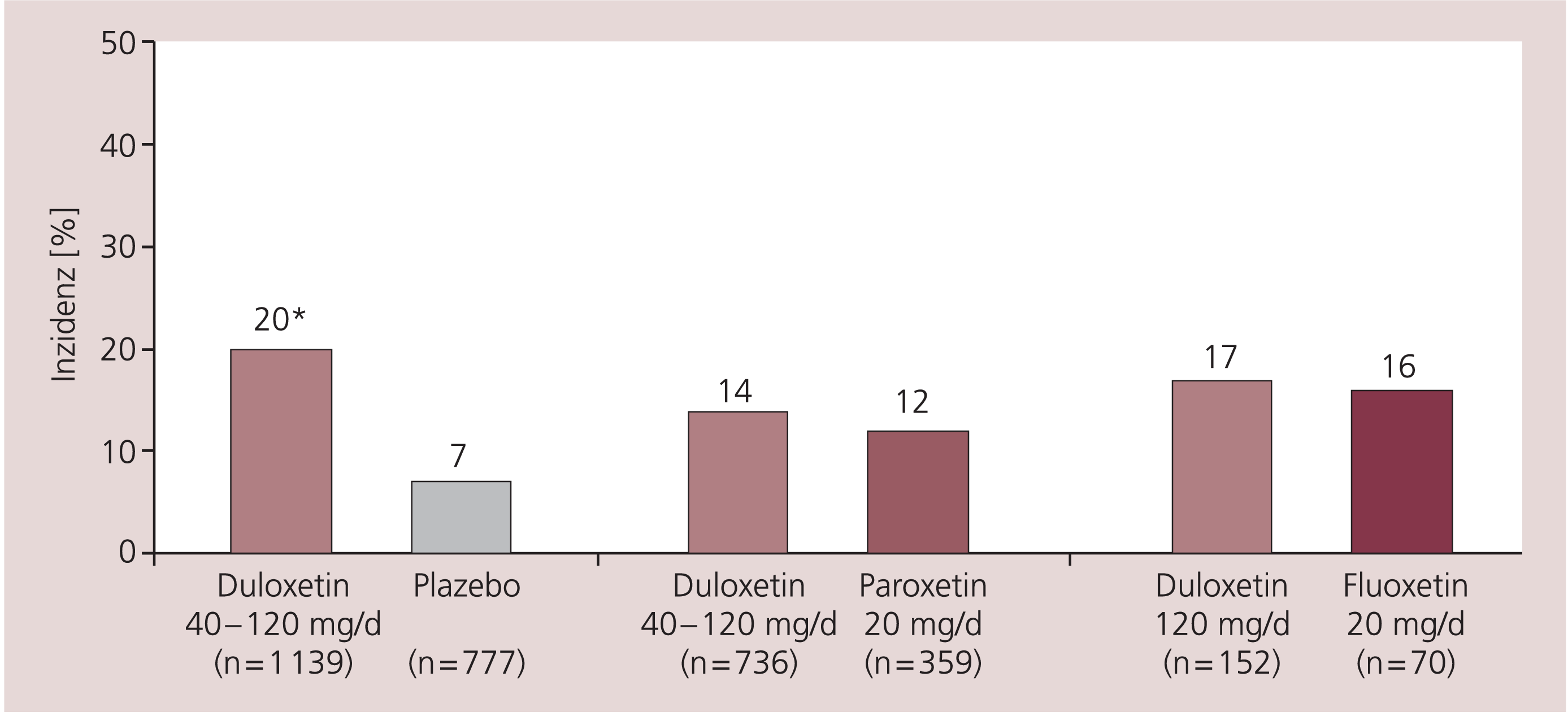
Abb. 1. Inzidenz der Übelkeit bei einer Behandlung mit 60 mg/d Duloxetin im Vergleich zu Plazebo, Paroxetin und Fluoxetin; * p<0,001 [mod. nach 16]
In der Regel trat die Übelkeit sehr früh auf (Median 1 Tag nach Einnahmebeginn) und verschwand im Verlauf der frühen Behandlungsphase wieder (mediane Dauer 7 Tage). Nach der ersten Behandlungswoche lag die Inzidenz für Übelkeit auf Plazebo-Niveau. Die Abbruchrate in klinischen Studien aufgrund von Übelkeit war dabei sehr gering (1,4%) [16]. Die Inzidenz der Übelkeit kann signifikant vermindert werden, wenn die Therapie mit einer geringeren Dosis begonnen wird (30 mg/d für 1 Woche; 30 mg ist jedoch keine antidepressiv wirksame Dosierung!) [7]. Des Weiteren kann die Verträglichkeit von Duloxetin verbessert werden, wenn es zu den Mahlzeiten eingenommen wird [8].
Kardiale Verträglichkeit
Ältere Antidepressiva, wie TZA und Monoaminoxidase-(MAO-)Hemmer werden mit kardiovaskulären Nebenwirkungen in Verbindung gebracht [30]. Insbesondere QT-Intervall-Verlängerungen können die Ursache für Herzrhythmusstörungen sein, die in seltenen Fällen zum plötzlichen Herztod führen können [43]. Duloxetin besitzt ein günstiges kardiales Verträglichkeitsprofil. Präklinische (in vitro, in vivo) und klinische Untersuchungen an gesunden Freiwilligen (z.B. supratherapeutische Dosen bis 400 mg/d) zeigten keinen klinisch relevanten Einfluss von Duloxetin auf kardiovaskuläre Parameter. Im Vergleich zu Venlafaxin und TZA scheint Duloxetin ein geringeres Potenzial zu haben, Arrhythmien zu induzieren [51].
In klinischen Studien wurden durch Duloxetin keine signifikanten Verlängerungen des QTc-Intervalls festgestellt [6a, 41]; es gab keine klinisch relevanten Unterschiede bei den Messintervallen QT, PR, QRS, QTcB (Berechnung des QTc-Intervalls unter Berücksichtigung der Herzfrequenz mittels Bazett-Formel) zwischen mit Duloxetin und Plazebo behandelten Patienten [10].
Blutdruck und Puls
Eine Analyse von acht Plazebo-kontrollierten klinischen Studien zeigte im Vergleich zu Plazebo eine signifikante – klinisch nicht relevante – mittlere Erhöhung der Pulsrate (1,6/min), des systolischen (1,0 mmHg) und des diastolischen (1,1 mmHg) Blutdrucks. Es gab keine signifikanten Unterschiede bezüglich anhaltender Blutdrucksteigerungen [41, 45], auch nicht bei älteren Patienten (≥55 Jahre) [21].
Durch eine Langzeitbehandlung (1 bis 2 Jahre) kam es ebenfalls zu keinen klinisch relevanten mittleren Veränderungen der Vitalparameter; im Mittel gab es auch keinen signifikanten Unterschied bezüglich systolischem und diastolischem Blutdruck zwischen Patienten, die zu Studienbeginn hypertensiv waren, und normotensiven Patienten [35, 49]. Im Verlauf einer 52-Wochen-Studie an einer zuvor normotonen Studienpopulation wurden bei 4,4% der Patienten hypertone Blutdruckwerte gemessen, wobei sich diese Werte bei der Hälfte der Betroffenen unter Weiterführung der Duloxetin-Behandlung wieder normalisierten [35]. Im Verlauf einer 2-Jahres-Studie erfüllten keine Patienten die Kriterien für einen anhaltenden Bluthochdruck [49].
Dennoch zeigen Spontanberichte, dass Duloxetin bei einigen Patienten in Zusammenhang mit Blutdruckanstiegen und klinisch signifikantem Hypertonus stehen kann. Fälle von hypertensiven Krisen wurden berichtet, insbesondere bei Patienten mit vorbestehendem Bluthochdruck. Deshalb wird bei Patienten mit bekanntem Bluthochdruck und/oder anderen Herzerkrankungen eine angemessene Überwachung des Blutdrucks, insbesondere während des ersten Behandlungsmonats, empfohlen. Bei Patienten mit unkontrolliertem Bluthochdruck, der sie der möglichen Gefahr einer hypertensiven Krise aussetzen könnte, darf Duloxetin nicht angewendet werden [10].
Leber
Ein Anstieg von Leberenzymwerten ist eine bekannte Nebenwirkung von Duloxetin. Die mittleren und kategorialen Veränderungen waren im Allgemeinen klein und lagen innerhalb der Normwerte [13]. Es wurden jedoch auch Fälle von Leberschädigung, einschließlich schwerwiegender Erhöhung von Leberenzymwerten (>10fache Erhöhung gegenüber den Normalwerten), Hepatitis und Gelbsucht berichtet. Die meisten Fälle traten in den ersten Behandlungsmonaten auf. Die Form der Leberschädigung war überwiegend hepatozellulär. Deshalb sollte Duloxetin bei Patienten, die eine Leberschädigung haben oder die andere Arzneimittel einnehmen, die zu einer Leberschädigung führen können, mit Vorsicht angewendet werden [10].
Gewicht
Anorexie und Gewichtsabnahme sind häufig Symptome einer Depression und viele Patienten nehmen während der Remission an Gewicht zu – mit oder ohne Behandlung. Bei einer Behandlung mit TZA kommt es häufig zu Appetitsteigerung und innerhalb der ersten Behandlungsmonate bis zu einer Gewichtszunahme von 1,4 kg/Monat [27, 52]. Ähnliches gilt für Mirtazapin, für das in Studien Gewichtszunahmen von 1,5 kg in vier Wochen bei 75% der Patienten berichtet wurden [26]. SSRI können sowohl mit moderater Gewichtsabnahme als auch mit Gewichtszunahme assoziiert sein [52].
Mit Duloxetin kommt es nur bei weniger als 1% der Patienten zu einer Gewichtszunahme, häufiger wird eine Gewichtsabnahme beobachtet [10]. Eine Analyse von zehn klinischen Studien mit depressiven Patienten zeigte, dass im Mittel eine Kurzzeitbehandlung mit Duloxetin zu einer Gewichtsabnahme (–0,5 kg nach 8 bis 12 Wochen) und eine längere Therapie zu einer leichten Gewichtszunahme führte (+1,1 kg nach offener 1-jähriger Behandlung und +3,1 kg nach 2 Jahren) [35, 46, 49] (Abb. 2).
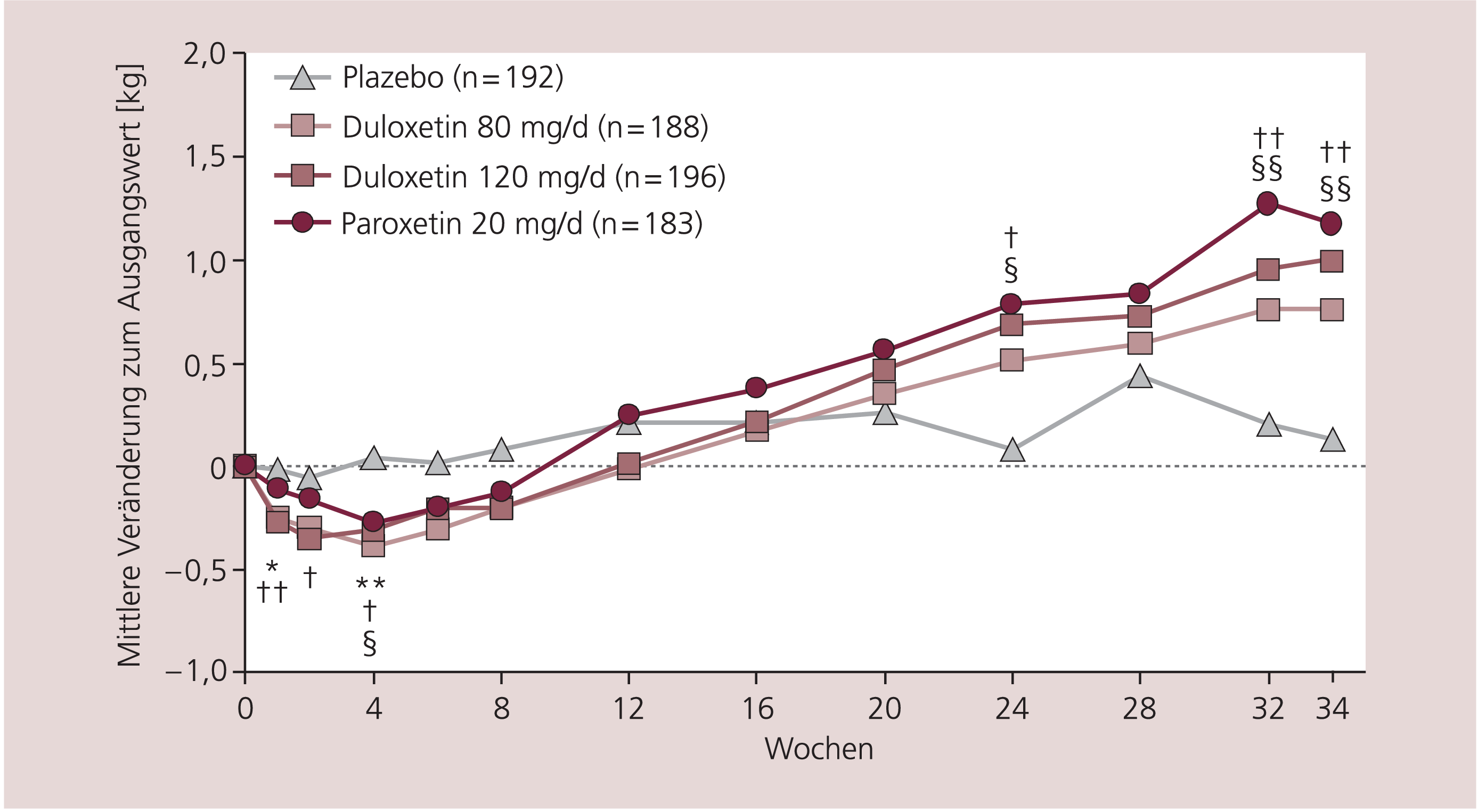
Abb. 2. Gewichtsveränderungen durch eine Duloxetin-Behandlung [mod. nach 46] */** Duloxetin 80 mg/d vs. Plazebo p ≤ 0,05/0,01, †/†† Duloxetin 120 mg/d vs. Plazebo p ≤ 0,05/0,01, §/§§ Paroxetin vs. Plazebo p ≤ 0,05/0,01
Sexuelle Funktionsstörungen
Sexuelle Funktionsstörungen (z. B. Impotenz, Ejakulations- oder Orgasmusstörungen) sind nicht nur Symptome der Depression, sondern relativ häufig auch Folge einer antidepressiven Therapie, insbesondere mit SSRI (bis zu 70% [28]). Aber auch bei TZA werden Prävalenzen bis zu 90% berichtet, wobei die Spanne sehr groß ist und Substanzen, die überwiegend noradrenerg wirken, geringere Inzidenzen aufweisen [44].
Ein direkter Vergleich ist dennoch schwierig, da diese Störungen in klinischen Studien unterschiedlich erfasst werden und viele Patienten spontan nicht darüber sprechen. Angesichts der hohen Prävalenz von sexuellen Funktionsstörungen bei der Depression per se (bis zu 70% werden berichtet) kann es schwierig sein, die sexuellen Nebenwirkungen einzelner Antidepressiva zu identifizieren und zu quantifizieren [27, 44].
In einigen Duloxetin-Studien wurde ein spezieller Fragebogen, der „Arizona Sexual Experience Scale“ (ASEX), eingesetzt, um sexuelle Funktionen genauer zu untersuchen. Die Poolanalyse zeigte, dass zu Studienbeginn bereits ungefähr 60% der depressiven Patienten an sexuellen Funktionsstörungen litten. Im Rahmen der akuten 8- bis 9-wöchigen Therapiephase entwickelten die anfangs symptomfreien Patienten in der Verum-Gruppe signifikant häufiger sexuelle Funktionsstörungen (Duloxetin: 46%, Paroxetin: 61%) als Patienten, die mit Plazebo behandelt wurden (29%). Während der Langzeitbehandlung (34 Wochen) gab es jedoch keinen signifikanten Unterschied mehr zu Plazebo [6, 21].
In einer Vergleichsstudie mit Duloxetin und Escitalopram verschlechterten sich sexuelle Funktionen bei Männern statistisch signifikant seltener (p = 0,005) mit Duloxetin (37%) im Vergleich zu Escitalopram (59%) (Abb. 3) [32].
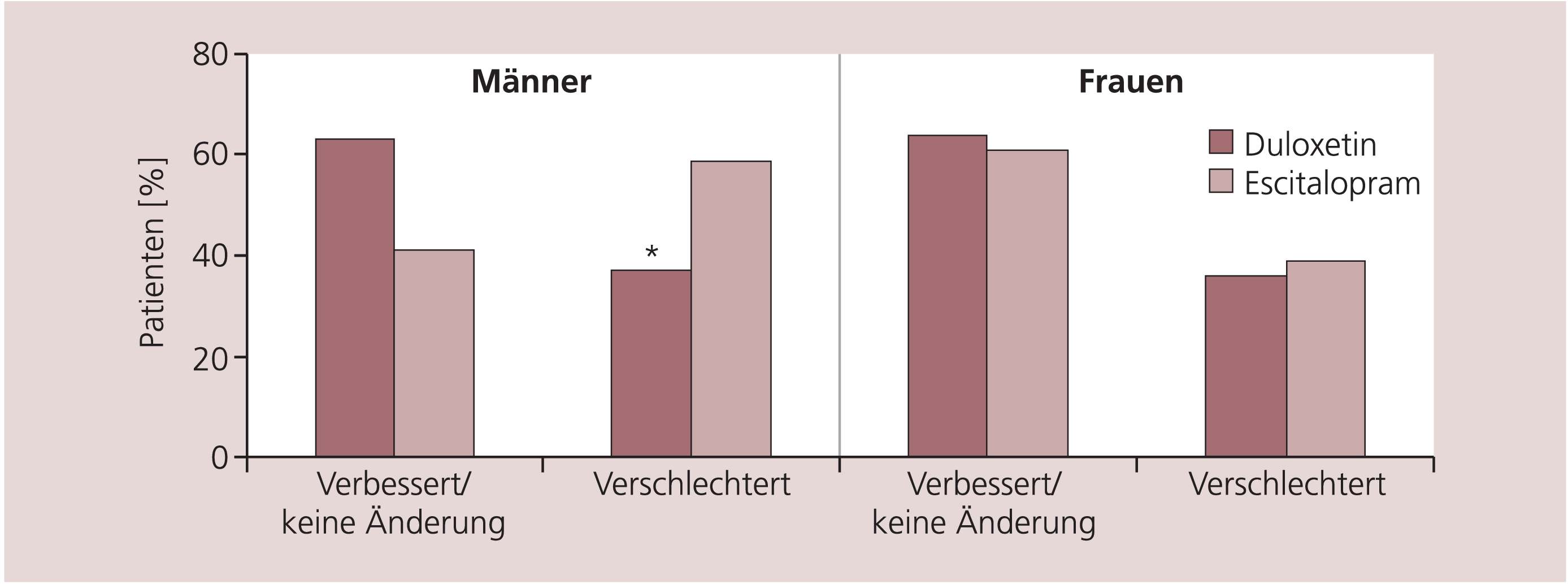
Abb. 3. Sexuelle Funktionen unter Duloxetin und Escitalopram, * p=0,005 vs. Escitalopram [mod. nach 32]
Folgende sexuelle Funktionsstörungen wurden signifikant häufiger mit Duloxetin als mit Plazebo berichtet:
● Erektile Dysfunktion 4,2% (Plazebo 0,8%)
● Verminderte Libido 2,5% (Plazebo 0,5%)
● Anorgasmie 2,2% (Plazebo 0,0%)
● Sexuelle Dysfunktion 0,7% (Plazebo 0,0%) [21]
Insgesamt scheinen sexuelle Funktionsstörungen mit Duloxetin weniger häufig aufzutreten als mit SSRI und TZA [6, 20, 32, 44].
Suizidalität
Suizidgedanken und -handlungen gehören zu den Zusatzsymptomen einer depressiven Störung; bei ungefähr 80% der depressiv Erkrankten treten Suizidgedanken auf, bei etwa 15% der Betroffenen kommt es zu einem Suizidversuch. Etwa 50% aller Suizide werden durch Depressionen verursacht. Dieses Risiko bleibt auch bei der Therapie mit einem Antidepressivum bestehen, bis eine deutliche Remission eintritt [10, 18, 38].
In den letzten Jahren wurde verstärkt diskutiert, ob Antidepressiva Suizide und Suizidversuche auslösen können. Im April 2004 warnte die europäische Arzneimittelbehörde (EMEA), dass Kinder und Jugendliche den SSRI Paroxetin wegen erhöhtem Suizidrisiko, verstärkter Feindseligkeit und fehlender Wirksamkeitsbelege nicht einnehmen sollten. Dies resultierte in internationalen Warnhinweisen in den Fach- und Gebrauchsinformationen bezüglich der Verordnung von SSRI und SSNRI an Kinder und Jugendliche.
Eine umfangreiche Analyse der FDA, die 372 Plazebo-kontrollierte Antidepressiva-Studien mit fast 100000 Patienten beinhaltete, zeigte, dass eine Antidepressiva-Therapie bei Kindern, Jugendlichen und jungen Erwachsenen (< 25 Jahre) mit einem erhöhten Risiko von Suizidgedanken und suizidalem Verhalten assoziiert ist. Gleichzeitig weist die FDA aber auch auf den neutralen oder protektiven Effekt einer antidepressiven Therapie hin, der bei älteren Erwachsenen nachgewiesen werden konnte [22].
Eine Metaanalyse von 12 Plazebo-kontrollierten Duloxetin-Studien bei depressiven Patienten zeigte keine signifikanten Unterschiede in der Inzidenz von Suizid-bezogenem Verhalten durch Duloxetin im Vergleich zu Plazebo. Die Studienergebnisse ergaben keinen Hinweis eines erhöhten Risikos von suizidalem Verhalten oder Suizidgedanken durch eine Duloxetin-Therapie. In der Tat zeigten durch die Duloxetin-Therapie mehr Patienten eine Verbesserung des Item 3 („Suizidgedanken“) des HAMD17 (Hamilton Depression Rating Scale) als eine „Verschlechterung“ im Vergleich zu Plazebo [1]. – Dennoch kann die Möglichkeit nicht ausgeschlossen werden, dass Antidepressiva im Einzelfall suizidale Phänomene induzieren, verstärken und Suizidgedanken oder suizidales Verhalten in einer Subgruppe von gefährdeten Patienten erhöhen können [12]. Dieses Phänomen ist seit langem bekannt und wurde früher darauf zurückgeführt, dass die psychomotorisch aktivierende Wirkung von Antidepressiva der depressionslösenden Wirkung vorausgehen kann [39]. Die entscheidende therapeutische Maßnahme, diesem möglichen Risiko gerecht zu werden und zu begegnen, ist die engmaschige und gezielte Begleitung des Patienten, insbesondere in der Frühphase der antidepressiven Therapie [12].
Wechselwirkungen
Die Sicherheit und Verträglichkeit einer Substanz beruhen neben ihren pharmakodynamischen auch auf ihren pharmakokinetischen Eigenschaften. Pharmakokinetische Wechselwirkungen von und mit Antidepressiva betreffen unter anderem ihren Metabolismus in der Leber durch das Cytochrom-P450(CYP)-System. In der Praxis haben dabei die inhibitorischen Eigenschaften der Wirkstoffe auf dieses Isoenzymsystem besondere Bedeutung [27].
Viele Antidepressiva werden in der Leber über CYP-Isoenzyme verstoffwechselt. Duloxetin wird durch Oxidation über die Isoenzyme CYP1A2 und CYP2D6 und anschließender Konjugation umfangreich metabolisiert. Die konjugierten Metabolite werden hauptsächlich über den Urin ausgeschieden und sind als pharmakologisch inaktiv anzusehen.
Da CYP1A2 am Metabolismus von Duloxetin beteiligt ist, ist es wahrscheinlich, dass eine gleichzeitige Anwendung von Duloxetin mit starken CYP1A2-Inhibitoren zu einer höheren Konzentration von Duloxetin führen kann. Fluvoxamin (100 mg einmal täglich), ein potenter Inhibitor von CYP1A2, senkte die Plasma-Clearance von Duloxetin um 77% und erhöhte die AUC0–t um das 6fache [10]. Deshalb ist die gleichzeitige Gabe von Duloxetin und einem starken CYP1A2-Inhibitor, wie beispielsweise Fluvoxamin, Ciprofloxacin, oder Enoxacin, kontraindiziert [10].
Da auch CYP2D6 am Metabolismus von Duloxetin beteiligt ist, können gleichzeitig verabreichte Substanzen, die einen hemmenden Einfluss auf CYP2D6 ausüben, möglicherweise ebenfalls die Wirkstoffkonzentration von Duloxetin im Blut erhöhen.
Zudem weist Duloxetin selbst moderate inhibitorische Eigenschaften auf CYP2D6 auf. So war beispielsweise die Wirkstoffkonzentration von Desipramin bei gleichzeitiger Gabe von Duloxetin erhöht [10]. Deshalb sollte Duloxetin nur mit Vorsicht gleichzeitig mit Substanzen eingesetzt werden, die über CYP2D6 metabolisiert werden und eine geringe therapeutische Breite aufweisen, wie beispielsweise Flecainid, Propafenon und Metoprolol [10].
Viele neue Antidepressiva sind Inhibitoren von CYP-Enzymen, unterscheiden sich aber in ihrem Interaktionspotenzial. Jede Kombinationsbehandlung muss daher unter Berücksichtigung von Medikamenten- und Patienteneigenschaften individuell bewertet werden [27].
Absetzsymptome
Absetzsymptome (z.B. grippeähnliche Symptome mit Schlafstörungen, Schwindel, Übelkeit, Unruhe) werden für alle Antidepressiva beschrieben. Sie treten häufig auf, meist in den ersten Tagen nach dem abrupten Absetzen der Medikamente, und verschwinden innerhalb einer Woche wieder. In seltenen Fällen jedoch können sie auch über viele Wochen andauern [17, 33].
Als Grundlage der Absetzsymptome („Entzugssymptome“) werden zentralnervöse Adaptationsmechanismen, insbesondere die Desensibilisierung postsynaptischer 5-HT- und NA-Rezeptoren, angesehen. Dies führt bei abruptem Absetzen des Antidepressivums zu einem hyposerotonergen/-noradrenergen Zustand [50].
In einer gepoolten Analyse von sechs Kurzzeitstudien wurden bei 44% der mit Duloxetin und bei 23% der mit Plazebo behandelten Patienten Absetzsymptome beschrieben, nachdem die Medikation abrupt beendet wurde. Am häufigsten traten Schwindel, Übelkeit, Kopfschmerzen, Parästhesien, Erbrechen, Erregbarkeit, und Alpträume auf [33]. Um Absetzsymptome zu vermeiden oder zu minimieren, sollte ein Antidepressivum nicht abrupt abgesetzt werden. Therapeutisch wird ein langsames Ausschleichen über mindestens zwei Wochen empfohlen, so auch für Duloxetin [10, 33].
Umstellung von anderen Antidepressiva auf Duloxetin
Die direkte Umstellung (ohne Aus- bzw. Einschleichen) von einem SSRI oder von Venlafaxin auf Duloxetin ist gut verträglich. Dies zeigte eine Studie, in der Patienten, die nicht ausreichend auf die Behandlung mit Citalopram (≤40 mg/d), Escitalopram (≤20 mg/d), Fluvoxamin (≤150 mg/d), Paroxetin (≤40 mg/d), Sertralin (≤150 mg/d) oder Venlafaxin (≤150 mg/d) ansprachen oder über unerwünschte Nebenwirkungen klagten, direkt auf Duloxetin (60 mg/d) umgestellt wurden [48].
Die Umstellung von Fluoxetin auf Duloxetin wurde nicht untersucht. Die Halbwertszeit von Fluoxetin beträgt 4 bis 6 Tage, die seines pharmakologisch aktiven Metaboliten sogar 4 bis 16 Tage. Aufgrund der langen Halbwertszeiten kann wirksame Substanz auch 5 bis 6 Wochen nach Absetzen noch im Körper verbleiben. In diesem Zeitraum können Wechselwirkungen mit Duloxetin sowohl in pharmakokinetischer (Abbau über das CYP-System) als auch pharmakodynamischer Hinsicht (gegenseitige Serotonin-verstärkende Wirkung bis hin zum Serotoninsyndrom) nicht ausgeschlossen werden. Deshalb sollte eine vorbestehende Therapie mit Fluoxetin erst ausgeschlichen werden, bevor eine Therapie mit Duloxetin begonnen wird.
Für eine Umstellung von TZA auf Duloxetin liegen keine kontrollierten Daten vor. Aufgrund der möglichen pharmakokinetischen und pharmakodynamischen Interaktionen sollten die Patienten eine TZA-Therapie vor Beginn der Duloxetin-Therapie bereits für einem Zeitraum beendet haben, der etwa fünf Halbwertszeiten des TZA entspricht. Diese Zeit erscheint hinreichend lange, um eine Elimination des betreffenden Wirkstoffs zu gewährleisten. Die Umstellung von einem MAO-Hemmer auf Duloxetin darf frühestens 14 Tage nach Beendigung der Therapie mit dem MAO-Hemmer erfolgen [10].
Fazit
Ziel der antidepressiven Therapie ist es, für jeden Patienten individuell die optimale Behandlung auszuwählen. Neben der Wirksamkeit sind die Verträglichkeit und Sicherheit des Antidepressivums von entscheidender Bedeutung. Im Gegensatz zu den älteren Substanzen mit geringer Selektivität sind die neueren, selektiven Antidepressiva deutlich sicherer und verträglicher geworden. Mit Duloxetin wird die antidepressive Therapie um ein gut verträgliches Antidepressivum erweitert, insbesondere für Patienten mit Schmerzen im Rahmen der Depression.
Literatur
1. Acharya N, Rosen AS, Polzer JP, D’Souza DN, et al. Duloxetine: meta-analysis of suicidal behaviors and ideation in clinical trials for major depressive disorder. J Clin Psychopharmacol 2006;26:587–94.
2. Anderson IM. Selective serotonin reuptake inhibitors versus tricyclic antidepressants: a meta-analysis of efficacy and tolerability. J Affect Disord 2000;58:19–36.
3. Arnold LM, Rosen A, Pritchett YL, D’Souza DN, et al. A randomized, double-blind, placebo-controlled trial of duloxetine in the treatment of women with fibromyalgia with or without major depressive disorder. Pain 2005;119:5–15.
4. Benkert O, Hippius H. Kompendium der Psychiatrischen Pharmakotherapie. 5. Aufl. Berlin: Springer-Verlag, 2005:30–1.
5. Bymaster FP, Dreshfield-Ahmad LJ, Thelkeld PG, Shaw JL, et al. Comparative affinity of duloxetine and venlafaxine for serotonin and norepinephrine transporters in vitro and in vivo, human serotonin receptor subtypes, and other neuronal receptors. Neuropsychopharmacology 2001;25:871–80.
6. Delgado PL, Brannan SK, Mallinckrodt CH, Tran PV, et al. Sexual functioning assessed in 4 double-blind placebo- and paroxetine-controlled trials of duloxetine for major depressive disorder. J Clin Psychiatry 2005;66:686–92.
6a.Detke MJ, Iyengar S, Henck JW, Bymaster F, et al. Cardiovascular effects of duloxetine: Preclinical and clinical findings [Poster]. Collegium Internationale Neuropsychopharmacologicum (CINP), Chicago, IL, July 9–13, 2006.
7. Dunner DL, Wohlreich MM, Mallickrodt CH, Watkin JG, et al. Clinical consequence of initial duloxetine dosing strategies: comparison of 30 and 60 mg QD starting doses. Curr Ther Res 2005;66:522–40.
8. Dunner D, Kornstein S, Whitmyer V, Meyers A, et al. Effects of initial dosing strategies of duloxetine on tolerability and efficacy in patients with major depressive disorder [Poster]. American College of Neuropsychopharmacology (ACNP), Hollywood, December 3–7, 2006.
9. EMEA 2003. Scientific Discussion for Cymbalta. www.emea.europa.eu
10. Fachinformation Cymbalta, Stand August 2007.
11. Fava M, Mallinckrodt CH, Detke MJ, Watkin JG, et al. The effect of duloxetine on painful physical symptoms in depressed patients: Do improvements in these symptoms result in higher remission rates? J Clin Psychiatry 2004;65:521–30.
12. Fritze J, Aldenhoff JB, Bergmann F, Maier W, et al. Antidepressiva: Lebensgefährliche Plazebos? Arznei-Telegramm: fahrlässiges Journal. Psychoneuro 2005;31:480–4.
13. Gahimer J, Wernicke J, Yalcin I, Ossanna MJ, et al. A retrospective pooled analysis of duloxetine safety in 23,983 subjects. Curr Med Res Opin 2007;23:175–84.
14. Goldstein DJ, Lu Y, Detke MJ, Hudson J, et al. Effects of duloxetine on painful physical symptoms associated with depression. Psychosomatics 2004;45:17–28.
15. Goldstein DJ, Lu Y, Detke MJ, Lee TC, et al. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain 2005;116:109–18.
16. Greist J, McNamara RK, Mallinckrodt CH, Rayamajhi JN, et al. Incidence and duration of antidepressant-induced nausea: duloxetine compared with paroxetine and fluoxetine. Clin Ther 2004;26:1446–55.
17. Haddad PM. Antidepressant discontinuation syndromes. Drug Saf 2001;24:183–97.
18. Hegerl U. Depression und Suizidalität. Verhaltenstherapie 2005;15:6–11.
19. Hiemke C, Hampel C, Weigmann H. Pharmakologie von Duloxetin. Psychopharmakotherapie 2006;13:12–8.
20. Hirschfeld RMA, Vornik LA. Newer antidepressants: review of efficacy and safety of escitalopram and duloxetine. J Clin Psychiatry 2004;65(Suppl 4):46–52.
21. Hudson JI, Wohlreich MM, Kajdasz DK, Mallinckrodt CH, et al. Safety and tolerability of duloxetine in the treatment of major depressive disorder: analysis of pooled data from eight placebo-controlled clinical trials. Hum Psychopharmacol Clin Exp 2005;20:327–41.
22. Kuehn BM. FDA panel seeks to balance risks in warnings for antidepressants. JAMA 2007;297:573–4.
23. Laux G. Depression – erkennen, behandeln, vorbeugen. Was kann der Hausarzt tun? MMW Fortschr Med 2003;145: Sonderheft 2.
24. MacGillivray S, Arroll B, Hatcher S, Ogston S, et al. Efficacy and tolerability of selective serotonin reuptake inhibitors compared with tricyclic antidepressants in depression treated in primary care: systematic review and meta-analysis. BMJ 2003;326:1–6.
25. Mallinckrodt CH, Prakash A, Andorn AC, Watkin JG, et al. Duloxetine for the treatment of major depressive disorder: a closer look at efficacy and safety data across the approved dose range. J Psychiatr Res 2006;40:337–48.
26. Masand P, Gupta S. Long-term side effects of newer generation antidepressants: SSRIs, venlafaxine, nefazodone, bupropion, and mirtazapine. Ann Clin Psychiatry 2002;14:175–82.
27. Möller HJ, Müller WE, Rüther E. Moderne Antidepressiva. Stuttgart, New York: Georg Thieme Verlag, 2002.
28. Montejo AL, Llorca G, Izquierdo JA, Rico-Villademoros F. Incidence of sexual dysfunction associated with antidepressant agents: a prospective multicenter study of 1,022 outpatients. J Clin Psychiatry 2001;62(Suppl 3):10–21.
29. Montgomery SA, Henry J, McDonald G, Dinan T, et al. Selective serotonin reuptake inhibitors: meta-analysis of discontinuation rates. Int Clin Psychopharmacol 1994;9:47–53.
30. Murray JB. Cardiac disorders and antidepressant medications. J Psychol 2000;134:162–8.
31. Nelson JC, Wohlreich MM, Mallinckrodt CH, Detke MJ, et al. Duloxetine for the treatment of major depressive disorder in older patients. Am J Geriatr Psychiatry 2005;13:227–35.
32. Nierenberg AA, Greist JH, Mallinckrodt CH, Prakash A, et al. Duloxetine versus escitalopram and placebo in the treatment of patients with major depressive disorder: onset of antidepressant action, a non-inferiority study. Curr Med Res Opin 2007;23:401–16.
33. Perahia DG, Kajdsz DK, Desaiah D, Haddad PM. Symptoms following abrupt discontinuation of duloxetine treatment in patients with major depressive disorder. J Affect Disord 2005;89:207–12.
34. Perahia DGS, Pritchett YL, Desaiah D, Raskin J. Efficacy of duloxetine in painful symptoms: an analgesic or antidepressant effect? Int Clin Psychopharm 2006;21:311–7.
35. Raskin J, Goldstein DJ, Mallinckrodt CH, Ferguson MB. Duloxetine in the long-term treatment of major depressive disorder. J Clin Psychiatry 2003;64:1237–44.
36. Richelson E. The clinical relevance of antidepressant interaction with neurotransmitter transporters and receptors. Psychopharmacol Bull 2002;36:140.
37. Robinson M, Shen S, Gonzales J, Myers T, et al. Duloxetine in the management of diabetic peripheral neuropathic pain (DPNP): Temporal profile of treatment emergent adverse events. Poster presented at AAN, San Diego, April 2006.
38. Rudolf S, Bermejo I, Schweiger U, Hohagen F, et al. Diagnostik depressiver Störungen. Dtsch Ärztebl 2006;103:A1754–62.
39. Schönhöfer PS, Schwabe U. Behandlung von Depressionen. In: Fülgraff G, Palm D (Hrsg.). Pharmakotherapie – Klinische Pharmakologie. 6. Aufl. Stuttgart: Gustav Fischer Verlag, 1986.
40. Stewart DE, Wohlreich MM, Mallinckrodt CH, Watkin JG, et al. Duloxetine in the treatment of major depressive disorder: Comparisons of safety and tolerability in male and female patients. J Affect Disord 2006;94: 183–9.
41. Thase ME, Tran PV, Wiltse C, Pngallo BA, et al. Cardiovascular profile of duloxetine, a dual reuptake inhibitor of serotonin and norepinephrine. J Clin Psychopharmacol 2005;25:132–40.
42. Tran PV, Bymaster FP, McNamara RK, Potter WZ. Dual monoamine modulation for improved treatment of major depressive disorder. J Clin Psychopharmacol 2003;23:78–86.
43. Vieweg WV, Wood MA. Tricyclic antidepressants, QT interval prolongation, and torsade de pointes. Psychosomatics 2004;45:371–7.
44. Werneke U, Northey S, Bhugra D. Antidepressants and sexual dysfunction. Acta Psychiatr Scand 2006;114:384–97.
45. Wernicke JF, Lu Y, Gahimer J, Yalcin I, et al. Safety and adverse event profile of duloxetine. Expert Opin Drug Saf 2005;4:987–93.
46. Wise TN, Perahia DGS, Pangallo BA, Losin WG, et al. Effects of the antidepressant duloxetine on body weight: analyses of 10 clinical studies. Prim Care Companion J Clin Psychiatry 2006;8:269–78.
47. Wohlreich MM, Mallinckrodt CH, Watkin JG, Hay DP. Duloxetine for the long-term treatment of major depressive disorder in patients aged 65 or older: an open label study. BMC Geriatrics 2004;4:11.
48. Wohlreich MM, Martinez JM, Mallinckrodt CH, Prakash A, et al. An open-label study of duloxetine for the treatment of major depressive disorder. J Clin Psychopharmacol 2005;25:552–60.
49. Wohlreich MM, Mallinckrodt CH, Prakash A, Watkin JG, et al. Duloxetine for the treatment of major depressive disorder: safety and tolerability associated with dose escalation. Depress Anxiety 2007;24:41–52.
50. Zajecka J, Tracy KA, Mitchel S. Discontinuation symptoms after treatment with serotonin reuptake inhibitors: a literature review. J Clin Psychiatry 1997;28:291–7.
51. Zhang L, Chappell J, Gonzales CR, Small D, et al. QT effects of duloxetine at supratherapeutic doses: A placebo and positive controlled Study. J Cardiovasc Pharmacol 2007;49:146–53.
52. Zimmermann U, Kraus T, Himmerich H, Schuld A, et al. Epidemiology, implications and mechanisms underlying drug-induced weight gain in psychiatric patients. J Psychiatr Res 2003;37:193–220.
*Alphabetische Reihenfolge der Autoren, die in gleichem Maße zur Erstellung des Manuskrips beigetragen haben.
Prof. Dr. med. Dr. rer. nat. Ekkehard Haen, Klinische Pharmakologie der Klinik und Poliklinik für Psychiatrie, Psychosomatik und Psychotherapie der Universität Regensburg, Universitätsstraße 84, 93053 Regensburg, E-Mail: ekkehard.haen@klinik.uni-regensburg.de
Dr. med. Edith Schneider, Medizinische Abteilung Neurologie/Psychiatrie, Lilly Deutschland GmbH, Werner-Reimers-Straße 2–4, 61352 Bad Homburg, E-Mail: schneider_edith@lilly.com Dr. Barbara Waldeck, Boehringer Ingelheim Pharma GmbH & Co. KG, Abteilung Medizinische Wissenschaft, 55216 Ingelheim
Tolerability and safety of duloxetine in the treatment of depressive patients
The tolerability and safety of a medication are of particular importance in the treatment of depression. When the onset of action is delayed, adverse effects at the beginning of the treatment can diminish compliance of the patients. For a long-term treatment, adverse effects can interfere with quality of life. The selective and dual-acting serotonin and noradrenaline reuptake inhibitor (SSNRI) duloxetine (Cymbalta®) is characterised not only by its good efficacy on the mental and physical symptoms of depression but also by its good tolerability, which is comparable to the newer selective substances. The most frequently reported side effects, such as nausea, dry mouth, headache and diarrhoea, usually occur at the beginning of treatment and are temporary. Duloxetine extends antidepressant treatment with a well-tolerated and usually non-sedating antidepressant, especially for patients with painful physical symptoms as part of the depression.
Keywords: Duloxetine, antidepressants, tolerability, safety
Psychopharmakotherapie 2008; 15(03)
