Dietmar Winkler, Edda Pjrek, Nikolas Klein und Siegfried Kasper, Wien
Escitalopram, das S-Enantiomer des chiralen Arzneistoffs Citalopram, ist der jüngste Vertreter aus der Gruppe der selektiven Serotonin-Wiederaufnahmehemmer (SSRI, selective serotonin reuptake inhibitor) [34]. Verglichen mit anderen SSRI besitzt der Arzneistoff die höchste Spezifität für den Serotonin-Transporter [22] und ein vergleichsweise geringes Interaktionsrisiko mit anderen Medikamenten aufgrund der hepatischen Biotransformation über drei verschiedene Cytochrom-P450-Enzyme [28]. Im Gegensatz zu anderen SSRI besitzt Escitalopram hohe Affinität zu einer allosterischen Modulationsstelle am Serotonin-Transporter, über die die Bindungsstabilität zwischen SSRI und Serotonin-Tansporter und damit die Rückaufnahmehemmung erhöht wird [3]. Der Arzneistoff wurde bisher in einer Reihe kontrollierter klinischer Studien bei depressiven Störungen [1, 16, 19, 21, 30] und Angststörungen [9, 17, 26] sowie in offenen Studien [18, 24] untersucht. Escitalopram (Cipralex®) ist derzeit zur Behandlung von depressiven Episoden, Panikstörung mit und ohne Agoraphobie, sozialer Phobie und generalisierter Angststörung zugelassen.
In der Prüfung von Arzneimitteln erfüllen Anwendungsbeobachtungen (Phase IV der klinischen Prüfung) eine wichtige Funktion [11, 20]. Da in den kontrollierten Untersuchungen der Phase II und III vor der Zulassung Studienpatienten einer speziellen Selektion unterliegen, wird häufig argumentiert, dass die Ergebnisse dieser Studien nicht ohne weiteres in die Praxis übertragbar seien. Die Zielsetzung von Anwendungsbeobachtungen ist es deshalb, an einer unselektierten, naturalistischen Stichprobe die Ergebnisse der kontrollierten Studien zu überprüfen. Das Ziel der vorliegenden Anwendungsbeobachtung war die Untersuchung der Wirksamkeit und Verträglichkeit von Escitalopram, sowie die Verbesserung des Krankheitsbilds unter dieser Medikation bei berufstätigen Menschen vor allem in Hinblick auf die Krankenstände.
Patienten und Methoden
Bei der vorliegenden Anwendungsbeobachtung (entsprechend § 2a (3) des österreichischen Arzneimittelgesetzes), handelt es sich um eine offene, multizentrische Studie, die von insgesamt 505 niedergelassenen Fachärzten und Ärzten für Allgemeinmedizin in Österreich durchgeführt wurde.
Wichtigstes Einschlusskriterium war die Indikationsstellung zu einer Therapie mit Escitalopram durch den behandelnden Arzt. Nach Zusendung der Dokumentationsunterlagen sollten die in Frage kommenden Patienten konsekutiv während der Rekrutierungsphase zwischen September 2004 und März 2005 dokumentiert werden. Nach dem Einschluss war eine Kontrolluntersuchung nach vier bis sechs Wochen und eine Abschlussuntersuchung nach drei Monaten vorgesehen. Für die Behandlungsführung, die Dosierung von Escitalopram und die Begleitmedikation gab es keine Auflagen. Nach Abschluss der Untersuchung wurden die Beurteilungsbögen (Case report forms, CRF) von der Studienleitung überprüft und etwaige Inkonsistenzen mit den Prüfärzten geklärt.
Bei 1571 Patienten wurden als Hauptzielparameter dieser Untersuchung die Krankenstandstage in den letzten drei Monaten vor der Behandlung und in den drei Monaten während der Therapie mit Escitalopram erhoben. Bei weiteren 807 Patienten wurde zusätzlich der klinische Verlauf mit den Skalen Clinical Global Impression of Severity (CGI-S, klinischer Gesamteindruck der Schwere der Erkrankung, Tab. 1) und Clinical Global Impression of Improvement (CGI-I, klinischer Gesamteindruck der Veränderung des Krankheitsbilds, Tab. 1) evaluiert [10]. Des Weiteren wurden in dieser Subgruppe
Tab. 1. Clinical Global Imression of Severity/Improvement (CGI-S/-I): Bewertung des klinischen Gesamteindrucks von Erkrankungsschwere und Verbesserung
|
Wertung Skala |
Bedeutung CGI-S |
Bedeutung CGI-I |
|
1 |
Nicht krank |
Sehr viel besser |
|
2 |
Grenzfall |
Viel besser |
|
3 |
Leicht krank |
Wenig besser |
|
4 |
Mäßig krank |
Unverändert |
|
5 |
Deutlich krank |
Etwas schlechter |
|
6 |
Schwer krank |
Viel schlechter |
|
7 |
Extrem schwer krank |
Sehr viel |
die therapeutische Wirksamkeit (1=sehr gut, 2=mäßig, 3=gering, 4=unverändert),
die aufgetretenen Nebenwirkungen,
die Veränderungen von Gewicht bzw. Body-Mass-Index (BMI),
die verwendete Begleitmedikation,
die Compliance des Patienten sowie
die weitere Therapie nach Abschluss der Untersuchung erhoben.
Insgesamt liegen Daten zu 2378 Patienten vor.
In diese Untersuchung wurden 949 Männer (40,8%) und 1376 Frauen (59,2%) eingeschlossen (Tab. 2). Das Durchschnittsalter betrug 42,3±10,6 Jahre (Range: 17 bis 85 Jahre). Die durchschnittliche Erkrankungsdauer zum Zeitpunkt des Therapiebeginns mit Escitalopram betrug 2,5±5,0 Jahre. Der BMI vor Therapiebeginn lag bei Männern im Durchschnitt bei 25,2±3,0 kg/m2 und bei Frauen bei 23,9±3,6 kg/m2.
Tab. 2. Demographische und klinische Charakteristika der in die Anwendungsbeobachtung eingeschlossenen Patienten
|
Gruppe 1: Krankenstandskarten |
Gruppe 2: Ausführlichere klinische Untersuchung |
Gesamt |
|
|
Probanden [n] |
1571 |
807 |
2378 |
|
Alter [Jahre] |
41,7±10,2 |
43,4±11,3 |
42,3±10,6 |
|
Dauer Erkrankung [Jahre] |
2,5±5,0 |
||
|
Körpergröße [cm] |
|
||
|
Körpergewicht [kg] |
|
||
|
BMI vor Therapie [kg/m2] |
|
||
|
Übergewichtige Probanden [%] |
|
||
|
Untergewichtige Probanden [%] |
|
||
|
Adipöse Probanden [%] |
|
||
|
BMI nach der Therapie [kg/m2] |
|
76,5% der eingeschlossenen Patienten litten an einer affektiven Störung (nach ICD-10 [35]: F3), 10,8% an einer Angststörung (F40, F41), 6,1% an einer Anpassungsstörung (F43.2), 4,7% an einer somatoformen Störung (F45) und 8,2% an sonstigen Erkrankungen.
366 (45,4%) der Patienten waren zum Einschlusszeitpunkt schon mit Antidepressiva vorbehandelt worden. Von diesen hatten 68,7% SSRI, 22,1% trizyklische Antidepressiva, 19,7% noradrenerge und spezifisch serotonerge Antidepressiva (NaSSA: Mirtazapin, Trazodon), 11,5% tetrazyklische Antidepressiva (Mianserin, Maprotilin), 9,0% Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI: Venlafaxin, Milnazipran) und 22,4% Antidepressiva einer anderen Arzneistoff-Gruppe erhalten.
Die erhobenen Daten wurden statistisch mit SPSS für Windows [25] ausgewertet. Neben deskriptiven Statistiken wurden gepaarte T-Tests für Vorher-Nachher-Vergleiche eingesetzt; univariate Varianzanalysen (analysis of variance, ANOVA) mit Messwiederholungen und Post-hoc-Tests mit Bonferroni-Korrektur wurden für Vergleiche zwischen den drei Studienvisiten angewandt. Bei fehlenden Werten wurde die Last-observation-carried-forward-Methode (LOCF) verwendet. Ein Signifikanzniveau von p≤0,05 wurde angenommen. Alle statistischen Hypothesen wurden zweiseitig formuliert.
Ergebnisse
Die initial verordnete tägliche Dosis von Escitalopram betrug im Mittel 9,0±3,2 mg. Bei der ersten Kontrollvisite nach vier bis sechs Wochen lag die Tagesdosis bei 12,1±4,7 mg, bei der Abschlussvisite wurden durchschnittlich 12,4±5,0 mg verordnet (Abb. 1).
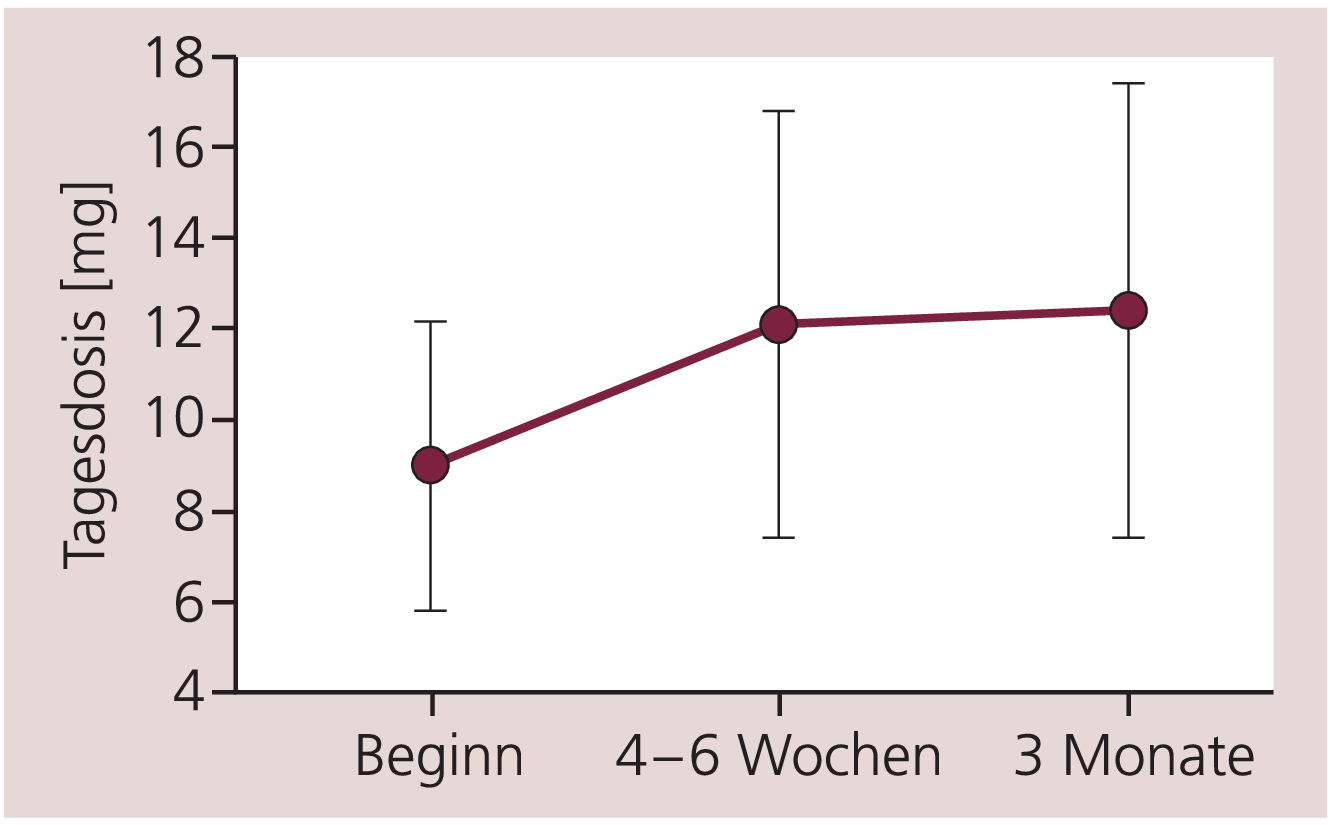
Abb. 1. Dosierungen von Escitalopram bei 794 Patienten zum Zeitpunkt der Einstellung sowie nach vier bis sechs Wochen und nach drei Monaten. Angegeben sind Mittelwerte und Standardabweichung. Analyse durch ANOVA mit Messwiederholungen (p<0,001) sowie Post-hoc-Tests mit Bonferroni-Korrektur: p<0,001 (zwischen allen Zeitpunkten)
Im Rahmen der Therapie kam es zu einem statistisch signifikanten Rückgang der Krankheitsschwere gemessen mit einer Reduktion im CGI-S von 4,7±0,9 auf 3,4±1,0 nach vier bis sechs Wochen und 2,4±1,1 nach drei Monaten (F=2436,6, df=1,686, p<0,001; Post-hoc-Tests zwischen allen drei Zeitpunkten: p<0,001; Abb. 2).
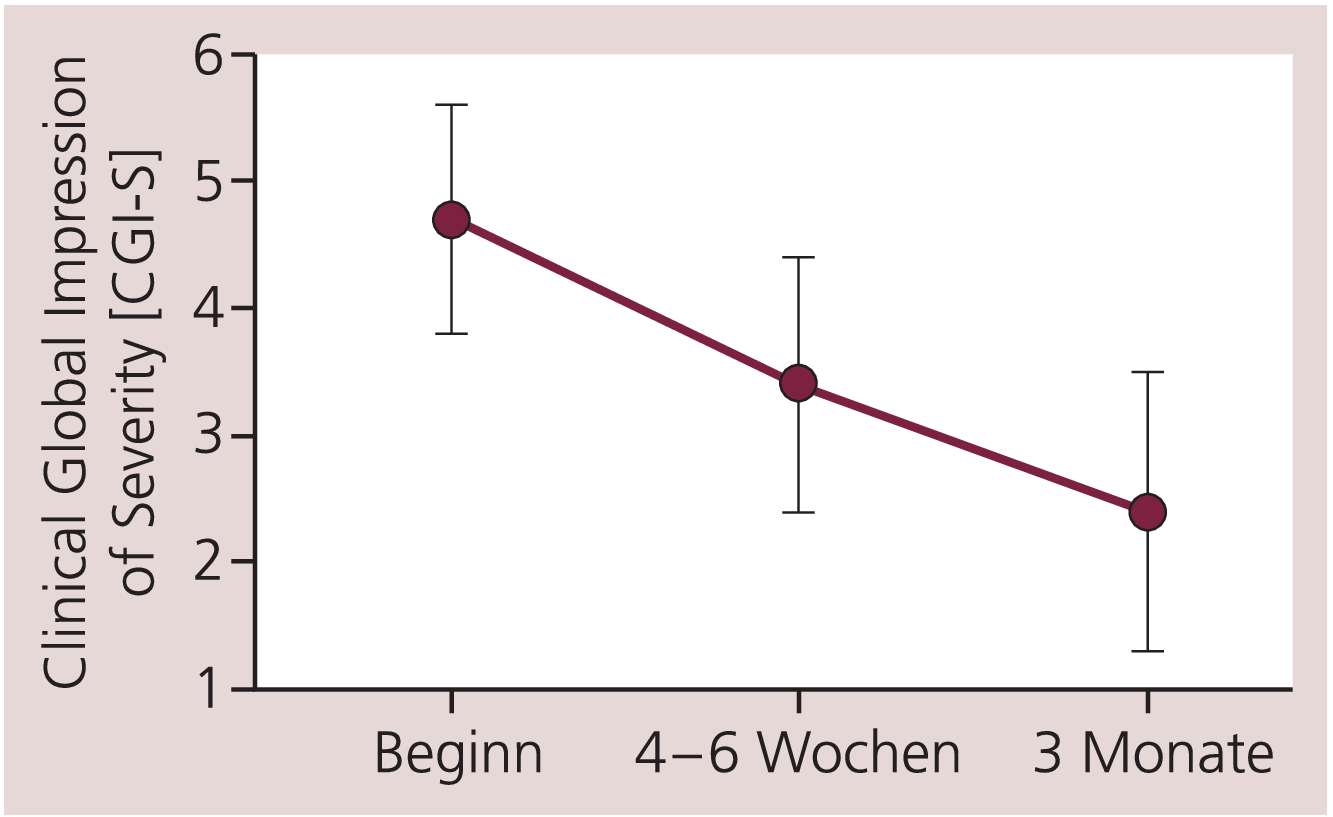
Abb. 2. Klinischer Gesamteindruck der Schwere des Krankheitsbilds (Clinical Global Impression of Severity; CGI-S) bei 796 Patienten zum Zeitpunkt der Erstuntersuchung sowie nach vier bis sechs Wochen und nach drei Monaten unter Therapie mit Escitalopram. Angegeben sind Mittelwerte und Standardabweichung. Analyse durch ANOVA mit Messwiederholungen (p<0,001) sowie Post-hoc-Tests mit Bonferroni-Korrektur: p<0,001 (zwischen allen Zeitpunkten)
Die Verbesserung des klinischen Zustands wurde mit CGI-I nach vier bis sechs Wochen auf durchschnittlich 2,5±0,8 und am Ende der Untersuchung auf 1,9±0,9 eingeschätzt. Zu den gleichen Zeitpunkten wurde die therapeutische Wirksamkeit mit 1,8±0,9 bzw. 1,4±0,7 beurteilt.
Die durchschnittliche Zahl der Krankenstandstage in den letzten drei Monaten vor der Therapie betrug 11,0±12,8 Tage und verminderte sich statistisch signifikant während der dreimonatigen Therapie mit Escitalopram auf 5,4±11,0 Tage (t=24,934, df=2298, p<0,001; Abb. 3).
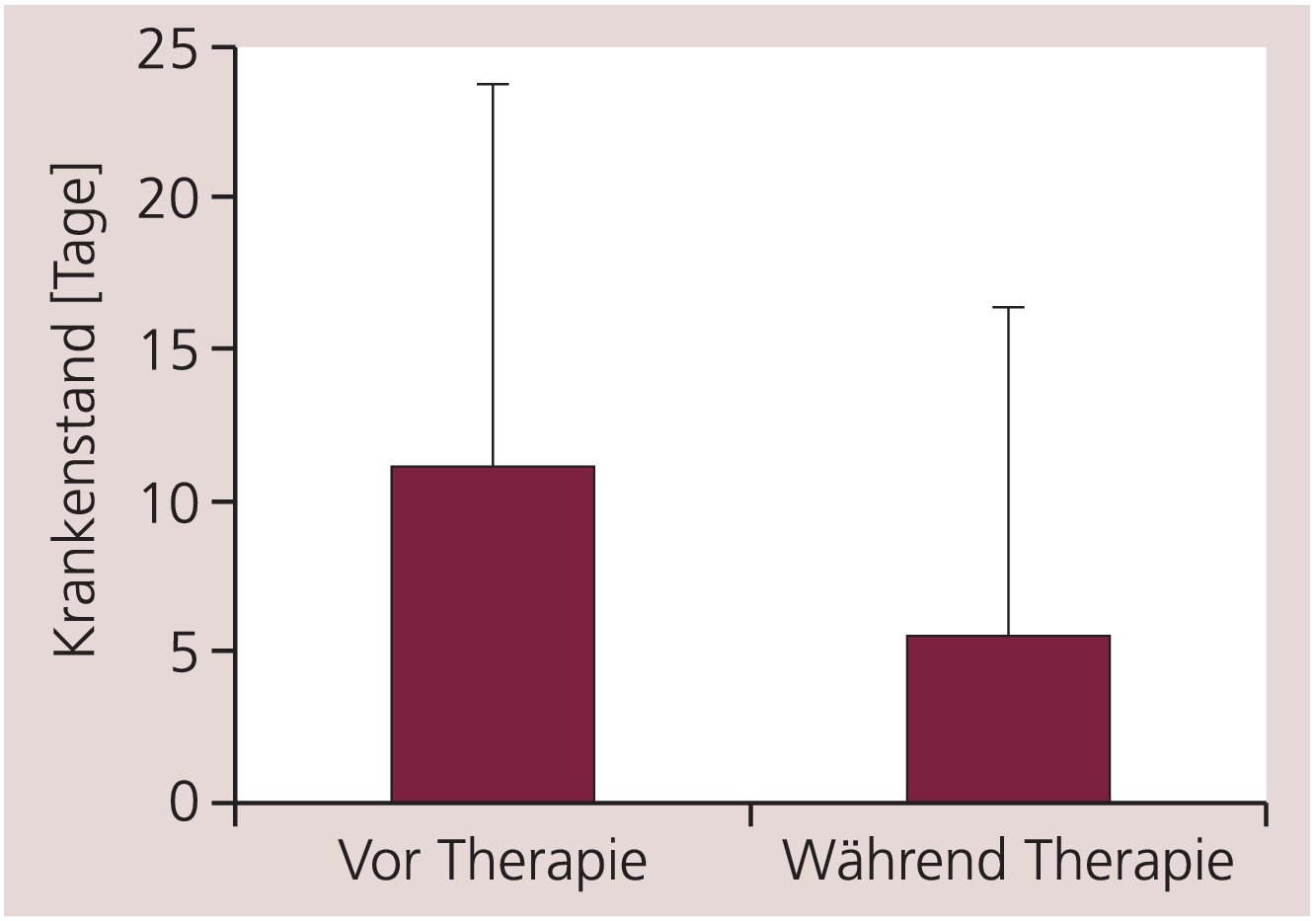
Abb. 3. Vergleich der Krankenstandstage von 2299 Patienten in den letzten drei Monaten vor Therapiebeginn und während der dreimonatigen Therapie mit Escitalopram (t=24,934, df=2298, p<0,001). Angegeben sind Mittelwerte und Standardabweichung.
Die Rate an Nebenwirkungen zu Therapiebeginn betrug 13,1%, wobei nur 1,3% der Patienten eine relevante Beeinträchtigung durch die Medikation bemerkten. Die häufigsten Nebenwirkungen waren dabei gastrointestinale Beschwerden inklusive Nausea (5,8%), innere Unruhe (1,9%), Potenz- und Ejakulationsstörungen (1,1%), Schwindel und Kreislaufprobleme (1,0 %), Müdigkeit (1,0%), Insomnie (1,0%), Schweißausbrüche (1,0%) und Kopfschmerzen (0,6%). Nach vier bis sechs Wochen betrug der Prozentsatz an Patienten mit Nebenwirkungen 14,3% (2,8% mit relevanter Beeinträchtigung), nach drei Monaten 7,3% (1,0% mit relevanter Beeinträchtigung). Während der Behandlung mit Escitalopram kam es nur zu geringfügigen Gewichtsveränderungen (absolute Gewichtsdifferenz +0,27±2,78 kg): Ein Vergleich des BMI vor (24,4±3,4 kg/m2) und nach Therapie (24,5±3,5 kg/m2) erbrachte jedoch keine signifikante Differenz (t=–1,899, df=784, p=0,058).
Als zusätzliche Therapie wurden 8,1% der Patienten mit einem weiteren Antidepressivum behandelt (in 3,1% Mirtazapin). Eine begleitende anxiolytische Medikation erhielten 34,9% der Patienten zu Studienbeginn; diese Rate verminderte sich nach vier bis sechs Wochen auf 29,2% und nach drei Monaten auf 18,7%. Das dabei am häufigsten verordnete Anxiolytikum war Alprazolam (12,6% der Patienten). Eine antipsychotische Komedikation erfolgte in 10,4% der Fälle.
Die Rate an Therapieabbrüchen in dieser Studie war mit 4,8% gering. Die Compliance der Patienten wurde von den behandelnden Ärzten in 91,6% der Fälle als gut eingeschätzt.
Nach dem Ende der Anwendungsbeobachtung behielten 96,2% der Patienten die Therapie mit Escitalopram als Erhaltungstherapie bei. Die häufigsten alternativen Therapieoptionen waren in 1,3% der Fälle die Umstellung auf SNRI, in 0,7% eine Umstellung auf NaSSA und in 0,5% ein Therapieversuch mit einem anderen SSRI.
Diskussion
In der vorliegenden Anwendungsbeobachtung wurde die Effektivität von Escitalopram in einer weitgehend unselektierten Gruppe ambulanter Patienten untersucht. Hauptzielvariable war dabei die Anzahl der Krankenstandstage, um Aufschluss über die Arbeitsfähigkeit vor und unter Therapie zu erhalten. Ein Großteil der Patienten in dieser Studie wurde mit einer Dosis von 10 mg pro Tag behandelt (68% bei der Abschlussvisite), was dem unteren therapeutischen Bereich entspricht. Während der Behandlung mit Escitalopram kam es nicht nur zu einer klinisch relevanten Reduktion im CGI-S und CGI-I, sondern auch zu einer Verminderung der Krankenstandstage um mehr als die Hälfte. Da sich die Kosten eines einzigen Krankenstandstags (unter anderem durch die entgangene Arbeitsleistung) im Durchschnitt auf 85 Euro belaufen [12, 27], ergibt sich allein durch die Berücksichtigung dieses Parameters (Reduktion der Krankenstände um 5,6 Tage in drei Monaten) eine Verminderung der Kosten von 476 Euro, was die direkten Beschaffungskosten einer medikamentösen Therapie mit Escitalopram [15] inklusive der mit der Sozialversicherung vereinbarten Arzthonorare [33] im Rahmen einer ambulanten Therapie im selben Zeitraum bei weitem übersteigt.
Die bislang publizierten Arbeiten, die den pharmakoökonomischen Aspekt einer Therapie mit Escitalopram untersucht haben [5, 7, 8, 13, 14, 31, 32], stützen sich in erster Linie auf Daten aus Metaanalysen oder randomisierten doppelblinden Studien. Hierbei konnte gezeigt werden, dass Escitalopram die indirekten Kosten (z.B. Krankenstandskosten und Kosten, die durch entgangene Produktivität entstehen) von Depressionen wirksam begrenzen kann und bezogen auf die Summe von direkten und indirekten Kosten, die dem Gesundheitssystem durch die Erkrankung entstehen, eine kostengünstigere Alternative zu anderen Antidepressiva darstellt. Dadurch, dass die Studienpatienten dieser Untersuchungen einer starken Selektion unterliegen, ist eine Verallgemeinerung der Schlussfolgerungen nicht immer möglich.
Unsere Untersuchung stellt damit eine wichtige Ergänzung dar, da wir eine naturalistische Stichprobe untersucht haben. Unsere Ergebnisse bestätigen damit die verfügbaren klinischen und pharmakoökonomischen Daten aus kontrollierten Studien, auch wenn wir keine vergleichende Analyse mit anderen Antidepressiva durchführen konnten.
Das im Rahmen dieser Studie erhobene Nebenwirkungsprofil von Escitalopram deckt sich mit bisherigen Daten zur Verträglichkeit von SSRI [6]. Die Therapie wurde in den meisten Fällen gut vertragen. Die geringe Rate an Studienabbrechern von rund 5% und die mit 92% hohe Compliance zeigen des Weiteren die hohe Akzeptanz seitens der Patienten. Eine klinisch relevante Beeinträchtigung durch die Medikation, die eine Dosisreduktion oder ein Absetzen von Escitalopram erforderlich machte, trat nur bei 1 bis 3% der Patienten auf.
Kritisch anzumerken ist, dass die Studienpatienten zwar zu jeder Visite zu unerwünschten Arzneimitteleffekten befragt wurden, ein Interview aber anhand einer systematischen Auflistung möglicher Nebenwirkungen wahrscheinlich zu einer höheren Rate erfasster Nebenwirkungen geführt hätte. Bei einer Anwendungsbeobachtung ist bei der kausalen Attribution von Nebenwirkung des Weiteren die Komedikation zu berücksichtigen. Unerwünschte Arzneimittelwirkungen sind dann häufiger, wenn neben einem Antidepressivum auch andere psychotrope Medikamente verabreicht werden [4].
Die Methodologie von Anwendungsbeobachtungen wirft eine Reihe von Problemen auf, beispielsweise hinsichtlich der Interrater-Reliabilität oder der Handhabung von fehlenden Daten, wobei die von uns verwendete LOCF-Methode zu einer Erhöhung der Validität der Ergebnisse führt. Ein weiteres Bias stellt die psychopharmakologische Komedikation der Patienten dar, die die Ergebnisse verzerren kann. Da beinahe die Hälfte der Patienten antidepressiv vorbehandelt war, wäre es auch denkbar, dass bereits diese Vormedikation eine Verbesserung induziert hat, und damit Einfluss auf die Zielvariablen der Studie (insbesondere auch auf die Krankenstände) genommen hat. Die Validität unserer Ergebnisse wird jedoch durch die Konkordanz unserer Befunde mit den Ergebnissen aus Phase-II- und -III-Studien bestätigt. Die vorliegende Arbeit erfüllt die Anforderungen an eine Anwendungsbeobachtung mit der Zielsetzung zur Qualitätssicherung von Arzneimitteln nach ihrer Zulassung unter besonderer Berücksichtigung pharmakoökonomischer Aspekte [20]. In Zukunft wäre untersuchenswert, ob die mit Escitalopram in der akuten Therapiephase erzielten Effekte auch in der Erhaltungs- und Langzeittherapie gehalten werden können, wie aus den bisher publizierten kontrollierten Untersuchungen [2, 23, 29] zu erwarten wäre.
Literatur
1. Auquier P, Robitail S, Llorca PM, Rive B. Comparison of escitalopram and citalopram efficacy: A meta-analysis. Int J Psychiatry Clin Pract 2003;7:259–68.
2. Bielski RJ, Bose A, Chang CC. A double-blind comparison of escitalopram and paroxetine in the long-term treatment of generalized anxiety disorder. Ann Clin Psychiatry 2005;17:65–9.
3. Chen F, Larsen MB, Sanchez C, Wiborg O. The S-enantiomer of R,S-citalopram, increases inhibitor binding to the human serotonin transporter by an allosteric mechanism. Comparison with other serotonin transporter inhibitors. Eur Neuropsychopharmacol 2005;15:193–8.
4. Corruble E, Puech AJ. How to improve the risk-benefit ratio of antidepressants. Int Clin Psychopharmacol 1993;8:237–41.
5. Demyttenaere K, Hemels ME, Hudry J, Annemans L. A cost-effectiveness model of escitalopram, citalopram, and venlafaxine as first-line treatment for major depressive disorder in Belgium. Clin Ther 2005;27:111–24.
6. Ferguson JM. SSRI antidepressant medications: adverse effects and tolerability. Prim Care Companion J Clin Psychiatry 2001;3:22–7.
7. Fernandez JL, Montgomery S, Francois C. Evaluation of the cost effectiveness of escitalopram versus venlafaxine XR in major depressive disorder. Pharmacoeconomics 2005;23:155–67.
8. Francois C, Toumi M, Aakhus AM, Hansen K. A pharmacoeconomic evaluation of escitalopram, a new selective serotonin reuptake inhibitor. Comparison of cost-effectiveness between escitalopram, citalopram, fluoxetine, and venlafaxine for the treatment of depression in Norway. Eur J Health Econ 2003;4:12–9.
9. Goodman WK, Bose A, Wang Q. Treatment of generalized anxiety disorder with escitalopram: pooled results from double-blind, placebo-controlled trials. J Affect Disord 2005;87:161–7.
10. Guy W. ECDEU assessment manual for psychopharmacology. US Department of Health, Education and Welfare publication (ADM). Rockville, MD: National Institute of Mental Health, 1976:76–338.
11. Hakkarainen H, Hattab JR, Venulet J. Phase IV research by pharmaceutical companies. Pharmacopsychiatry 1984;17:168–75.
12. Hauptverband der Österreichischen Sozialversicherungsträger. Handbuch der Österreichischen Sozialversicherung 2002. Wien: Österreichische Sozialversicherung, 2002.
13. Hemels ME, Kasper S, Walter E, Einarson TR. Cost-effectiveness analysis of escitalopram: a new SSRI in the first-line treatment of major depressive disorder in Austria. Curr Med Res Opin 2004;20:869–78.
14. Hemels ME, Kasper S, Walter E, Einarson TR. Cost-effectiveness of escitalopram versus citalopram in the treatment of severe depression. Ann Pharmacother 2004;38:954–60.
15. IMS Health. IMS Dataview. IMS data QTR/12/02, 2002.
16. Kasper S, Spadone C, Verpillat P, Angst J. Onset of action of escitalopram compared with other antidepressants: results of a pooled analysis. Int Clin Psychopharmacol 2006;21:105–10.
17. Kasper S, Stein DJ, Loft H, Nil R. Escitalopram in the treatment of social anxiety disorder: randomised, placebo-controlled, flexible-dosage study. Br J Psychiatry 2005;186:222–6.
18. Klein N, Wiesegger G, Attarbaschi T, Winkler D, et al. A naturalistic observational study of escitalopram in the treatment of depression and anxiety disorder in adult outpatients. Rom J Psychopharmacol 2004;4:1–9.
19. Lepola UM, Loft H, Reines EH. Escitalopram (10–20 mg/day) is effective and well tolerated in a placebo-controlled study in depression in primary care. Int Clin Psychopharmacol 2003;18:211–7.
20. Linden M, Baier D, Beitinger H, Kohnen R, et al. Leitlinien zur Durchführung von Anwendungsbeobachtungen (AWB) in der Psychopharmakotherapie. Nervenarzt 1994;65:638–44.
21. Llorca PM, Azorin JM, Despiegel N, Verpillat P. Efficacy of escitalopram in patients with severe depression: a pooled analysis. Int J Clin Pract 2005;59:268–75.
22. Owens MJ, Knight DL, Nemeroff CB. Second-generation SSRIs: human monoamine transporter binding profile of escitalopram and R-fluoxetine. Biol Psychiatry 2001;50:345–50.
23. Rapaport MH, Bose A, Zheng H. Escitalopram continuation treatment prevents relapse of depressive episodes. J Clin Psychiatry 2004;65:44–9.
24. Rush AJ, Bose A. Escitalopram in clinical practice: results of an open-label trial in a naturalistic setting. Depress Anxiety 2005;21:26–32.
25. SPSS for Windows. Release 11.0. Chicago, IL, USA: 1989–2001.
26. Stahl SM, Gergel I, Li D. Escitalopram in the treatment of panic disorder: a randomized, double-blind, placebo-controlled trial. J Clin Psychiatry 2003;64:1322–7.
27. Statistik Austria. Statistisches Jahrbuch. www.statistik.at, 2003.
28. von Moltke LL, Greenblatt DJ, Giancarlo GM, Granda BW, et al. Escitalopram (S-citalopram) and its metabolites in vitro: cytochromes mediating biotransformation, inhibitory effects, and comparison to R-citalopram. Drug Metab Dispos 2001;29:1102–9.
29. Wade A, Despiegel N, Reines E. Long-term treatment of depression with escitalopram is safe and well-tolerated. Eur Neuropsychopharmacol 2002;12(Suppl 3):232–3.
30. Wade A, Lemming OM, Bang Hedegaard K. Escitalopram 10 mg/day is effective and well tolerated in a placebo-controlled study in depression in primary care. Int Clin Psychopharmacol 2002;17:95–102.
31. Wade AG, Toumi I, Hemels ME. A pharmacoeconomic evaluation of escitalopram versus citalopram in the treatment of severe depression in the United Kingdom. Clin Ther 2005;27:486–96.
32. Wade AG, Toumi I, Hemels ME. A probabilistic cost-effectiveness analysis of escitalopram, generic citalopram and venlafaxine as a first-line treatment of major depressive disorder in the UK. Curr Med Res Opin 2005;21:631–42.
33. Wiener Gebietskrankenkasse. Wien: Gebietskrankenkasse, 2003.
34. Winkler D, Kasper S. Escitalopram. Arzneimitteltherapie 2004;22:97–102.
35. World Health Organization. The ICD-10 classification of mental and behavioral disorders: Clinical descriptions and diagnostic guidelines. Geneva: World Health Organization (WHO), 1991.
Dr. med. univ. Dietmar Winkler, Dr. Edda Pjrek, Dr. Nikolas Klein, O. Univ. Prof. Dr. Dr. h.c. Siegfried Kasper, Klinische Abteilung für Allgemeine Psychiatrie, Medizinische Universität Wien, Währinger Gürtel 18–20, 1090 Wien, Österreich, E-Mail: dietmar.winkler@meduniwien.ac.at
Escitalopram in employed people – results from an observational study in 2378 patients
The selective serotonin reuptake inhibitor (SSRI) escitalopram is the active enantiomer of racemic citalopram. It has been licensed for treatment of major depression, social phobia, panic disorder and generalized anxiety disorder. The aim of this observational study was to evaluate the efficacy and safety of escitalopram in a naturalistic sample of employed people with mood and anxiety disorders. Days on sick leave in the last three months before and during three months of treatment with escitalopram were recorded in 2378 subjects (949 males, 1376 females). Clinical Global Impression (CGI) was used to assess treatment effects in a subsample of 807 patients. Treatment with escitalopram (mean daily dosage: 12.4±5.0 mg) led to a significant reduction of sick leaves (11.0±12.8 days versus 5.4±11.0 days; p<0.001), and a continuous decrease of severity of illness (CGI-S) starting from 4.7±0.9 at baseline to 3.4±1.0 after four to six weeks and 2.4±1.1 after three months (p<0.001). The rate of side effects at the start of treatment was 13.1%, but only 1.3% of the patients experienced a relevant impairment due to the medication. Altogether escitalopram was efficacious and well tolerated. A reduction of sick leaves is indicative of better working ability in our subjects, and emphasizes the cost-effectiveness of this treatment.
Keywords: Escitalopram, depression, antidepressants, sick leave
Psychopharmakotherapie 2006; 13(04)
