Detlef Degner, Göttingen, Renate Grohmann, München, Eckart Rüther, Göttingen, Udo Reulbach, Erlangen, und Merle Haust, Düsseldorf
Das Institut für Arzneimittelsicherheit in der Psychiatrie e.V. (AMSP) untersucht kontinuierlich schwere unerwünschte Arzneimittelwirkungen (UAW) unter Psychopharmaka im stationären Bereich. Das AMSP-Projekt ist ein UAW-Erfassungssystem zur systematischen Überwachung und raschen Entdeckung klinisch bedeutsamer Risiken unter Psychopharmaka.
Gerade bei stationären psychiatrischen Patienten werden, aus unterschiedlichen Gründen, häufig Mehrfachtherapien mit verschiedenen Psychopharmaka [4], aber auch, besonders bei multimorbiden Patienten, zusätzlich internistische Medikamente eingesetzt. So wurden der AMSP-Datenbank zufolge im Zeitraum von 2001 bis 2003 bei etwa 40% aller UAW-Fälle Kombinationsbehandlungen angeschuldigt. Für den behandelnden Psychiater bringen sowohl pharmakodynamische als auch pharmakokinetische Interaktionen oft besondere Schwierigkeiten.
Die AMSP-Daten belegen, dass, mit steigender Tendenz [5], Antikonvulsiva nach Antipsychotika und Antidepressiva die dritthäufigste Substanzklasse sind, mit der stationäre Patienten in psychiatrischen Kliniken behandelt wurden [4]. Der hier vorgestellte Fall zeigt unter anderem auch Risiken beim Einsatz bekannter, älterer Antikonvulsiva wie Carbamazepin auf.
Angesichts der Tatsache, dass verstärkt neue Antipsychotika und Antidepressiva im Zentrum allgemeinen Interesses stehen, soll durch AMSP das Problembewusstsein für Präparate geschärft werden, die schon lange, teilweise auch als Generika, auf dem Markt sind, und sehr häufig eingesetzt werden.
Fallbericht
Bei einer 41-jährigen Patientin sind als Diagnosen eine langjährige Alkohol- und Opioid-Abhängigkeit (ICD-10: F10.2, F11.2) bekannt, zusätzlich besteht der Verdacht auf eine emotional instabile Persönlichkeitsstörung (ICD-10: F60.31). Die Erstdiagnose wurde 1985 gestellt, bislang kam es zu fünf stationären psychiatrischen Vorbehandlungen. An organischen Erkrankungen sind eine Leberzirrhose, Ösophagus-Varizen, eine alte Hepatitis B sowie epileptische Krampfanfälle im Rahmen von Alkoholentzügen bekannt. Als Vormedikation erhielt sie seit etwa einem Jahr im ambulanten Bereich Carbamazepin (400 mg/d) und im Rahmen eines speziellen Substitutionsprogramms Levomethadon (L-Polamidon®; 75 mg/d).
Auf Grund einer beginnenden Alkohol-Entzugssymptomatik wurde die Patientin akut in der Notaufnahme der Universitätsklinik Göttingen aufgenommen.
Sie erhielt initial Diazepam (20 mg/d) und Gabapentin (900 mg/d), die Medikation mit Carbamazepin (Tegretal®, 400 mg/d) und die Levomethadon-Substitution wurden fortgesetzt. Wegen einer Pneumonie wurde von den Internisten zusätzlich eine antibiotische Therapie mit Erythromycin (am 1. Tag 1500 mg, dann ab dem 2. Tag 2000 mg/d) sowie eine antimykotische Therapie mit Metronidazol (900 mg/d) eingeleitet. Die Patientin wurde am Abend des Aufnahmetags in die Psychiatrische Klinik verlegt. Carbamazepin wurde am 2. Tag nach stationärer Aufnahme auf eine Tagesdosis von 800 mg erhöht und mit dieser Dosierung fortgeführt, die Carbamazepin-Spiegel im Plasma lagen am 2. Tag bei 42,0 µmol/l, am 5. Tag bei 45,5 µmol/l (therapeutischer Bereich: 17–47 µmol/l). Der weitere Verlauf unter Fortsetzung der bisherigen Medikation war zunächst komplikationslos.
Sieben Tage nach stationärer Aufnahme traten eine starke Schläfrigkeit mit zunehmender Desorientiertheit, ein ausgeprägter Blickrichtungsnystagmus sowie eine deutliche Ataxie mit mehrfachen Stürzen auf. Wegen multipler Hämatome war eine chirurgische Konsiliaruntersuchung erforderlich. Das kraniale CT zeigte einen regelrechten Befund.
Wegen des dringenden Verdachts auf eine Carbamazepin-Intoxikation wurde Carbamazepin zunächst auf 400 mg/d reduziert und am Folgetag abgesetzt. Die Carbamazepin-Plasmakonzentrationen waren bis auf maximal 88,3 µmol/l gestiegen. Nach Absetzen von Carbamazepin kam es zu einer raschen klinischen Besserung der Symptomatik, die Blutspiegel waren ebenfalls schnell rückläufig. Die Dauer der UAW betrug insgesamt drei Tage.
Die Therapie mit Erythromycin, Metronidazol, Gabapentin und Levomethadon wurde fortgesetzt. Der Verlauf ist in Abbildung 1 zusammengefasst.
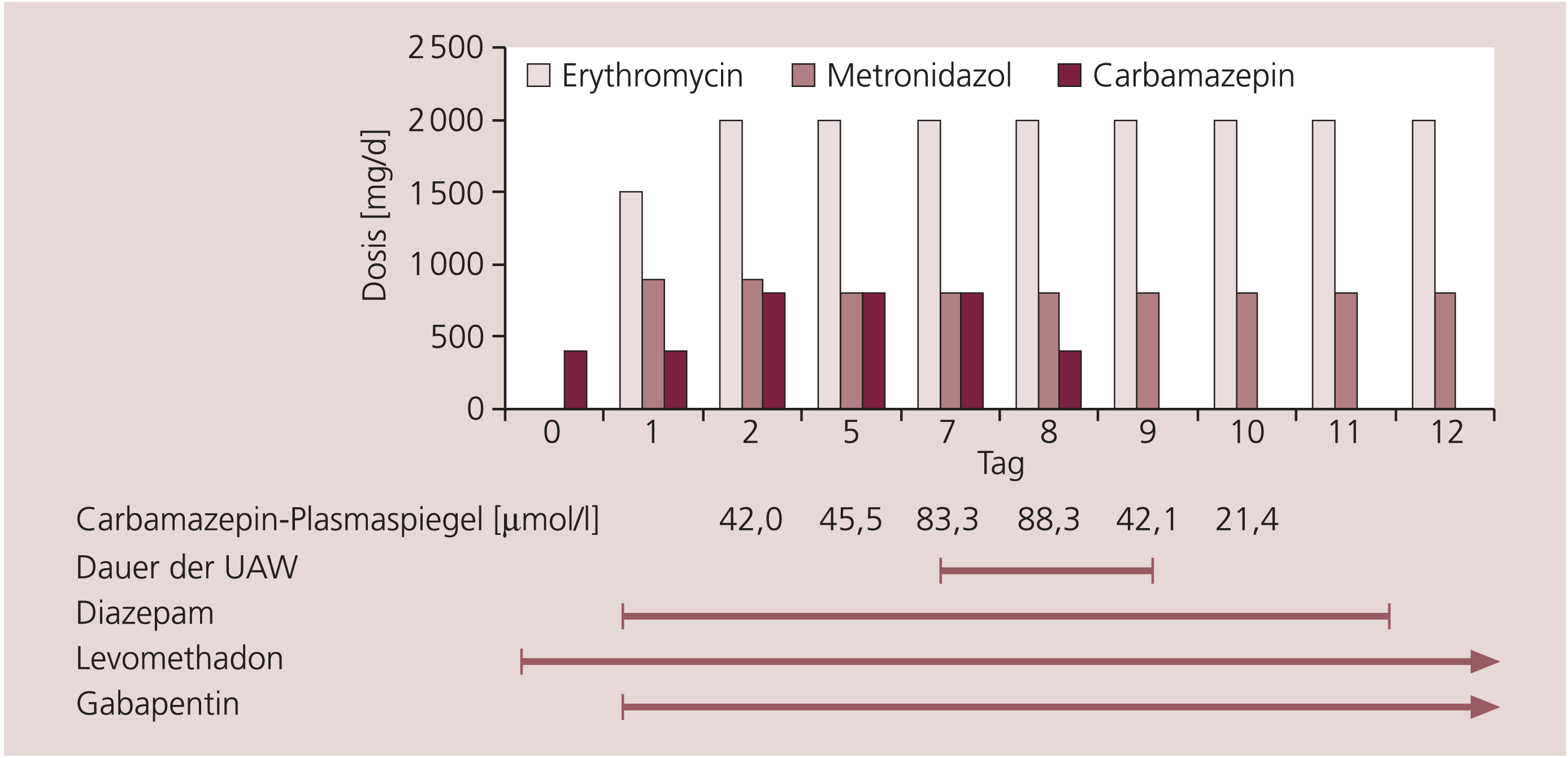
Abb. 1. Verlauf der stationären Pharmakotherapie
In der Folgezeit wurde Diazepam sukzessive reduziert und schließlich abgesetzt, nach Abschluss der stationären Entzugsbehandlung konnte die Patientin 17 Tage nach Aufnahme in stabilisiertem Zustand unter Fortführung der Levomethadon-Substitution in eine weiterführende ambulante Therapie entlassen werden.
Diskussion
Carbamazepin wird als Antikonvulsivum und in der Schmerztherapie häufig eingesetzt. Daneben hat die Substanz einen festen Stellenwert in der psychopharmakologischen Therapie unter anderem bei affektiven Störungen (mood stabilizer) und im Rahmen einer Alkohol-Entzugsbehandlung [17]. Bekannte UAW von Carbamazepin sind (initiale) Sedierung, Ataxien, Hyponatriämien, Leberenzym-Erhöhungen, hämatologische Komplikationen und – besonders häufig – hautallergische Reaktionen bis hin zum Lyell-Syndrom und Stevens-Johnson-Syndrom [2].
Bei dem hier dargestellten Fall lag nach dem klinischen Bild und den erhöhten Blutspiegeln eine Carbamazepin-Intoxikation als schwere UAW vor. Nach Mise et al. [11] können schwerwiegende, lebensbedrohliche Komplikationen einer Carbamazepin-Intoxikation bei einem Serumspiegel von >170 µmol/l auftreten.
Die Intoxikation könnte zum einen durch einen additiven Effekt bedingt sein; die Dosis der schon länger vorbestehenden Carbamazepin-Medikation war kurz zuvor erhöht worden, parallel wurden sedierende Substanzen (Diazepam, Gabapentin, Levomethadon) gegeben. Zusätzlich waren mutmaßlich mehrere pharmakokinetische Interaktionseffekte von entscheidender Relevanz.
Carbamazepin erreicht in der hier applizierten Tablettenform (Tegretal®) seinen maximalen Plasmaspiegel nach etwa acht Stunden. Der Metabolismus ist komplex und kann sowohl die Induktion als auch die Inhibition abbauender Enzyme beinhalten [15, 21]. Beschrieben wurde eine Induktion der Cytochrom-P450-(CYP-) Isoenzyme CYP2C9/10, CYP3A4 und anderer oxidativer Enzyme in der Leber [10]. Umgekehrt lassen Beobachtungen bei verschiedenen Kombinationstherapien auf eine Enzyminhibition durch Carbamazepin schließen [20].
Der Metabolismus von Carbamazepin kann durch zahlreiche Medikamente gehemmt werden.
Bei Carbamazepin-Interaktionen ist das CYP3A4-System von entscheidender Bedeutung [3]. Dieses hepatische Cytochrom ist entscheidend für die Verstoffwechselung von Carbamazepin zum aktiven Metaboliten Carbamazepin-10,11-epoxid [10].
Joos [9] beschrieb pharmakokinetische Interaktionen von Carbamazepin mit Antibiotika, insbesondere Makrolid-Antibiotika (z.B. Erythromycin), aber auch mit Antimykotika wie Ketoconazol durch CYP3A4-inhibitorische Effekte.
Rosenstiel und Adam [19] haben klinisch relevante Interaktionen von Makrolid-Antibiotika wie Clarithromycin und Erythromycin zusammenfassend dargestellt. Kombinationstherapien mit Carbamazepin führten mit am häufigsten zu schweren UAW. O’Connor und Fris [14] analysierten retrospektiv die Interaktion zwischen Carbamazepin und Clarithromycin. Bei allen Patienten fanden sie zum Teil deutliche Carbamazepinspiegel-Anstiege trotz vorheriger Dosisreduktion. Die Autoren empfahlen neben einem intensiven Drug-Monitoring eine Dosisreduktion von Carbamazepin um 30 bis 50%. Yasui und Mitarbeiter [23] untersuchten sieben Patienten mit der Medikamentenkombination Carbamazepin (600 mg/d) und Clarithromycin (400 mg/d). Vier Patienten entwickelten Carbamazepin-induzierte UAW, die Carbamazepin-Plasmakonzentrationen waren durchschnittlich doppelt so hoch wie bei späteren Kontroll-Blutspiegelbestimmungen nach Absetzen des Antibiotikums. Grundsätzlich ist das Interaktionsrisiko unter Erythromycin deutlich erhöht [6]. In Kasuistiken wurden mehrfach schwere Carbamazepin-Intoxikationen bei der Komedikation mit Erythromycin dokumentiert [1, 12, 22].
Auch über die Wechselwirkung mit anderen Antiinfektiva liegen Publikationen vor. Patterson [16] analysierte pharmakokinetische Interaktionen zwischen Metronidazol und Carbamazepin. Nair und Morris [13] berichteten über eine akute Carbamazepin-Intoxikation nach mehrjähriger komplikationsloser Einnahme von Carbamazepin nach einer parallelen Einnahme des Antimykotikums Fluconazol, das wie Metronidazol einen Imidazolring enthält. Als Ursache wurde jeweils eine CYP3A4-Inhibition betont. Bei der hier beschriebenen Patientin besteht zusätzlich der Verdacht auf einen Anstieg des Methadon-Spiegels infolge einer CYP3A4-Inhibition durch Erythromycin beziehungsweise Metronidazol [21]. Möglicherweise sind zumindest Teilsymptome der Intoxikation dadurch zusätzlich verstärkt worden.
Relevante pharmakokinetische Interaktionen unter Gabapentin sind nicht bekannt [7].
Insgesamt sind die genannten pharmakokinetischen Interaktionen von besonderer, möglicherweise interdependenter Komplexität, weil zwei unterschiedliche internistische Substanzen die Metabolisierung sowohl von Carbamazepin als auch potenziell von Methadon beeinflusst haben könnten.
Durch die Dokumentation der Blutspiegel konnte eine Inhibition des enzymatischen Abbaus von Carbamazepin nachgewiesen werden. Die klinische Symptomatik und das rasche Abklingen der UAW nach Absetzen sprechen für eine Carbamazepin-Intoxikation. Der zeitliche Verlauf bis zum Auftreten der UAW war relativ lang; engmaschige Konzentrationsmessungen vor Auftreten der UAW zeigten Plasmawerte im so genannten therapeutischen Bereich.
Als zusätzlicher organischer Risikofaktor bestand bei der Patientin eine ausgeprägte Vorschädigung der Leber (Leberzirrhose, Hepatitis B).
Die Kasuistik unterstreicht die klinische Relevanz internistischer Komedikationen bei einer psychopharmakologischen Therapie und die komplexe Problematik pharmakokinetischer Wechselwirkungen. Daneben besitzen weitere Faktoren wie Komorbiditäten, Organvorschädigungen, Alter und potenzielle pharmakogenetische Polymorphismen eine zusätzliche große Bedeutung. Grundsätzliche Kenntnisse pharmakologischer Interaktionen sind zwar in den letzten Jahren durch Untersuchungen der beteiligten Enzymsysteme gewachsen, die Beachtung von Interaktionsrisiken ist Bestandteil von präklinischen Prüfungen [8, 18], Einzelfallbeobachtungen und systematische Arzneimittel-Überwachungsprojekte haben aber entscheidende Bedeutung gerade bei der Komplexität von Kombinationstherapien, (elektronische) Interaktions-Datenbanken bekommen einen zunehmenden Stellenwert. Inzwischen liegen mehrere praktikable Datenbanken im Internet sowie umfangreiche Interaktionstabellen vor [21].
Die klinische Relevanz des therapeutischen Drug-Monitorings für die Einschätzung und Kausalitätsbeurteilung, aber auch für die potenzielle Vermeidung einer UAW wird durch die vorliegende Kasuistik gut veranschaulicht.
Literatur
1. Berrettini WH. A case of erythromycin-induced carbamazepine toxicity. J Clin Psychiatry 1986;47:147.
2. Devi K, George S, Criton S, et al. Carbamazepine – the commonest cause of toxic epidermal necrolysis and Stevens-Johnson syndrome: a study of 7 years. Indian J Dermatol Venereol Leprol 2005;71:325–8.
3. Dresser GK, Spence JD, Bailey DG. Pharmacokinetic-pharmacodynamic consequences and clinical relevance of cytochrome P450 3A4 inhibition. Clin Pharmacokinet 2000;38:41–57.
4. Grohmann R, Engel RR, Rüther E, Hippius H. The AMSP Drug Safety Program: methods und global results. Pharmacopsychiatry 2004;37(Suppl 1):4–11.
5. Grohmann R, Engel RR, Geissler KH, Rüther E. Psychotropic drug use in psychiatric inpatients: recent trends and changes over time-Data from the AMSP Study. Pharmacopsychiatry 2004;37(Suppl 1): 27–38.
6. Gurevitz SL. Erythromycin: drug interactions. J Dent Hyg 1997;71:159–61.
7. Hachad H, Ragueneau-Majlessi I, Levy RH. New antiepileptic drugs: review on drug interactions. Ther Drug Monit 2002;24:91–103.
8. Hiemke C, Dragicevic A, Sachse J, Härtter S. Wechselwirkungen bei der Psychopharmakotherapie. Arzneimitteltherapie 2003;11:331–5.
9. Joos AA. Pharmakologische Interaktionen von Antibiotika und Psychopharmaka. Psychiatr Prax 1998;25:57–60.
10. Levy RH. Cytochrome P450 isozymes and antiepiletic drug interactions. Epilepsia 1995;36:8–13.
11. Mise S, Jukic I, Tonkic A, et al. Multidose activated charcoal in the treatment of carbamazepine overdose with seizures: a case report. Arh Hig Rada Toksikol 2005;56:333–8.
12. Mota CR, Carvalho C, Mota C, et al. Severe carbamazepine toxicity induced by concurrent erythromycin therapy. Eur J Pediatr 1996;155:345.
13. Nair DR, Morris HH. Potential fluconazole-induced carbamazepine toxicity. Ann Pharmacother 1999;33:790–2.
14. O’Connor NK, Fris J. Clarithromycin-carbamazepine interaction in a clinical setting. J Am Board Fam Pract 1994;7:489–92.
15. Oesterheld J, Osser D, Sandson N. P450 drug interactions. Mental Health Connections Inc, 2004.
16. Patterson BD. Possible interaction between metronidazole and carbamazepine. Ann Pharmacother 1994;28:1303–4.
17. Polycarpou A, Papanikolaou P, Ioannidis JP, et al. Anticonvulsants for alcohol withdrawal. Cochrane Database Syst Rev 2005.
18. Ramanathan M. A method for estimating pharmacokinetic risks of concentration-dependent drug interactions from preclinical data. Drug Metab Disposition 1999;27:1479–87.
19. von Rosenstiel NA, Adam D. Macrolide antibacterials. Drug interactions of clinical significance. Drug Saf 1995;13:105–22.
20. Spina E, Pisani F, Perucca E. Clinically significant pharmacokinetic drug interactions with carbamazepine. An update. Clin Pharmacokinet 1996;31:198–214.
21. Stockley I. Drug Interactions 6th Edition. Nottingham: Pharmaceutical Press, 2002.
22. Wynn RL. Serious erythromycin interactions caused by inhibition of drug metabolism in the liver. Gent Dent 1996;44:486–8, 490.
23. Yasui N, Otani K, Kaneko S, et al. Carbamazepine toxicity induced by clarithromycin coadministration in psychiatric patients. Int Clin Psychopharmacol 1997; 12: 225–9.
Dr. med. Detlef Degner, Prof. Dr. med. Eckart Rüther, Klinik für Psychiatrie und Psychotherapie der Georg-August-Universität Göttingen, Von-Siebold-Str. 5, 37075 Göttingen, E-Mail: ddegner@gwdg.de Dr. med. Renate Grohmann, Klinik für Psychiatrie und Psychotherapie der Ludwig-Maximilians-Universität München, Nussbaumstr. 7, 80336 München Udo Reulbach, M.Sc., Psychiatrische und Psychotherapeutische Klinik der Friedrich-Alexander-Universität Erlangen-Nürnberg, Schwabachanlage 6, 91054 Erlangen Merle Haust, Klinik für Dermatologie und Venerologie der Heinrich-Heine-Universität Düsseldorf, Moorenstr. 5, 40225 Düsseldorf
Psychopharmakotherapie 2006; 13(04)
