Hans-Jürgen Möller, München, und Edith Schneider, Bad Homburg
Die Depression gehört zu den häufigsten psychiatrischen Krankheitsbildern. In der deutschen Bevölkerung liegt die Prävalenz bei 11,5% [46]. Nach internationalen, von der Weltgesundheitsorganisation (WHO) erhobenen Daten, leiden weltweit 5 bis 10% der Bevölkerung an einer behandlungsbedürftigen depressiven Störung [49]. Dabei wird das Risiko, an einer Depression zu erkranken, in den kommenden Jahren weiter zunehmen. Einer Prognose der WHO zufolge wird die Depression in Europa in den nächsten Jahren zur Volkskrankheit Nummer 1 avancieren [31].
Psychische und körperliche Symptome der Depression
Die Depression ist ein komplexes Krankheitsbild und weit mehr als eine rein psychische Erkrankung. Neben den psychischen Symptomen, wie Antriebsarmut, gedrückte Stimmung, Interessenverlust, Angst und Schuldgefühle, klagen die Patienten sehr oft auch über körperliche Symptome: allgemeines Krankheitsgefühl, Appetit- und Gewichtsveränderungen, Konzentrationsstörungen, erhöhte Ermüdbarkeit und insbesondere auch über Schmerzen (z.B. Rücken-, Gelenk-, Bauch-, Brust- oder Kopfschmerz). Über verschiedene Studien hinweg reichen die Prävalenzraten von depressiven Patienten mit körperlicher Begleitsymptomatik von 15 bis 100% (im Mittel 65% [2]). In anderen Studien konnte gezeigt werden, dass mit der zunehmenden Anzahl körperlicher Beschwerden das Risiko, an einer Depression zu erkranken, ansteigt [25]. Körperliche Symptome sind für nahezu drei Viertel aller depressiven Patienten (69%) der alleinige Grund, ihren Hausarzt aufzusuchen [38].
Körperliche Symptome der Depression wurden unterschätzt
Die Bedeutung der körperlichen Symptome, insbesondere der Schmerzen im Rahmen der Depression, wurde lange Zeit unterschätzt. Der traditionelle Fokus der behandelnden Ärzte auf die psychische Symptomatik der Depression führte zu einem mangelnden Problembewusstsein für schmerzhafte körperliche Symptome. So leiden vor Diagnosestellung einer Depression etwa 30% der Patienten bereits seit mehr als fünf Jahren an körperlichen Symptomen [27]. Das fehlende Bewusstsein für diese Symptome führt oft zu Fehldiagnosen, inadäquaten Behandlungsansätzen [24] und resultiert in einer großen Anzahl von Patienten mit Restsymptomen [35]. Diese Patienten haben jedoch nicht nur eine verminderte Lebensqualität, sondern auch ein erhöhtes Risiko für depressive Rezidive [6].
Studien weisen darauf hin, dass sich eine ungenügende Behandlung von Schmerzen im Rahmen der Depression negativ auf den Behandlungserfolg der Depression auswirkt [3, 13]. Der Behandlung schmerzhafter Symptome bei depressiven Patienten sollte deswegen eine deutlich höhere Aufmerksamkeit gewidmet werden [2, 26].
Biologischer Zusammenhang von psychischen und körperlichen Symptomen
Die beiden Neurotransmitter Serotonin (5-HT) und Noradrenalin (NA) scheinen sowohl für die Entstehung der psychischen als auch der körperlichen Symptome im Rahmen der Depression verantwortlich zu sein. Schon lange wird eine Dysfunktion von 5-HT und NA im Gehirn als entscheidende biologische Ursache für die Entstehung einer Depression angesehen (Monoamin-Hypothese) [20].
Diese Dysfunktion von 5-HT und NA spielt offensichtlich aber auch bei den körperlichen Symptomen, insbesondere den Schmerzen im Rahmen der Depression, eine zentrale Rolle. Die serotonergen und noradrenergen Nervenbahnen mit ihrem Ursprung in den Raphe-Kernen und im Locus coeruleus projizieren nicht nur in die zentrale Schaltstelle für Emotionen, das limbische System, sondern über deszendierende Bahnen auch in das Rückenmark und modulieren vermutlich hier das Schmerzempfinden über die Beeinflussung afferenter Schmerzbahnen. Durch einen Mangel an 5-HT und NA kann an dieser Stelle der physiologische inhibitorische Effekt dieser Neurotransmitter auf die Schmerzbahn fehlen, so dass normalerweise nicht schmerzhafte körperliche Reize als schmerzhaft wahrgenommen werden [39].
Das bedeutet, dass – insbesondere im Vergleich zu selektiven Serotonin-Wiederaufnahmehemmern (SSRI) – ein Antidepressivum mit einem dualen Wirkungsmechanismus, das 5-HT und NA gleichermaßen beeinflusst, möglicherweise eine umfassendere und wirksamere Behandlung psychischer und körperlicher Symptome der Depression erlaubt.
Das dual wirksame Antidepressivum Duloxetin
Duloxetin hemmt die Wiederaufnahme von 5-HT und NA in verschiedenen Transportermodellen und steigert in vivo die extrazelluläre Konzentration von 5-HT und NA im Hypothalamus und im präfrontalen Kortex [5]. Bei einer ausgewogenen hohen Bindungsaffinität zu serotonergen und noradrenergen Transportern zeigt Duloxetin keine signifikante Affinität zu muscarinergen, histaminergen und cholinergen Rezeptoren [37]. Verglichen mit dem selektiven Serotonin-Noradrenalin-Wiederaufnahmehemmer (SSNRI) Venlafaxin (Trevilor®), das erst bei höheren Dosen (>150 mg) eine ausreichende Bindung an den noradrenergen Transporter zeigt [4, 23], ermöglicht die ausgeglichene Affinität von Duloxetin zu den 5-HT- und NA-Transportern ein duales Wirkungsprinzip von Therapiebeginn an.
Die Wirksamkeit und Verträglichkeit von Duloxetin wurde in einer Reihe von kontrollierten Doppelblindstudien [7, 8, 14, 28, 33] und Langzeitstudien [9, 36] nachgewiesen. Duloxetin ist zur Behandlung von depressiven Episoden seit August 2004 in den USA und seit Dezember 2004 in Europa zugelassen.
Antidepressive Wirksamkeit
Gemessen mit der 17-Item-Version der Hamilton-Depressionsskala (HAMD17) besserte sich die depressive Symptomatik unter der Duloxetin-Therapie (60 mg/d) nach zwei Wochen signifikant im Vergleich zu Plazebo (p<0,001; Abb. 1) [7]. Der zeitliche Verlauf der einzelnen psychischen und körperlichen Beschwerden wurde in einer gepoolten Analyse von Hirschfeld et al. [21] genauer untersucht. Bereits in der ersten Behandlungswoche besserten sich unter der Duloxetin-Therapie die HAMD17-Items depressive Stimmung, Schuldgefühle, Suizidgedanken, Arbeit/Aktivität, psychische Angst sowie auf der visuellen Analogskala (VAS) Rücken- und Schulterschmerzen signifikant im Vergleich zu Plazebo.
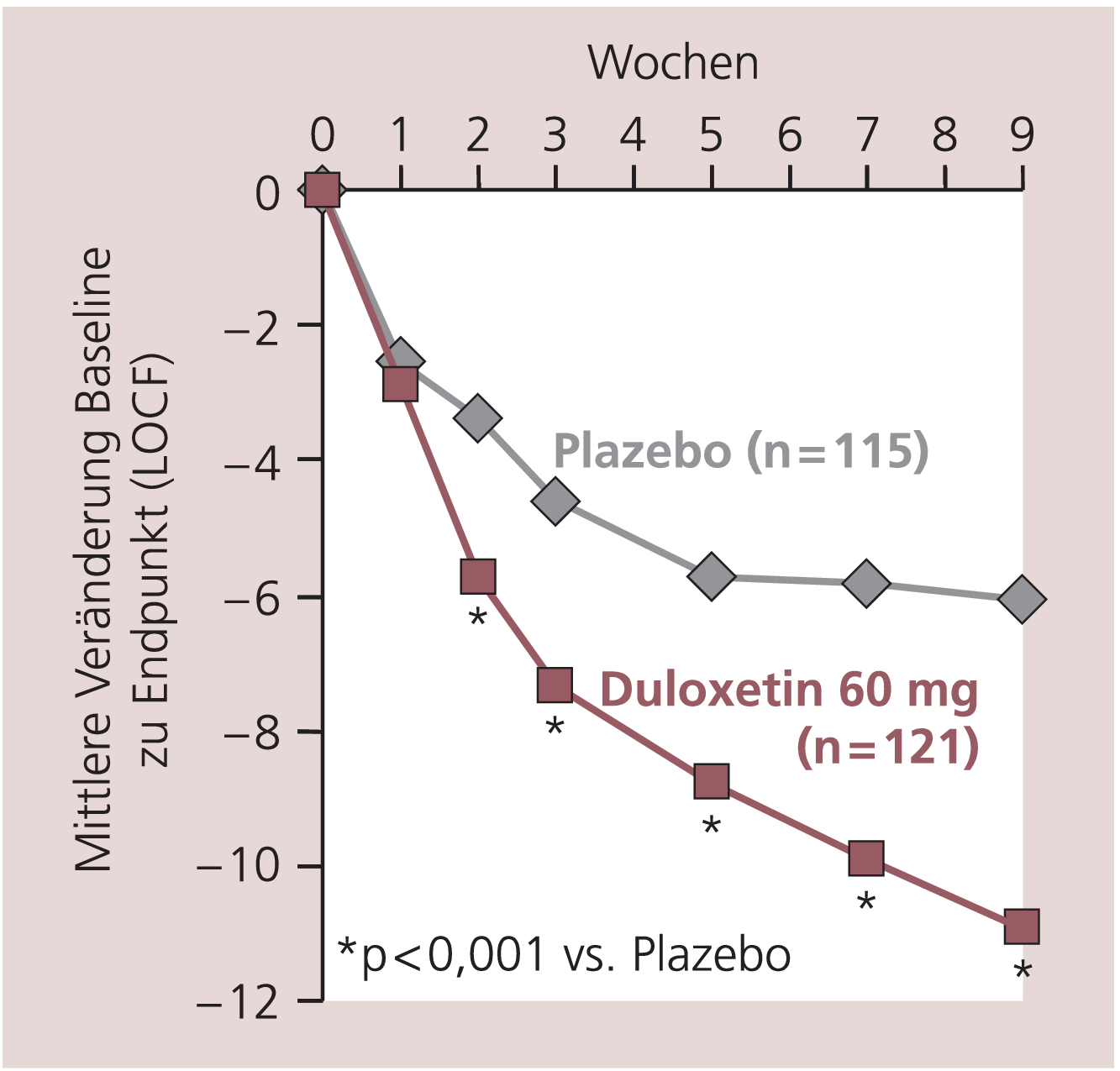
Abb. 1. Antidepressive Wirksamkeit von Duloxetin 60 mg im Vergleich zu Plazebo (HAMD17)
Das Ziel jeder antidepressiven Therapie ist die Remission, das heißt Symptomfreiheit, definiert als ein Gesamtpunktwert auf der Hamilton-Depressionsskala (HAMD17) ≤7. Dieses Ziel wird derzeit aber lediglich bei etwa einem Drittel der Patienten erreicht [34].
Die Remissionsraten in den Plazebo-kontrollierten Zulassungsstudien lagen unter der Duloxetin-Therapie zwischen 43 und 57% [28]. Mit der empfohlenen Duloxetin-Standarddosis von 60 mg/d erreichte nahezu die Hälfte aller Patienten (44%) innerhalb von 9 Wochen eine Remission. Damit wurde eine nahezu dreimal höhere Remissionsrate erzielt als unter Plazebo (16%; p<0,001) [7].
Eine gepoolte Analyse aus sechs randomisierten, Plazebo-kontrollierten Doppelblindstudien zeigte für die Remissionsraten auch eine nummerische Überlegenheit von Duloxetin gegenüber den SSRI Paroxetin und Fluoxetin (43 vs. 38% SSRI vs. 28% Plazebo) [42]. Eine Subgruppenanalyse der Patienten mit mittelschwerer und schwerer Depression (HAMD ≥19) fand sogar signifikante Unterschiede in der Remissionsrate (Duloxetin 38% vs. SSRI 29%, p=0,013) [42]. Dieser Therapieerfolg war unabhängig von der Vortherapie, die Remissionraten von SSRI-naiven und SSRI-vorbehandelten Patienten waren vergleichbar [40].
Eine Studie zur Rückfallprävention zeigte auch bei der Langzeitbehandlung eine gute Wirksamkeit von Duloxetin [7, 12]. Patienten, die auf eine 12-wöchige Akuttherapie mit Duloxetin 60 mg/d ansprachen, erhielten für weitere sechs Monate randomisiert Duloxetin oder Plazebo. Unter der Duloxetin-Therapie erlitten signifikant weniger Patienten einen depressiven Rückfall (17% vs. Plazebo 29%, p=0,004). Diese Langzeitergebnisse wurden in einer weiteren Studie im Vergleich zu Plazebo bestätigt [8].
Wirksamkeit von Duloxetin auf Schmerzen im Rahmen der Depression
Die Wirksamkeit von Duloxetin auf körperliche Beschwerden, insbesondere Schmerzen im Rahmen der Depression, wurde nicht nur anhand von Depressionsskalen untersucht (i.e. Item 13 des HAMD17), sondern gezielt auch mit Schmerzskalen, unter anderen der VAS, evaluiert [17].
Unter der Duloxetin-Therapie zeigte sich eine deutliche Reduktion der schmerzhaft körperlichen Symptome. Im Verlauf einer 9-wöchigen Behandlung wurden für die einzelnen Schmerzparameter (z.B. Gesamtschmerz, Rücken-, Schulterschmerz) im Mittel Verbesserungen bis zu 46% auf der VAS im Vergleich zum Ausgangswert erreicht [33]. Der signifikante Behandlungserfolg im Vergleich zu Plazebo stellte sich für die Rückenschmerzen bereits innerhalb der ersten Woche ein und blieb unverändert bis zum Ende der 9-wöchigen Beobachtungsdauer erhalten [7].
Direkte Schmerzwirkung
Es liegt nahe, die Verbesserung der körperlich schmerzhaften Beschwerden unter der Duloxetin-Therapie der Verbesserung der allgemeinen depressiven Symptomatik zuzuschreiben. Eine Pfadanalyse zeigte jedoch, dass Duloxetin nicht nur diese indirekte Wirkung auf die Schmerzen hat, sondern dass auch ein direkter analgetischer Effekt vorliegt [13]. Den Ergebnissen dieser Pfadanalyse zufolge ist die Reduktion des Gesamtschmerzes etwa zur Hälfte (51%) durch eine direkte analgetische Wirkung von Duloxetin zu erklären, während die andere Hälfte (49%) durch einen indirekten Effekt über die antidepressive Wirkung zu erklären ist (Abb. 2). Die direkte Schmerzreduktion bei Rücken- und Schulterschmerzen war mit (61 bzw. 59%) noch höher [47].
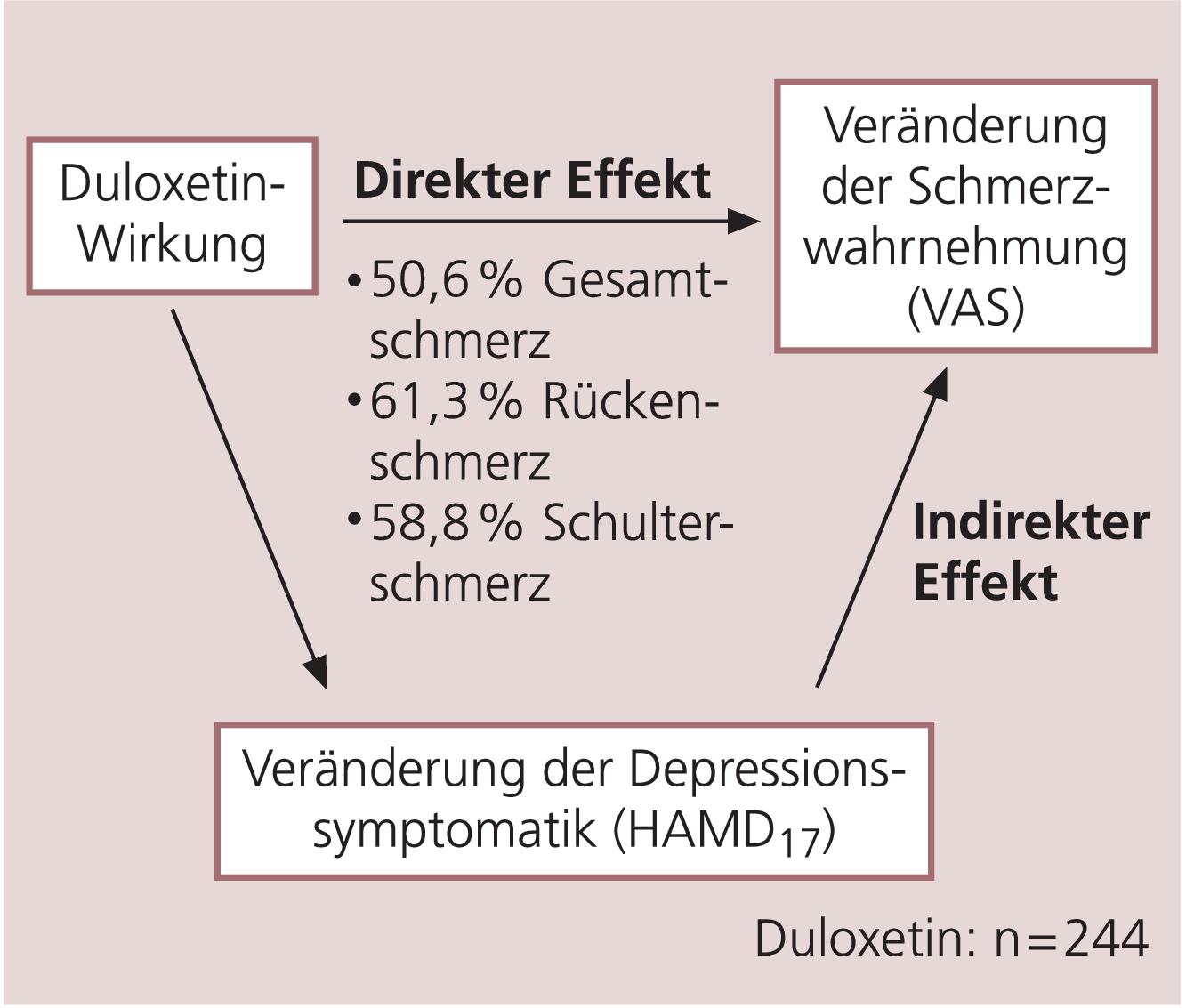
Abb. 2. Direkte und indirekte Effekte von Duloxetin auf Schmerzen im Rahmen einer Depression (Modell)
Für eine direkte Wirkung von Duloxetin auf die Schmerzen im Rahmen der Depression spricht auch der diesbezüglich frühe Wirkungseintritt. So zeigte sich für Rückenschmerzen schon nach einer Woche eine signifikante Verbesserung, während die allgemeine depressive Symptomatik (gemessen anhand der HAMD17) erst nach zwei Wochen signifikant gebessert war [7].
Wirksamkeit auf chronische Schmerzerkrankungen
Aufgrund seines dualen Wirkungsmechanismus und präklinischer Untersuchungen (positive Ergebnisse in einer Reihe von chronischen Schmerzmodellen) [22] wurde Duloxetin in einer reinen Schmerzindikation, Schmerzen im Rahmen der diabetischen Polyneuropathie, untersucht. In einer Dosisfindungsstudie reduzierte Duloxetin dosisabhängig die Schmerzen mit einer im Vergleich zu Plazebo signifikanten Wirkung ab 60 mg/d ab Woche 1 über den gesamten Verlauf der 3-monatigen Behandlung. Die nachfolgenden Studien konnten dieses gute Ergebnis bestätigen (Abb. 3) [15, 45]. In den USA ist Duloxetin seit August 2004 für diese Indikation zugelassen, seit Juli 2005 auch in Deutschland.
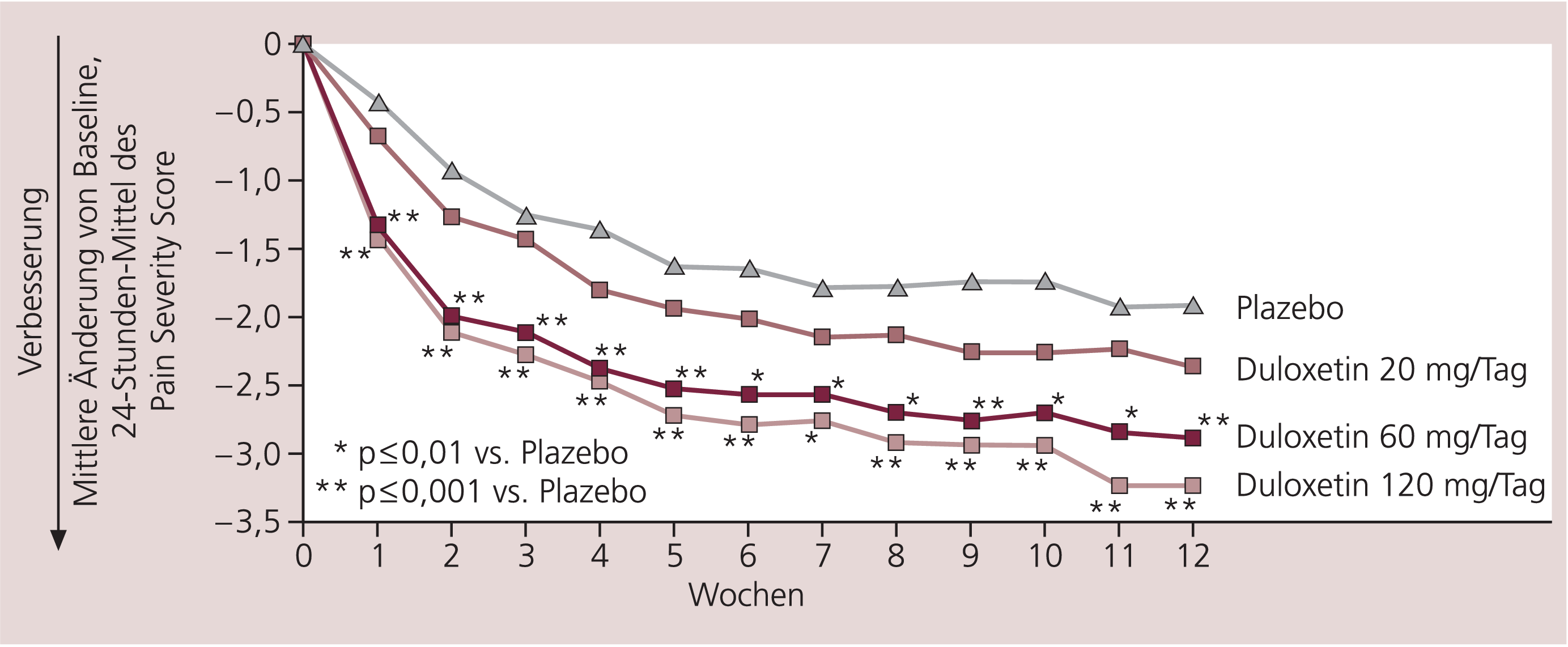
Abb. 3. Dosisabhängige Wirksamkeit von Duloxetin vs. Plazebo auf Schmerzen bei diabetischer Neuropathie
Auch gibt es erste positive Studienergebnisse bei Patienten mit primärer Fibromyalgie. Duloxetin war wirksam bei vielen Symptomen, die mit der Fibromyalgie einhergehen, und zwar unabhängig vom Vorliegen einer depressiven Erkrankung [1].
Duale Antidepressiva erzielen höhere Remissionsraten
Die potenzielle Überlegenheit eines dualen serotonerg-noradrenergen Wirkungsmechanismus wurde bereits durch eine Reihe klinischer Studien belegt [44]. So unter anderem durch Metaanalysen von 25 bzw. 32 Doppelblindstudien, in denen Remissionsraten verglichen wurden. Demzufolge ist die Remissionsrate unter einer Behandlung mit SSRI geringer als unter der Behandlung mit dual und selektiv wirksamen Antidepressiva (SSNRI) [41, 42]. Auch durch die gleichzeitige Gabe eines auf das serotonerge und eines auf das noradrenerge System zielenden Antidepressivums (SSRI: Fluoxetin + SNRI: Desipramin) konnte eine höhere Remissionsrate erzielt werden als mit Fluoxetin allein [32, 44].
Die modernen SSRI bieten zwar eine gute Wirksamkeit auf die psychischen Symptome der Depression, zeigen aber im Vergleich zu dual wirksamen Substanzen und den trizyklischen Antidepressiva eine geringere Wirkung auf körperliche Symptome und Schmerzen im Rahmen einer depressiven Erkrankung [18].
Auch die älteren trizyklischen Antidepressiva wirken teilweise „dual“, sind aufgrund der geringen Selektivität der Substanzen jedoch mit einer breiten Palette von Nebenwirkungen assoziiert, was sich in vielen Fällen nachteilig auf die Compliance der Patienten auswirkt [30]. Als besonders problematisch bei der Behandlung mit trizyklischen Antidepressiva müssen dabei neben subjektiv belastenden Nebenwirkungen wie Mundtrockenheit, Sedierung und Gewichtszunahme vor allem mögliche kardiovaskuläre Nebenwirkungen und die hohe Toxizität bei Überdosierung angesehen werden.
Eine selektive Modulation der serotonergen und noradrenergen Transmittersysteme durch balancierte SSNRI, wie beispielsweise Duloxetin, sollte die gute Wirksamkeit der trizyklischen Antidepressiva mit der guten Verträglichkeit der SSRI verbinden.
Gute Verträglichkeit
Die Sicherheit und Verträglichkeit von Duloxetin wurde in unterschiedlichen Dosen (bis zu 120 mg/d) in Plazebo-kontrollierten Studien und einer offenen Langzeitstudie über ein Jahr untersucht. Duloxetin zeichnet sich durch ein den neueren selektiv wirksamen Substanzen vergleichbares Verträglichkeitsprofil aus. Die Verträglichkeit ist auch bei Patienten in höherem Alter (≥65) vergleichbar zu jüngeren Patienten (18–64 Jahre) [48].
Im Gegensatz zu vielen älteren trizyklischen Antidepressiva hat Duloxetin keine sedierende Wirkung [4, 12]. Die am häufigsten beobachtete Nebenwirkung war eine vorübergehende leichte bis moderate Übelkeit, die meist in den ersten ein bis zwei Tagen nach Behandlungsbeginn auftrat. Nach der ersten Behandlungswoche lag die Inzidenz der Übelkeit auf Plazebo-Niveau (Abb. 4). Die Abbruchrate in klinischen Studien aufgrund von Übelkeit war gering [19].
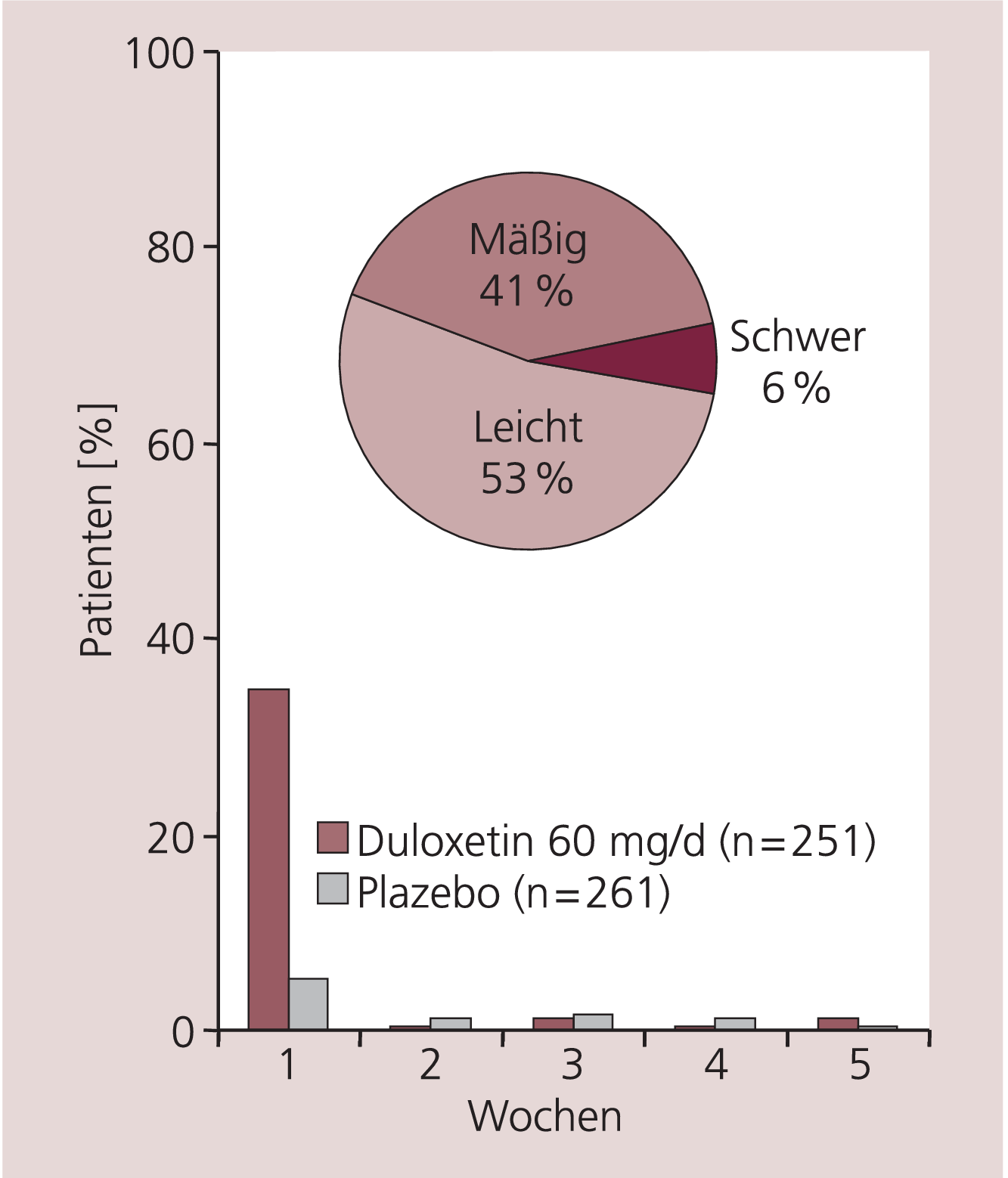
Abb. 4. Intensität und Dauer der Übelkeit bei der Gabe von Duloxetin 60 mg und Plazebo im Rahmen klinischer Studien in der Indikation Depression
Unter Duloxetin wurde keine signifikante Veränderung des QTc-Intervalls festgestellt, die QTc-Intervalle der mit Duloxetin behandelten Patienten unterschieden sich nicht von denen der mit Plazebo behandelten Patienten [12]. In den klinischen Studien wurden im Vergleich zu Plazebo signifikante, aber nicht klinisch relevante, mittlere Erhöhungen der Pulsrate (1,6 bpm), des systolischen (1,0 mmHg) und diastolischen (1,1 mmHg) Blutdrucks gemessen. Es gab keine signifikanten Unterschiede bezüglich anhaltender Blutdrucksteigerungen [43] und bei nur wenigen Patienten trat unter der empfohlenen Standarddosis von Duloxetin (60 mg/d) ein Hypertonus auf (0,8%) [8].
Sexuelle Funktionsstörungen werden nicht nur im Rahmen der depressiven Symptomatik, sondern sehr oft auch als Folge einer antidepressiven Therapie berichtet (z.B. bis zu 70% unter SSRI [29]). So können auch unter einer Duloxetin-Therapie sexuelle Funktionsstörungen auftreten, Männer werden davon häufiger betroffen als Frauen (17,7 vs. 2,9%) [12].
Unter Duloxetin kam es zu keiner klinisch relevanten Gewichtszunahme. Die gepoolten Daten aus den Kurzzeitstudien von 8- bis 12-wöchiger Dauer zeigten eine durchschnittliche Gewichtsabnahme von 0,5 kg [33]. In der offenen Ein-Jahres-Langzeitstudie wurde eine leichte mittlere Gewichtszunahme von 1,1 kg dokumentiert [36].
Fazit
Ziel sollte es heute sein, für jeden depressiven Patienten individuell die optimale Behandlung auszuwählen. Für die Wirksamkeit einer Behandlung sind dabei neben den psychischen auch die körperlichen Symptome, insbesondere die Schmerzen, im Rahmen der Depression zu berücksichtigen. In der nachgewiesenen direkten Beeinflussung beider Symptomgruppen scheint der besondere Vorteil von Duloxetin zu liegen. Dadurch könnte es mit Duloxetin gelingen, das Ziel der antidepressiven Pharmakotherapie – die Remission – häufiger zu erreichen. Aufgrund der guten Wirksamkeit auf die verschiedenen Symptome der Depression, insbesondere auch der Depressions-begleitenden schmerzhaften körperlichen Symptome, und der höheren Remissionsraten wird Duloxetin das pharmakotherapeutische Repertoire der Depressions-Behandlung, insbesondere bei Patienten mit begleitender Schmerzsymptomatik, positiv erweitern.
Literatur
1. Arnold LM, Lu Y, Crofford LJ, Wohlreich M, et al. A double-blind, multicenter trial comparing duloxetine with placebo in the treatment of fibromyalgia patients with or without major depressive disorder. Arthritis Rheum 2004;50:2974–84.
2. Bair MJ, Robinson RL, Katon W, Kroenke K. Depression and pain comorbidity: a literature review. Arch Intern Med 2003;163:2433–45.
3. Bair MJ, Robinson RL, Eckert GJ, Stang PE, et al. Impact of pain on depression treatment response in primary care. Psychosom Med 2004;66:17–22.
4. Benkert O, Hippius H. Kompendium der Psychiatrischen Pharmakotherapie. 4. Aufl. Berlin: Springer, 2003:28–9.
5. Bymaster FP, Dreshfield-Ahmad LJ, Thelkeld PG, Shaw JL, et al. Comparative affinity of duloxetine and venlafaxine for serotonin and norepinephrine transporters in vitro and in vivo, human serotonin receptor subtypes, and other neuronal receptors. Neuropsychopharmacology 2001;25:871–80.
6. Cornwall PL, Scott J. Partial remission in depressive disorders. Acta Psychiatr Scand 1997;95:265–71.
7. Detke MJ, Lu Y, Goldstein DJ, Hayes JR, et al. Duloxetine, 60 mg once daily, for major depressive disorder: A randomized double-blind placebo-controlled trial. J Clin Psychiatry 2002;63:308–15.
8. Detke MJ, Lu Y, Goldstein DJ, McNamara RK, et al. Duloxetine 60 mg once daily dosing versus placebo in the acute treatment of major depression. J Psychiatr Res 2002;36:383–90.
9. Detke MJ, Gilaberte I, Perahia DG, Wang F, et al. Duloxetine vs. placebo in the prevention of relapse of major depressive disorder. Eur Psychiatry 2004;19(Suppl 1):214s.
10. Detke MJ, Wiltse CG, Mallinckrodt CH, McNamara RK, et al. Duloxetine in the acute and long-term treatment of major depressive disorder: a placebo- and paroxetine-controlled trial. Eur Pharmacopsychiatry 2004;14:457–70.
11. Dunner DL, Goldstein DJ, Mallickrodt C, Lu Y, et al. Duloxetine in treatment of anxiety symptoms associated with depression. Depress Anxiety 2003;18:53–61.
12. Fachinformation Cymbalta, Stand September 2005.
13. Fava M, Mallinckrodt CH, Detke MJ, Watkin JG, et al. The effect of duloxetine on painful physical symptoms in depressed patients: Do improvements in these symptoms result in higher remission rates? J Clin Psychiatry 2004;65:521–30.
14. Goldstein DJ, Mallinckrodt C, Lu Y, Demitrack MA. Duloxetine in the treatment of major depressive disorder: a double-blind clinical trial. J Clin Psychiatry 2002;63:225–31.
15. Goldstein DJ, Lu Y, Detke MJ, Lee TC, et al. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain 2005;116:109–18.
16. Goldstein DJ, Lu Y, Detke MJ, Wiltse C, et al. Duloxetine in the treatment of depression: A double blind placebo-controlled comparison with paroxetine. J Clin Psychopharmacology 2004;24:389–99.
17. Goldstein DJ, Lu Y, Detke MJ, Hudson J, et al. Effects of duloxetine on painful physical symptoms associated with depression. Psychosomatics 2004;45:17–28.
18. Greco T, Eckert G, Kroenke K. The outcome of physical symptoms with treatment of depression. J Gen Intern Med 2004;19:813–8.
19. Greist J, McNamara RK, Mallinckrodt CH, Rayamajhi JN, et al. Incidence and duration of antidepressant-induced nausea: duloxetine compared with paroxetine and fluoxetine. Clin Ther 2004;26:1446–55.
20. Hirschfeld RMA. History and evolution of the monoamine hypothesis of depression. J Clin Psychiatry 2000;61(Suppl 6):4–6.
21. Hirschfeld RMA, Mallinckrodt CH, Lee TC, Clemens JW, et al. Early symptom response during treatment with duloxetine 60 mg QD: HAMD17 items. 157th Annual APA Meeting, 1. bis 6. Mai 2004, New York.
22. Iyengar S, Webster AA, Hemrick-Luecke SK, Xu JY, et al. Efficacy of duloxetine, a potent and balanced serotonin-norepinephrine reuptake inhibitor in persistent pain models in rats. J Pharmacol Exp Ther 2004;311:576–684.
23. Jain R. Single-action versus dual-action antidepressants. Prim Care Companion J Clin Psychiatry 2004;6(Suppl 1):7–11.
24. Kessler RC, Berglund P, Demler O, Jin R, et al. The epidemiology of major depressive disorder: results from the National Comorbidity Survey Replication (NCS-R). JAMA 2003;289:3095–105.
25. Kroenke K, Spitzer RL, Williams JB, Linzer M, et al. Physical symptoms in primary care. Predictors of psychiatric disorders and functional impairment. Arch Fam Med 1994;3:774–9.
26. Lepine JP, Biley M. The epidemiology of pain in depression. Hum Psychopharmacol 2004;19(Suppl 1):S3–S7.
27. Lesse S. The masked depression syndrome – results of a seventeen-year clinical study. Am J Psychother 1983;37:456–75.
28. Mallinckrodt CH, Goldstein DJ, Detke MJ, Lu Y, et al. Duloxetine: a new treatment for the emotional and physical symptoms of depression. Prim Care Companion, J Clin Psychiatry 2003;5:19–28.
29. Montejo AL, Llorca G, Izquierdo JA, Rico-Villademoros F. Incidence of sexual dysfunction associated with antidepressant agents: a prospective multicenter study of 1022 outpatients. J Clin Psychiatry 2001;62(Suppl 3):10–21.
30. Montgomery SA, Henry J, McDonald G, Dinan T, et al. Selective serotonin reuptake inhibitors: meta-analysis of discontinuation rates. Int Clin Psychopharmacol 1994;9:47–53.
31. Murray CJL, Lopez AD. The global burden of disease: a comprehensive assessment of mortality and disability from diseases, injuries, and risk factors in 1990 and projected to 2020. Harvard University Press, 1996.
32. Nelson JC, Mazure CM, Bowers MB jr., Jatlow PI. A preliminary, open study of the combination of fluoxetine and desipramine for rapid treatment of major depression. Arch Gen Psychiatry 1991;48:303–7.
33. Nemeroff CB, Schatzberg AF, Goldstein DJ, Detke MJ, et al. Duloxetine for the treatment of major depressive disorder. Psychopharmacol Bull 2002;36:106–32.
34. O’Reardon JP, Amsterdam JD. Treatment-resistant depression: progress and limitations. Psychiatr Ann 1998;28:633–40.
35. Paykel ES, Ramana R, Cooper Z, Hayhurst H, et al. Residual symptoms after partial remission: an important outcome in depression. Psychol Med 1995;25:1171–80.
36. Raskin J, Goldstein DJ, Mallinckrodt CH, Ferguson MB. Duloxetine in the long-term treatment of major depressive disorder. J Clin Psychiatry 2003;64:1237–44.
37. Richelson E. The clinical relevance of antidepressant interaction with neurotransmitter transporters and receptors. Psychopharmacol Bull 2002;36:140.
38. Simon GE, VonKorff M, Piccinelli M, Fullerton C, et al. An international study of the relation between somatic symptoms and depression. New Engl J Med 1999;341:1329–35.
39. Stahl SM. The psychopharmacology of painful physical symptoms in depression. J Clin Psychiatry 2002;63:382–3.
40. Swindle RW, Rosenbaum JF, Mallinckrodt CH, et al. Efficacy of duloxetine treatment: analysis of pooled data from six placebo and SSRI-controlled clinical trials. Int J Neuropsychopharmacol 2004;7(Suppl 1):P02.177.
41. Thase ME, Entsuah AR, Rudolph RL. Remission rates during treatment with venlafaxine or selective serotonin reuptake inhibitors. Br J Psychiatry 2001;178:234–40.
42. Thase M, Lu Y, Joliat M, Detke M. Remission rates in double-blind, placebo-controlled clinical trials of duloxetine with SSRI as a comparator. Eur Neuropsychopharmacol 2003;13(Suppl 4):S259.
43. Thase ME, Tran PV, Wiltse C, Pngallo BA, et al. Cardiovascular profile of duloxetine, a dual reuptake inhibitor of serotonin and norepinephrine. J Clin Psychopharmacol 2005;25:132–40.
44. Tran PV, Bymaster FP, McNamara RK, Potter WZ. Dual monoamine modulation for improved treatment of major depressive disorder. J Clin Psychopharmacol 2003;23:78–86.
45. Wernicke JF, Lu Y, D’Souza DN, Waninger A, et al. Duloxetine at doses of 60 mg QD and 60 mg BID is effective treatment of diabetic neuropathic pain. APA 2004, New York.
46. Wittchen H.-U. (Hrsg.). Depression 2000: Eine bundesweite Depressions-Screening-Studie in Allgemeinarztpraxen. MMW-Fortschritte der Medizin 2000;118(Suppl I):4–10.
47. Wohlreich MM, Mallinckrodt CH, Lu Y, Detke MJ. Efficacy of duloxetine (60 mg QD) in the treatment of painful physical symptoms in patients with major depression [Poster]. APA 2004, New York.
48. Wohlreich MM, Mallinckrodt CH, Watkin JG, Hay DP. Duloxetine for the long-term treatment of major depressive disorder in patients aged 65 or older: an open label study. BMC Geriatrics 2004;4:11.
49. World Health Organization. The World Health Report, 2001. Mental Health: New Understanding, New Hope. 2001.
Prof. Dr. med. Hans-Jürgen Möller, Klinik und Poliklinik für Psychiatrie und Psychotherapie der Ludwig-Maximilians-Universität München, Nussbaumstr. 7, 80336 München
Dr. med. Edith Schneider, Medizinische Abteilung Neurologie/Psychiatrie, Lilly Deutschland GmbH, Saalburgstr. 153, 61350 Bad Homburg
Duloxetine – a new selective and dual acting antidepressant: Good effectiveness not only on psychiatric but also on bodily symptoms of depression
Depression belongs to the disease states which are most common and whose severity is underestimated, and its importance will continue to increase in the upcoming years. Accordingly, there is an urgent need for new innovative options in pharmacotherapy, which do not only ameliorate depressive symptoms, but whose substantial efficacy on psychiatric and physical symptoms of depression will raise the chance for remission.
The new, dual acting, selective serotonin and norepinephrine reuptake inhibitor (SNRI) duloxetine (Cymbalta®) is characterized by good tolerability and high remission rates achieved but in particular by its good effectiveness on bodily symptoms, specifically painful physical symptoms of depression. The specific efficacy profile of duloxetine may help depressive patients to return to their daily life and to give them a good long-term prognosis.
Keywords: Depression, pain, reuptake-inhibitors, remission
Psychopharmakotherapie 2006; 13(01)
