Cathrin Rohleder, Sydney, und Juliane K. Müller, Frankfurt am Main
Medizinische Verwendung von Cannabis
Cannabis wird seit Jahrtausenden in vielfältiger Weise verwendet – als Lebensmittel, Faserlieferant zur Herstellung von Seilen und Textilien, Rauschmittel sowie für medizinische Zwecke [66]. Bereits im ältesten bekannten Arzneibuch „Sheng-Nung Pen-ts’ao Ching“ (erstellt 100 v. Chr., aber dem legendären Kaiser Shen-Nung (27. Jh. v. Chr.) zugeschrieben) sind Eintragungen über die medizinischen Eigenschaften der Pflanze und ihre psychotropen Nebenwirkungen bei exzessivem Gebrauch zu finden [66] und auch in grundlegenden Texten der ayurvedischen Medizin (z. B. „Susrita Samhita“, 800 v. Chr.) sowie alten ägyptischen Schriften (z. B. „Papyrus Ramesseum III“, 1700 v. Chr.) wurde bereits der medizinische Gebrauch von Cannabis beschrieben [56, 66]. Auslöser für die Einführung von Cannabis in die westliche Schulmedizin scheint schließlich 1842 der Bericht des in Kalkutta stationierten Arztes O’Shoughnessy gewesen zu sein, der verschiedene Cannabis-Präparate gegen Rheumatismus, Tollwut, Cholera, Tetanus und Delirium tremens bei Menschen einsetzte [56]. Bis Mitte des 20. Jahrhunderts wurden Cannabis-Produkte vielfältig als Arzneimittel verwendet (z. B. als Schlafmittel, Sedativum, Analgetikum oder zur Behandlung von Cholera, Tetanus und Gonorrhö), bis schließlich eine Vielfalt anderer Wirkstoffe mit besserer Wirkung und/oder pharmazeutischer Stabilität entwickelt wurde [56]. Außerdem wurden auf Basis der von 60 Nationen unterschriebenen „Single Convention of Narcotic Drugs“ (1961) rechtliche Einschränkungen bezüglich Besitzes, Verwendung, Handel, Import/Export und Produktion von Cannabis eingeführt.
Mittlerweile wurde der medizinische Gebrauch von Cannabis und Cannabinoiden in einigen Ländern wieder legalisiert und Cannabis-Zubereitungen zur Behandlung verschiedener Erkrankungen (multiple Sklerose, Epilepsie, Chemotherapie-bedingte Emesis und Nausea, Appetitlosigkeit und Gewichtsverlust bei HIV/AIDS-Patienten) zugelassen (Tab. 1) [66]. Das erste in Deutschland arzneimittelrechtlich zugelassene Cannabis-basierte Arzneimittel ist Sativex®, welches in bestimmten Fällen der Erkrankung an multipler Sklerose Anwendung findet. Im Januar 2017 wurde schließlich auch Canemes® für die Behandlung von Chemotherapie-bedingter Emesis und Nausea bei Krebs-Patienten zugelassen. In Europa wurde zudem Epidyolex® (Wirkstoff Cannabidiol) von der Europäischen Kommission für zwei seltene Epilepsieformen bei Kindern zugelassen (Tab. 1).
Tab. 1. Übersicht der in Deutschland verschreibungsfähigen Cannabis-Zubereitungen
|
Name |
Wirkstoff |
Indikation |
Zulassungsstatus |
|
Sativex® (auch Mevatyl® [Brasilien]) |
Cannabisextrakt, THC und CBD im Verhältnis 1 : 1 (Nabiximols) |
Mittelschwere bis schwere Spastik bei Patienten mit multipler Sklerose, die auf eine andere antispastische Therapie nicht angesprochen haben |
In Deutschland arzneimittelrechtlich zugelassen seit Juli 2011 |
|
Canemes® (auch Cesamet®) |
Nabilon, vollsynthetisches Delta-9-Tetrahydrocannabinol-Derivat |
Behandlung von Chemotherapie-bedingter Emesis und Nausea bei jenen Krebspatienten, die auf andere antiemetische Behandlungen nicht adäquat ansprechen |
In Deutschland arzneimittelrechtlich zugelassen seit Januar 2017 |
|
Epidyolex® |
Cannabidiol |
Seltene Epilepsieformen bei Kindern (Lennox-Gastaut-Syndrom, Dravet-Syndrom) |
In Europa durch die Europäische Kommission zugelassen seit September 2019 |
|
Dronabinol |
THC (Reinsubstanz) |
Behandlung von Chemotherapie-bedingter Emesis und Nausea sowie gegen Appetitlosigkeit und Gewichtsverlust bei HIV/AIDS-Patienten |
Nicht arzneimittelrechtlich zugelassen; verschreibungsfähiges Betäubungsmittel |
|
Medizinische Cannabis-Blüten |
Variable Zusammensetzung je nach Züchtung |
Ausnahmeerlaubnis zum Erwerb von Medizinal-Cannabis-Blüten im Rahmen einer ärztlich überwachten Selbsttherapie. Indikation nicht näher vom Gesetzgeber spezifiziert. |
Nicht arzneimittelrechtlich zugelassen; verschreibungsfähiges Betäubungsmittel |
|
Ölige Cannabidiol-Lösung |
Cannabidiol |
Ärztlich überwachte Selbsttherapie. Indikation nicht näher vom Gesetzgeber spezifiziert. |
Nicht arzneimittelrechtlich zugelassen; kein Betäubungsmittel, aber verschreibungspflichtig |
Bestandteile der Cannabis-Pflanze
Bei der Cannabis-Pflanze Cannabis sativa L. handelt es sich um eine hoch diverse Spezies zu der drei Varietäten gezählt werden: var. sativa, indica und ruderalis [22].
Obwohl Cannabis Mitte des 19. Jahrhunderts Einzug in die westliche Medizin erhielt, wurden die beiden relevantesten Bestandteile, die Phytocannabinoide Delta-9-Tetrahydrocannabinol (∆9-THC, im Weiteren kurz „THC“) und Cannabidiol (CBD), erst 1940 aus der Pflanze isoliert [2] und ihre exakte Molekülstruktur 1963 mittels Kernspinresonanzspektroskopie(NMR-Spektroskopie) aufgeklärt [58].
Mittlerweile wurden mehr als 560 Verbindungen verschiedenster chemischer Klassen (darunter Terpene, Flavonoide, Steroide, Phenole, Aminosäuren usw.) identifiziert [22], wobei die charakteristischste und für die medizinische Wirkung vermutlich relevanteste chemische Klasse die der Cannabinoide ist. Bis heute wurden insgesamt 120 verschiedene Phytocannabinoide isoliert, wobei elf verschiedene Typen unterschieden werden (Tab. 2) [22].
Tab. 2. Übersicht der verschiedenen Cannabinoid-Typen in Cannabis sativa L. [22, 82]
|
Cannabinoid-Typ |
Anzahl der verschiedenen Verbindungen |
|
(–)-Delta-9-trans-Tetrahydrocannabinol |
23 |
|
(–)-Delta-8-trans-Tetrahydrocannabinol |
5 |
|
Cannabigerol (CBG) |
16 |
|
Cannabichromen (CBC) |
9 |
|
Cannabidiol (CBD) |
7 |
|
Cannabinodiol (CBND) |
2 |
|
Cannabielsoin (CBE) |
5 |
|
Cannabicyclol (CBL) |
3 |
|
Cannabinol (CBN) |
11 |
|
Cannabitriol (CBT) |
9 |
|
Sonstige |
30 |
Der Gehalt der einzelnen Cannabis-Bestandteile ist höchst variabel. In Abhängigkeit vom Gehalt der beiden wichtigsten Cannabinoide (THC und CBD) werden drei verschiedene Cannabis-sativa-L.-Phänotypen unterschieden (Tab. 3) [15]: Drogen-, intermediärer und Faser-Hanf.
Tab. 3. Cannabis-sativa-L.-Phänotypen in Abhängigkeit vom THC- und CBD-Gehalt [15]
|
Phänotyp |
THC [%] |
CBD [%] |
|
Drogen-Hanf |
> 0,3 |
< 0,5 |
|
Intermediärer Hanf |
> 0,3 |
> 0,5 |
|
Faser-Hanf |
< 0,3 |
> 0,5 |
Nach einer weiteren Definition basierend auf dem Verhältnis von THC- und CBD-Gehalt wird hingegen nur zwischen Drogen- (THC/CBD > 1) und Faserhanf (THC/CBD < 1) unterschieden [15].
Obwohl Umweltfaktoren den Gehalt der Cannabinoide in den unterschiedlichen Teilen der Pflanze (Harz > Blüten > Blätter > Stiel > Wurzeln) während der verschiedenen Wachstumsphasen beeinflussen [7, 87], ist das Verhältnis der beiden Cannabinoide THC und CBD genetisch festgelegt [14].
Pharmakologie von Cannabis und Cannabinoiden
Aufgrund der äußerst lipophilen Eigenschaften der Phytocannabinoide ging man lange davon aus, dass sie ihre Wirkung unspezifisch ohne Rezeptorbeteiligung durch eine Veränderung der Zellmembranfluidität ausüben [36]. Studien zur biologischen Aktivität, die eine strikte Struktur- und Stereoselektivität von THC und synthetischen Analogons nachweisen konnten, lieferten schließlich erste klare Hinweise für das Vorhandensein von Ligand-Rezeptor-Interaktionen [38]. 1988 wurde erstmalig nachgewiesen, dass THC reversibel an einen G-Protein-gekoppelten Rezeptor bindet [19]. Wenig später wurde sowohl die Ratten- als auch die humane cDNA dieses ersten Cannabinoid-Rezeptors (CB1R) kloniert und exprimiert [27, 53]. Es dauerte allerdings vier weitere Jahre, bis der erste endogene CB1R-Ligand – Anandamid (Arachidonylethanolamid) – isoliert wurde [20]. Innerhalb der folgenden drei Jahre gelang zudem die Identifizierung eines zweiten Cannabinoid-Rezeptors (CB2R) [61] sowie eines weiteren endogenen Cannabinoids: 2-Arachidonyl-sn-glycerol (2-AG) [57, 80]. Die beiden Endocannabinoide (Anandamid, 2-AG), ihre synthetisierenden und abbauenden Enzyme sowie die Cannabinoid-Rezeptoren (CB1R, CB2R) bilden das Endocannabinoid-System (Abb. 1), welches in die Regulation diverser physiologischer und kognitiver Prozesse involviert ist [51, 71]. Dazu gehören unter anderem Schmerzwahrnehmung, Energiehomöostase, Appetit, Nahrungsaufnahme, Fettstoffwechsel, gastrointestinale und kardiovaskuläre Funktionen, Reproduktionsprozesse, Thermoregulation, Immunantwort, Schlaf-Wach-Rhythmus, Psychomotorik, Gedächtnisleistung, Emotionen und Stressantwort [51, 71]. Die Regulation solch vielfältiger Funktionen durch das Endocannabinoid-System erklärt auch das breite therapeutisches Wirkspektrum, das Cannabis-Zubereitungen zugesprochen wird, darunter analgetische, antiemetische, antikonvulsive, antiinflammatorische, antispastische, neuroprotektive, antiproliferative, anxiolytische und antipsychotische Wirkungen [10, 41, 72].
Zudem wurde eine Reihe weiterer molekularer Zielstrukturen außerhalb des Endocannabinoid-Systems identifiziert. Dazu gehören andere Rezeptoren, Ionenkanäle, Enzyme und Transporter, die die verschiedenen Cannabis-Wirkungen vermitteln [5, 82].
Das heißt, die Komplexität der Pharmakologie von Cannabis wird zum einen durch die Variabilität der Konzentration der einzelnen Cannabis-Bestandteile in Pflanzenteilen bzw. Cannabis-Vollextrakten bestimmt und zum anderen durch die polypharmakologischen Effekte der verschiedenen Phytocannabinoide bedingt, die möglicherweise zusätzlich durch Nicht-Cannabinoid-Bestandteile moduliert werden können [76].
Delta-9-Tetrahydrocannabinol (THC)
THC ist für die psychotomimetischen Wirkungen der Cannabis-Pflanze verantwortlich und hat analgetische, antispastische, sedierende, appetitsteigernde, antiemetische, antikonvulsive und möglicherweise neuroprotektive Eigenschaften.
In-vitro-Verdrängungsstudien mit radioaktiv markierten synthetischen Agonisten zeigen, dass THC ein moderater partieller CB1R- und CB2R-Agonist mit niedriger mikromolarer Affinität ist [19, 82] (Abb. 1). Der In-vivo-Nachweis der CB1R-Aktivierung durch THC erfolgte im Tiermodell unter Verwendung einer Verhaltenstestbatterie, die auch als Tetraden-Testbatterie oder „Billy Martin Tetrad“ bekannt ist [52]. THC führte in diesen Tests bei Mäusen ebenso wie spezifische synthetische CB1R-Agonisten zu (1) einer Inhibition der lokomotorischen Aktivität (Hypomobilität, Sedierung), (2) einer reduzierten Schmerzsensitivität (Analgesie), (3) einer reduzierten Körpertemperatur (Hypothermie) und (4) Immobilität (Katalepsie) [52, 83]. Diese Effekte ließen sich mit dem CB1R-Antagonisten (bzw. inversen Agonisten) Rimonabant blockieren [83].
Obwohl bisher nur wenig untersucht, geht man zurzeit davon aus, dass die antispastische Wirkung von THC ebenfalls CB1R-vermittelt ist. In einem tierexperimentellen Multiple-Sklerose-Modell wurde in Wildtyp-Mäusen, aber nicht in CB1R-defizienten Mäusen nach Gabe von synthetischen Cannabinoiden (non-selektive CB1R- und CB2R-Agonisten) ein antispastischer Effekt beobachtet [68].
Auch die appetitsteigernden Effekte von THC scheinen CB1R-vermittelt zu sein. In Ratten führt die Gabe von THC zur Hyperphagie [42, 85] und dieser Effekt lässt sich durch die Gabe von Rimonabant blockieren [42].
Die THC-induzierten psychotomimetischen, Psychose-artigen Symptome bei Menschen [3] werden ebenfalls durch die Aktivierung der CB1R ausgelöst [11, 13]. Eine höhere CB1R-Bindungsaffinität, wie sie einige synthetische Cannabinoide aufweisen, die immer wieder als legaler Ersatz für Cannabis („Legal High“) auf den Markt kommen (z. B. JWH-018 [„Spice“], CP 47,497-C8 [„K2“], AB-FUBINACA oder AMB-FUBINACA), geht demgemäß mit einer verstärkten psychotropen Wirkung sowie stärkeren unerwünschten Wirkungen einher [1, 4].
Zahlreiche In-vitro-Studien zeigen, dass THC auch über CB1R-unabhängige Mechanismen seine Wirkung entfalten kann [82], wobei die physiologische Relevanz der Aktivierung durch THC noch nicht für alle Zielstrukturen gut untersucht ist (z. B. G-Protein-gekoppelter Rezeptor (GPR) 55, GPR18, Transientes-Rezeptor-Potential[TRP]-Kationenkanal). Dass allerdings die Aktivierung der CB1R nicht der einzige Wirkungsmechanismus von THC ist, belegt auch eine Studie an CB1R-Knockout-Mäusen, in der die Tiere trotz CB1R-Knockout weiterhin THC-induzierte Analgesie im sogenannten „Tail-flick-Test“ zeigten, aber die THC-Gabe keine Katalepsie, Hypomobilität oder Hypothermie auslösen konnte [88]. Auch wenn die primäre analgetische Wirkung von THC vermutlich über CB1R vermittelt wird, scheint auch eine agonistische Stimulation von Glycin-Rezeptoren eine Rolle zu spielen [50]. THC potenziert die Amplitude von Ionenströmen durch aktivierte Glycin-Rezeptoren [33, 86], vermutlich über die Bindung an Alpha-1- und Alpha-3-Untereinheiten des Glycin-Rezeptors [86].
Eine weitere möglicherweise relevante CB1R-unabhängige Zielstruktur von THC scheint der Peroxisom-Proliferator-aktivierte Rezeptor gamma (PPARγ) zu sein. So konnte gezeigt werden, dass THC einen dosis- und zeitabhängigen Effekt auf die PPARγ-vermittelte Vasorelaxation der Aorta und der Arteria mesenterica superior hat [63, 64]. Die signifikant verstärkte Vasorelaxation durch THC konnte durch PPARγ-Antagonisten inhibiert werden [64] und war vergleichbar mit der erhöhten Vasorelaxation nach Gabe des PPARγ-Agonisten Rosiglitazon [62]. Die agonistische Aktivierung von PPARγ durch THC vermittelt möglicherweise auch die antiinflammatorische Wirkungen des Phytocannabinoids. In einem Zellkulturmodell für Parkinson wies THC neuroprotektive Effekte auf, die durch einen PPARγ-Antagonisten blockiert wurden [8]. Des Weiteren milderte THC in sehr geringen Dosierungen durch Entzündungen ausgelöste kognitive Schäden in Mäusen – ein Effekt, der sowohl durch CB1R- als auch PPARγ-Antagonisten inhibiert werden konnte, jedoch interessanterweise nicht durch CB2R-Antagonisten blockiert wurde [24].
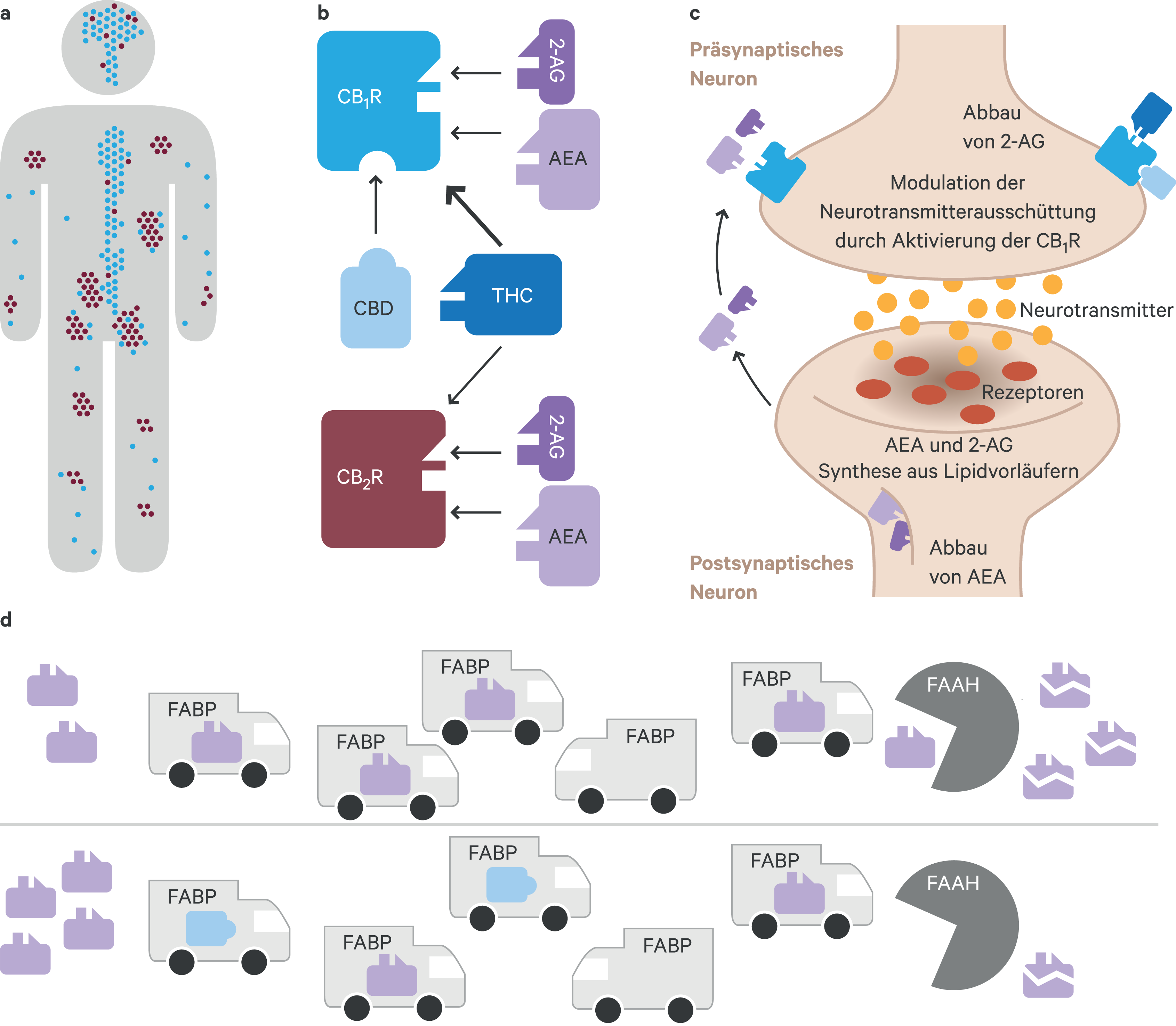
Abb. 1. Das Endocannabinoid-System. Die beiden Endocannabinoide Anandamid (AEA, Arachidonylethanolamid) und 2-AG (2-Arachidonylglycerol), ihre synthetisierenden und abbauenden Enzyme sowie die beiden Cannabinoidrezeptoren CB1R und CB2R bilden das Endocannabinoid-System. (a) Die Cannabinoidrezeptoren werden im ganzen Körper exprimiert, wobei CB1R (symbolisiert durch blaue Punkte) vorwiegend im Zentralnervensystem in Nervenzellen zu finden ist, aber auch in geringerer Dichte in der Peripherie, zum Beispiel in vaskulären Endothelzellen, dem Darm, der Leber oder dem Reproduktionsgewebe. CB2R (rostrote Punkte) werden hingegen vorwiegend auf peripheren und zerebralen Zellen des Immunsystems exprimiert (z.B. Makrophagen [inklusive Mikrogliazellen], Lymphozyten, Osteoklasten und Osteoblasten), aber auch in Keratinozyten der Haut. (b) Aktiviert werden die Cannabinoidrezeptoren nicht nur durch die endogenen Liganden AEA und 2-AG, sondern auch durch das exogene Cannabinoid Delta-9-Tetrahydrocannabinol (THC), den psychotomimetisch wirksamen Hauptbestandteil der Cannabispflanze. Cannabidiol (CBD), das neben THC am besten untersuchte exogene Cannabinoid, hat hingegen nur eine geringe Affinität zu den beiden Cannabinoidrezeptoren. Allerdings wird vermutet, dass CBD über eine negative allosterische Modulation der CB1R die Wirkung von CB1R-Agonisten (orthosterische Liganden wie THC oder 2-AG) antagonisieren kann. (c) Die Aktivierung der postsynaptischen Cannabinoidrezeptoren durch endogene (AEA, 2-AG) oder exogene Liganden (THC) führt zu einer Reduktion der Neurotransmitterausschüttung. Dieser Effekt kann durch negative allosterische Modulatoren wie CBD abgeschwächt werden. Eine Besonderheit der Endocannabinoide ist, dass sie als retrograde Neurotransmitter agieren. Das heißt, sie werden bei Bedarf von der präsynaptischen Zelle aus Lipidvorläufern in der Zellmembran synthetisiert und ausgeschüttet, wandern über den synaptischen Spalt zur Postsynapse und aktivieren die dortigen Cannabinoidrezeptoren. Der Abbau von 2-AG erfolgt in der präsynaptischen Zelle, während AEA in der Postsynapse verstoffwechselt wird. (d) Zudem wird vermutet, dass CBD mit dem Endocannabinoid-System über einen Cannabinoidrezeptor-unabhängigen Weg interagiert. Dabei scheint CBD über die Blockade von Transportproteinen (FABP, fatty acid binding proteins) den Transport von AEA zu seinem abbauenden Enzym (FAAH, fatty acid amide hydrolase) zu inhibieren, sodass es zu einem Anstieg der AEA-Konzentration nach CBD-Gabe kommt.
Cannabidiol (CBD)
CBD ist aufgrund seiner vielversprechenden therapeutischen Effekte eines der am besten untersuchten Phytocannabinoide. Der Substanz werden unter anderem antipsychotische, antiepileptische, anxiolytische, antiemetische, antiinflammatorische und neuroprotektive Eigenschaften zugeschrieben.
Im Gegensatz zu THC wirkt CBD nicht psychotomimetisch und hat dementsprechend nur eine geringe CB1R-Affinität [6, 19]. CBD scheint allerdings die Internalisierung von CB1R zu inhibieren [46] und es wird vermutet, dass CBD über eine negative allosterische Modulation der CB1R [45] die Wirkung von CB1R-Agonisten (WIN-55 212, CP-55 940, THC, 2-AG) antagonisieren kann [45]. Das heißt, CBD aktiviert nicht den CB1R, aber verändert vermutlich die Potenz und Wirksamkeit der orthosterischen Liganden (Abb. 1). Die Affinität von CBD zum CB2R ist ebenfalls nur gering [6].
Interessanterweise ist die in klinischen Studien beobachtete antipsychotische Wirkung von CBD [47, 54] signifikant mit einer Erhöhung von Anandamid-Spiegeln im Serum assoziiert [47]. In vitro inhibiert CBD das Anandamid-abbauende Enzym FAAH (Fatty acid amide hydrolase) [6, 17, 47] sowie die zelluläre Aufnahme von Anandamid [6, 17]. Allerdings wurde kürzlich berichtet, dass CBD zwar die FAAH-Variante von Nagern inhibiert, nicht aber das humane FAAH-Enzym [21]. Die gleiche Studie zeigte auch, dass CBD humane Transportproteine – sogenannte „fatty acid-binding proteins“ (FABPs) – blockiert [21], die vermutlich Anandamid und verwandte Fettsäureethanolamide zum FAAH-Enzym transportieren [43]. Elmes et al. [21] schließen aus diesen Befunden, dass CBD bei Menschen den Abbau von Anandamid verhindert, indem es mit Anandamid um die Bindung an die Transportproteine (FABPs) konkurriert. Dementsprechend kann Anandamid nicht zum FAAH-Enzym transportiert werden, solange CBD die FABP-Bindungsstellen blockiert, was schließlich zum Anstieg des Anandamid-Spiegels führt (Abb. 1).
CBD scheint zudem sowohl in vitro als auch in vivo antagonistisch an einem potenziellen weiteren Cannabinoid-Rezeptor, dem G-Protein-gekoppelten Rezeptor GPR55, zu wirken [44, 81]. Es wurde postuliert, dass die antiepileptische Wirkung von CBD möglicherweise über diesen Mechanismus vermittelt wird, da in einem genetischen Mausmodell des Dravet-Syndroms die Steigerung der inhibitorischen Neurotransmission durch CBD auch durch einen GPR55-Antagonisten ausgelöst wird und die gemeinsame Gabe von CBD und dem GPR55-Antagonisten, im Vergleich zur einzelnen Gabe beider Substanzen, keine zusätzlichen Wirkungen hervorruft [44].
Neben diesen Endocannabinoid-System-abhängigen molekularen Zielstrukturen wurden zudem zahlreiche unabhängige Zielstrukturen postuliert, wobei die pharmakologische Relevanz noch nicht vollständig geklärt ist.
In-vitro-Studien deuten darauf hin, dass CBD die 5-HT1A-Rezeptor-vermittelte serotonerge Neurotransmission fördern kann. Beispielsweise verdrängt CBD in der Zellkultur den 5-HT1A-Rezeptoragonisten [3H]8-OH-DPAT und steigert die Aktivität des humanen 5-HT1A-Rezeptors [75]. In Membranpräparationen vom Hirnstamm der Ratte konnte dieser Effekt zwar nicht beobachtet werden; allerdings steigerte CBD die maximale Effektivität des Agonisten 8-OH-DPAT [69]. Dies deutet darauf hin, dass CBD vermutlich nicht wie zunächst postuliert agonistisch am 5-HT1A-Rezeptor wirkt [75], sondern die Rezeptoraktivität allosterisch moduliert [69, 78]. Auch wenn der genaue Mechanismus noch nicht verstanden ist, zeigen In-vivo-Studien, dass einige der therapeutischen Effekte von CBD über den 5-HT1A-Rezeptor und die Förderung der serotonergen Neurotransmission vermittelt wurde. Dazu gehören unter anderem antiemetische [75], antikataleptische [29, 78], anxiolytische [30] und neuroprotektive [37, 60] Wirkungen von CBD.
CBD bindet in vitro wie THC an PPARγ [31, 63] und wirkt ebenso dosis- und zeitabhängig auf die PPARγ-vermittelte Vasorelaxation der Aorta der Ratte [63]. Des Weiteren scheinen neuroprotektive/antiinflammatorische Effekte von CBD im Ratten- und Zellkulturmodell für Alzheimer [23, 77], im Mausmodell für tardive Dsykinesie [79] und im Zellkulturmodell für Ischämie [37] über einen PPARγ-abhängigen Mechanismus vermittelt zu werden.
In vitro stimuliert CBD zudem den humanen TRPV1 (TRP-Kationenkanal der Subfamilie V) [6, 17]. Die physiologische Relevanz ist jedoch noch nicht gut untersucht. Im Tiermodell schwächt CBD eine experimentell induzierte Verschlechterung der Präpulsinhibition (ein Maß für die sensomotorische Reizfilterung) ab, ein Effekt der durch die Vorbehandlung mit einem TRPV1-Agonisten (Capsaicin) blockiert wird [49]. Kürzlich wurde beschrieben, dass die antinozizeptiven Effekte von CBD vermutlich nicht durch eine direkte Aktivierung der TRPV1 vermittelt werden. So konnte gezeigt werden, dass CBD die Schmerzwahrnehmung im Tiermodell durch eine Inhibition des Anandamid-Abbaus vermindert, was zu einem Anstieg von Anandamid führt, welches wiederum TRPV1 aktiviert [12]. Auf der anderen Seite scheint eine Desensitivierung des TRPV1 an der Vermittlung der antikonvulsiven Wirkung von CBD beteiligt zu sein, wie eine Studie im Mausmodell für Epilepsie nahelegt [84]. Dass die antikonvulsive Wirkung durch eine direkte agonistische Aktivität von CBD am TRPV1 vermittelt wird, konnte bisher jedoch noch nicht belegt werden [26].
Ein weiterer Mechanismus, der zu den antikonvulsiven Effekten von CBD beitragen könnte, ist die Inhibition von humanen spannungsgesteuerten Calcium- und Natrium-Kanälen, aber auch hier fehlen Studien die einen direkten Zusammenhang zeigen [26, 28, 65, 74].
Neben den beschriebenen molekularen Zielstrukturen wurden noch einige weitere vorgeschlagen. Darunter weitere Subtypen des TRP-Kationenkanals (TRPV2, TRPM8, TRPA1), Glycin-Rezeptoren, Adenosin-Rezeptoren, µ- und δ-Opioid-Rezeptoren, nikotinische Acetylcholin-Rezeptoren, Enzyme der Arachidonsäurekaskade, Enzyme, die in den xenobiotischen Metabolismus involviert sind, sowie proinflammatorische Zytokine [5, 55]. Die pharmakologische Relevanz dieser Zielstrukturen muss allerdings noch eingehender untersucht werden und es ist zu vermuten, dass auch weitere relevante Zielstrukturen existieren, die bisher noch nicht in Betracht gezogen wurden.
Cannabidivarin (CBDV)
CBDV ist ein Propyl-Analogon von CBD und zählt somit zum CBD-Typ (Tab. 2). Es weist ähnliche chemische Eigenschaften auf und wirkt ebenfalls nicht psychotomimetisch. Allerdings sind die pharmakologischen Eigenschaften bisher nur wenig untersucht, obwohl das Phytocannabinoid bereits 1969 isoliert wurde [41]. CBDV weist wie CBD nur eine geringe Affinität zu CB1R und CB2R auf [35] und inhibiert ebenfalls die zelluläre Aufnahme von Anandamid [17]. Zudem blockiert es die Diacylglycerol-Lipase alpha (DAGLα), ein Enzym das maßgeblich an der Biosynthese des Endocannabinoids 2-AG beteiligt ist [17].
Außerhalb des Endocannabinoid-Systems scheint CBDV insbesondere die Aktivität verschiedener TRP-Kationenkanäle zu modulieren. So aktiviert CBDV den humanen TRPA1 und ist ein schwacher bis moderater Agonist der TRPV1, TRPV2 und TRPV3 [16, 17, 40]. Studien an tierexperimentellen Epilepsiemodellen zeigten, dass die antikonvulsive Wirkung des CBDVs über einen CB1R-unabhängigen Mechanismus vermittelt wird [35] und möglicherweise TRPV-Kanäle involviert, da der antikonvulsive Effekt in TRPV-Knockout-Mäusen nur abgeschwächt zu beobachten ist [39]. Ergebnisse einer In-vitro-Studie weisen allerdings darauf hin, dass die antiepileptiformen Effekte von CBDV nicht ausschließlich über eine TRPV1-Aktivierung ausgelöst werden [40]. Eine kürzlich veröffentlichte Humanstudie, in welcher der Effekt einer akuten CBDV-Gabe (600 mg) auf die Glutamat- und GABA-Spiegel im Gehirn mittels Magnetresonanzspektroskopie untersucht wurde, beobachtete erhöhte Glutamat-Spiegel in den Basalganglien von Gesunden und Probanden mit einer autistischen Störung. Die Glutamat-Spiegel im dorsomedialen präfrontalen Kortex sowie die GABA-Spiegel blieben unverändert [67]. Aufgrund der Kolokalisation mit TRP-Kationenkanälen, spekulieren die Autoren, dass der beobachtete Anstieg der subkortikalen Glutamat-Konzentrationen möglicherweise durch diese vermittelt wird [67].
Cannabigerol (CBG)
CBG kommt in recht hohen Konzentrationen in der Cannabis-Pflanze vor und wirkt wie CBD und CBDV nicht psychotomimetisch [22, 32]. Die Carboxylsäure-Form von CBG ist äußerst relevant für die Synthese anderer Phytocannabinoide. Sie ist unter anderem Vorläufer für die Carboxylsäure-Formen von ∆9-THC (∆9-THCA) und CBD (CBDA). Diese werden wiederum enzymatisch zu ∆9-THC und CBD umgesetzt [22]. Obwohl CBG schon 1964 isoliert wurde [59], wurden die pharmakologischen Eigenschaften dieses Phytocannabinoids bisher noch nicht umfassend untersucht.
CBG weist wie die anderen nicht-psychotomimetischen Phytocannabinoide nur eine geringe Affinität am CB1R auf [41, 73] und löst dementsprechend im Tiermodell im Gegensatz zu THC keine Katalepsie, Sedierung, oder Hypomobilität aus [32]. Auch die CB2R-Affinität ist gering [73]. Wie CBD und CBDV scheint CBG aber die zelluläre Aufnahme von Anandamid zu inhibieren [17].
Des Weiteren wurden einige vom Endocannabinoid-System unabhängige molekulare Zielstrukturen beschrieben. So konnte gezeigt werden, dass CBG ein potenter TRPM8-Antagonist [17, 18] sowie ein potenter TRPA1-Agonist [17, 18], aber nur ein schwacher TRPV1- [17, 48] und TRPV2-Agonist [17] ist. Zudem wurde gezeigt, dass CBG den Alpha-2-Adrenorezepor aktiviert, ein Effekt der durch den selektiven Alpha-2-Adrenorezeptorantagonisten Yohimbin blockiert wurde [9]. Wie andere selektive Alpha-2-Adrenorezeptoragonisten, scheint CBG zudem ein moderater 5-HT1A-Rezeptorantagonist zu sein [9]. Inwieweit die verschiedenen postulierten Wirkungsmechanismen für die beschriebenen antibakteriellen [41], antiproliferativen [41, 48] und antikonvulsiven [34] Wirkungen relevant sind, ist bisher allerdings noch nicht geklärt. Die antagonistische Wirkung am 5-HT1A-Rezeptor könnte aber dazu beitragen, dass CBG im Tiermodell die antiemetische Wirkung von CBD und 8-OH-DPAT aufhebt [70], also eine pro-emetische Wirkung hat [25].
Schlussfolgerung und Zusammenfassung
Die Cannabis-Pflanze enthält eine Vielzahl von Inhaltsstoffen, die diversen chemischen Klassen angehören. Die für die therapeutischen Effekte wichtigste Substanzklasse stellen jedoch die Phytocannabinoide dar. Da die exakte Zusammensetzung in Abhängigkeit von genetischen und Umweltfaktoren stark variiert, haben verschiedene Cannabis-Extrakte auch unterschiedliche Wirkungen. Die zurzeit am besten untersuchten Phytocannabinoide sind ∆9-THC und CBD. Zudem sind CBG und CBDV in den letzten Jahren immer mehr in den wissenschaftlichen Fokus gerückt, da auch diese beiden Phytocannabinoide vielversprechende therapeutische Wirkungen zu haben scheinen. Auch wenn sicherlich ein Großteil der therapeutischen Effekte über die Modulation des Endocannabinoid-Systems vermittelt wird, sei es über die Aktivierung der Cannabinoid-Rezeptoren oder die Inhibition von Enzymen und Transportern, zeigen die Forschungsergebnisse der letzten Jahrzehnte, dass die Phytocannabinoide polypharmakologisch ihre Wirkung entfalten und weitere, vom Endocannabinoid-System unabhängige molekulare Zielstrukturen in die Vermittlung der therapeutischen Effekte involviert sind (Tab. 4). Allerdings fehlen zurzeit kontrollierte, klinische Studien, die die pharmakologische Relevanz der postulierten Wirkungsmechanismen für die verschiedenen therapeutischen Effekte belegen.
Tab. 4. Relevante pharmakologische Effekte der einzelnen Cannabis-Bestandteile. Inwieweit die postulierten Wirkungsmechanismen für die beschriebenen Wirkungen relevant sind, ist noch nicht in allen Fällen abschließend geklärt. Des Weiteren existieren vermutlich weitere Zielstrukturen, die bisher noch nicht in Betracht gezogen wurden.
|
Cannabinoid |
Pharmakologische Effekte |
Postulierte Wirkungsmechanismen/Zielstrukturen |
|
THC |
Psychotomimetische Wirkung |
|
|
Analgetisch |
|
|
|
Appetitsteigernd |
|
|
|
Antiemetisch |
|
|
|
Antispastisch |
|
|
|
Sedierend |
|
|
|
Antikonvulsiv/ |
|
|
|
Antiinflammatorisch |
|
|
|
Neuroprotektiv |
|
|
|
Weitere Zielstrukturen deren pharmakologische Relevanz noch nicht gut untersucht ist:
|
||
|
CBD |
Antipsychotisch |
|
|
Anxiolytisch |
|
|
|
Antiemetisch |
|
|
|
Antikonvulsiv/ |
|
|
|
Neuroprotektiv |
|
|
|
Antikataleptisch |
|
|
|
Antiinflammatorisch |
|
|
|
Antinozizeptiv |
|
|
|
Weitere Zielstrukturen deren pharmakologische Relevanz noch nicht gut untersucht ist:
|
||
|
CBDV |
Antikonvulsiv |
Die antiepileptiformen Effekte werden aber vermutlich nicht ausschließlich über eine TRPV1-Aktivierung vermittelt. |
|
Weitere Wirkungsmechanismen deren Funktion und Relevanz noch nicht näher geklärt sind:
|
||
|
CBG |
Antikonvulsiv Antiproliferativ Antibakteriell |
Folgende pharmakologischen Eigenschaften wurden bisher beschrieben:
Inwieweit die postulierten Wirkungsmechanismen für die beschriebenen Wirkungen relevant sind, ist noch nicht abschließend geklärt |
|
Pro-emetisch |
|
CB1R: Cannabinoid-Rezeptor Typ 1; CBD: Cannabidiol; CBDV: Cannabidivarin; CBG: Cannabigerol; DAGLα: Diacylglycerol-Lipase alpha; THC: Delta-9-Tetrahydrocannabinol; FABP: Fatty acid binding protein; GPR: G-Protein-gekoppelter Rezeptor; PPARγ: Peroxisom-Proliferator-aktivierter Rezeptor gamma; TRP: Transientes-Rezeptor-Potential-Kationenkanal; TRPA: TRP der Subfamilie A; TRPM: TRP der Subfamilie M; TRPV: TRP der Subfamilie V
Interessenkonflikterklärung
Beide Autorinnen erklären, dass keine Interessenkonflikte vorliegen.
Literatur
1. Adams AJ, et al. “Zombie” outbreak caused by the synthetic cannabinoid AMB-FUBINACA in New York. N Engl J Med 2017;376:235–42.
2. Adams R. Marihuana. Science 1940;92:115–9.
3. Ashton H, et al. The seed and the soil: effect of dosage, personality and starting state on the response to delta-9-tetrahydrocannabinol in man. Br J Clin Pharmacol 1981;12:705–20.
4. Auwärter V, et al. ‘Spice’ and other herbal blends: harmless incense or cannabinoid designer drugs? J Mass Spectrom 2009;44:832–7.
5. Bih CI, et al. Molecular targets of cannabidiol in neurological disorders. Neurotherapeutics 2015;12:699–730.
6. Bisogno T, et al. Molecular targets for cannabidiol and its synthetic analogues: effect on vanilloid VR1 receptors and on the cellular uptake and enzymatic hydrolysis of anandamide. Br J Pharmacol 2001;134:845–52.
7. Bócsa I, Mathé P, Hangyel L. Effect of nitrogen on tetrahydrocannabinol (THC) content in hemp (Cannabis sativa L.) leaves at different positions. J Int Hemp Assoc 1997;4:78–9.
8. Carroll CB, et al. Delta(9)-tetrahydrocannabinol (Delta(9)-THC) exerts a direct neuroprotective effect in a human cell culture model of Parkinson’s disease. Neuropathol Appl Neurobiol 2012;38:535–47.
9. Cascio MG, et al. Evidence that the plant cannabinoid cannabigerol is a highly potent alpha2-adrenoceptor agonist and moderately potent 5HT1A receptor antagonist. Br J Pharmacol 2010;159:129–41.
10. Cohen K, Weizman A, Weinstein A. Positive and negative effects of cannabis and cannabinoids on health. Clin Pharmacol Ther 2019;105:1139–47.
11. Colizzi M, et al. Descriptive psychopathology of the acute effects of intravenous delta-9-tetrahydrocannabinol administration in humans. Brain Sci 2019;9:93.
12. Crivelaro do Nascimento G, et al. Cannabidiol increases the nociceptive threshold in a preclinical model of Parkinson’s disease. Neuropharmacology 2019;163:107808.
13. D’Souza DC, et al. The psychotomimetic effects of intravenous delta-9-tetrahydrocannabinol in healthy individuals: implications for psychosis. Neuropsychopharmacology 2004;29:1558–72.
14. de Meijer EP, et al. The inheritance of chemical phenotype in Cannabis sativa L. Genetics 2003;163:335–46.
15. de Meijer EPM, van der Kamp HJ, van Eeuwijk FA. Characterisation of cannabis accessions with regard to cannabinoid content in relation to other plant characters. Euphytica 1992;62:187–200.
16. De Petrocellis L, et al. Cannabinoid actions at TRPV channels: effects on TRPV3 and TRPV4 and their potential relevance to gastrointestinal inflammation. Acta Physiol (Oxf) 2012;204:255–66.
17. De Petrocellis L, et al. Effects of cannabinoids and cannabinoid-enriched cannabis extracts on TRP channels and endocannabinoid metabolic enzymes. Br J Pharmacol 2011;163:1479–94.
18. De Petrocellis L, et al. Plant-derived cannabinoids modulate the activity of transient receptor potential channels of ankyrin type-1 and melastatin type-8. J Pharmacol Exp Ther 2008;325:1007–15.
19. Devane WA, et al. Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol 1988;34:605–13.
20. Devane WA, et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992;258:1946–9.
21. Elmes MW, et al. Fatty acid-binding proteins (FABPs) are intracellular carriers for delta-9-tetrahydrocannabinol (THC) and cannabidiol (CBD). J Biol Chem 2015;290:8711–21.
22. ElSohly MA, et al. Phytochemistry of cannabis sativa L. Prog Chem Org Nat Prod 2017;103:1–36.
23. Esposito G, et al. Cannabidiol reduces Abeta-induced neuroinflammation and promotes hippocampal neurogenesis through PPARgamma involvement. PLoS One 2011;6:e28668.
24. Fishbein-Kaminietsky M, Gafni M, Sarne Y. Ultralow doses of cannabinoid drugs protect the mouse brain from inflammation-induced cognitive damage. J Neurosci Res 2014;92:1669–77.
25. Galli JA, Sawaya RA, Friedenberg FK. Cannabinoid hyperemesis syndrome. Curr Drug Abuse Rev 2011;4:241–9.
26. Gaston TE, Friedman D. Pharmacology of cannabinoids in the treatment of epilepsy. Epilepsy Behav 2017;70:313–8.
27. Gerard CM, et al. Molecular cloning of a human cannabinoid receptor which is also expressed in testis. Biochem J 1991;279:129–34.
28. Ghovanloo MR, et al. Inhibitory effects of cannabidiol on voltage-dependent sodium currents. J Biol Chem 2018;293:16546–58.
29. Gomes FV, Del Bel EA, Guimaraes FS. Cannabidiol attenuates catalepsy induced by distinct pharmacological mechanisms via 5-HT1A receptor activation in mice. Prog Neuropsychopharmacol Biol Psychiatry 2013;46:43–7.
30. Gomes FV, Resstel LBM, Guimarães FS. The anxiolytic-like effects of cannabidiol injected into the bed nucleus of the stria terminalis are mediated by 5-HT1A receptors. Psychopharmacology 2011;213:465–73.
31. Granja AG, et al. A cannabigerol quinone alleviates neuroinflammation in a chronic model of multiple sclerosis. J Neuroimmune Pharmacol 2012;7:1002–16.
32. Grunfeld Y, Edery H. Psychopharmacological activity of the active constituents of hashish and some related cannabinoids. Psychopharmacologia 1969;14:200–10.
33. Hejazi N, et al. Delta-9-tetrahydrocannabinol and endogenous cannabinoid anandamide directly potentiate the function of glycine receptors. Mol Pharmacol 2006;69:991–7.
34. Hill AJ, et al. Voltage-gated sodium (NaV) channel blockade by plant cannabinoids does not confer anticonvulsant effects per se. Neurosci Lett 2014;566:269–74.
35. Hill TD, et al. Cannabidivarin-rich cannabis extracts are anticonvulsant in mouse and rat via a CB1 receptor-independent mechanism. Br J Pharmacol 2013;170:679–92.
36. Hillard CJ, Harris RA, Bloom AS. Effects of the cannabinoids on physical properties of brain membranes and phospholipid vesicles: fluorescence studies. J Pharmacol Exp Ther 1985;232:579–88.
37. Hind WH, England TJ, O’Sullivan SE. Cannabidiol protects an in vitro model of the blood-brain barrier from oxygen-glucose deprivation via PPARgamma and 5-HT1A receptors. Br J Pharmacol 2016;173:815–25.
38. Hollister LE. Structure-activity relationships in man of cannabis constituents, and homologs and metabolites of Δ9-tetrahydrocannabinol. Pharmacology 1974;11:3–11.
39. Huizenga MN, Sepulveda-Rodriguez A, Forcelli PA. Preclinical safety and efficacy of cannabidivarin for early life seizures. Neuropharmacology 2019;148:189–98.
40. Iannotti FA, et al. Nonpsychotropic plant cannabinoids, cannabidivarin (CBDV) and cannabidiol (CBD), activate and desensitize transient receptor potential vanilloid 1 (TRPV1) channels in vitro: potential for the treatment of neuronal hyperexcitability. ACS Chem Neurosci 2014;5:1131–41.
41. Izzo AA, et al. Non-psychotropic plant cannabinoids: new therapeutic opportunities from an ancient herb. Trends Pharmacol Sci 2009;30:515–27.
42. Jarbe TU, DiPatrizio NV. Delta-9-THC induced hyperphagia and tolerance assessment: interactions between the CB1 receptor agonist delta-9-THC and the CB1 receptor antagonist SR-141716 (rimonabant) in rats. Behav Pharmacol 2005;16:373–80.
43. Kaczocha M, et al. Fatty acid-binding proteins transport N-acylethanolamines to nuclear receptors and are targets of endocannabinoid transport inhibitors. J Biol Chem 2012;287:3415–24.
44. Kaplan JS, et al. Cannabidiol attenuates seizures and social deficits in a mouse model of Dravet syndrome. Proc Natl Acad Sci U S A 2017;114:11229–34.
45. Laprairie RB, et al. Cannabidiol is a negative allosteric modulator of the cannabinoid CB1 receptor. Br J Pharmacol 2015;172:4790–805.
46. Laprairie RB, et al. Type 1 cannabinoid receptor ligands display functional selectivity in a cell culture model of striatal medium spiny projection neurons. J Biol Chem 2014;289:24845–62.
47. Leweke FM, et al. Cannabidiol enhances anandamide signaling and alleviates psychotic symptoms of schizophrenia. Transl Psychiatry 2012;2:e94.
48. Ligresti A, et al. Antitumor activity of plant cannabinoids with emphasis on the effect of cannabidiol on human breast carcinoma. J Pharmacol Exp Ther 2006;318:1375–87.
49. Long LE, Malone DT, Taylor DA. Cannabidiol reverses MK-801-induced disruption of prepulse inhibition in mice. Neuropsychopharmacology 2006;31:795–803.
50. Lotsch J, Weyer-Menkhoff I, Tegeder I. Current evidence of cannabinoid-based analgesia obtained in preclinical and human experimental settings. Eur J Pain 2018;22:471–84.
51. Maccarrone M, et al. Endocannabinoid signaling at the periphery: 50 years after THC. Trends Pharmacol Sci 2015;36:277–96.
52. Martin BR, et al. Behavioral, biochemical, and molecular modeling evaluations of cannabinoid analogs. Pharmacol Biochem Behav 1991;40:471–8.
53. Matsuda LA, et al. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature 1990;346:561–4.
54. McGuire P, et al. Cannabidiol (CBD) as an adjunctive therapy in schizophrenia: A multicenter randomized controlled trial. Am J Psychiatry 2018;175:225–31.
55. McPartland JM, et al. Are cannabidiol and delta-9-tetrahydrocannabivarin negative modulators of the endocannabinoid system? A systematic review. Br J Pharmacol 2015;172:737–53.
56. Mechoulam R, Carlini EA. Toward drugs derived from cannabis. Die Naturwissenschaften 1978;65:174–9.
57. Mechoulam R, et al. Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochem Pharmacol 1995;50:83–90.
58. Mechoulam R, Shvo Y. Hashish–I: The structure of Cannabidiol. Tetrahedron 1963;19:2073–8.
59. Mechoulam R. Marihuana chemistry. Science 1970;168:1159–66.
60. Mishima K, et al. Cannabidiol prevents cerebral infarction via a serotonergic 5-hydroxytryptamine1A receptor-dependent mechanism. Stroke 2019;36:1077.
61. Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature 1993;365:61–5.
62. O’Sullivan SE, et al. Novel time-dependent vascular actions of delta-9-tetrahydrocannabinol mediated by peroxisome proliferator-activated receptor gamma. Biochem Biophys Res Commun 2005;337:824–31.
63. O’Sullivan SE, et al. Time-dependent vascular actions of cannabidiol in the rat aorta. Eur J Pharmacol 2009;612:61–8.
64. O’Sullivan SE, Kendall DA, Randall MD. Further characterization of the time-dependent vascular effects of delta-9-tetrahydrocannabinol. J Pharmacol Exp Ther 2006;317:428–38.
65. Patel RR, et al. Aberrant epilepsy-associated mutant Nav1.6 sodium channel activity can be targeted with cannabidiol. Brain 2016;139:2164–81.
66. Pisanti S, Bifulco M. Medical cannabis: A plurimillennial history of an evergreen. J Cell Physiol 2019;234:8342–51.
67. Pretzsch CM, et al. Effects of cannabidivarin (CBDV) on brain excitation and inhibition systems in adults with and without autism spectrum disorder (ASD): a single dose trial during magnetic resonance spectroscopy. Transl Psychiatry 2019;9:313.
68. Pryce G, Baker D. Control of spasticity in a multiple sclerosis model is mediated by CB1, not CB2, cannabinoid receptors. Br J Pharmacol 2007;150:519–25.
69. Rock EM, et al. Cannabidiol, a non-psychotropic component of cannabis, attenuates vomiting and nausea-like behaviour via indirect agonism of 5-HT1A somatodendritic autoreceptors in the dorsal raphe nucleus. Br J Pharmacol 2012;165:2620–34.
70. Rock EM, et al. Interaction between non-psychotropic cannabinoids in marihuana: effect of cannabigerol (CBG) on the anti-nausea or anti-emetic effects of cannabidiol (CBD) in rats and shrews. Psychopharmacology (Berl) 2011;215:505–12.
71. Rodriguez de Fonseca F, et al. The endocannabinoid system: physiology and pharmacology. Alcohol Alcohol 2005;40:2–14.
72. Rohleder C, et al. Cannabidiol as a potential new type of an antipsychotic. A critical review of the evidence. Front Pharmacol 2016;7:422.
73. Rosenthaler S, et al. Differences in receptor binding affinity of several phytocannabinoids do not explain their effects on neural cell cultures. Neurotoxicol Teratol 2014;46:49–56.
74. Ross HR, Napier I, Connor M. Inhibition of recombinant human T-type calcium channels by Δ9-tetrahydrocannabinol and cannabidiol. J Biol Chem 2008;283:16124–34.
75. Russo EB, et al. Agonistic properties of cannabidiol at 5-HT1a receptors. Neurochem Res 2005;30:1037–43.
76. Russo EB, Marcu J. Cannabis pharmacology: The usual suspects and a few promising leads. Adv Pharmacol 2017;80:67–134.
77. Scuderi C, Steardo L, Esposito G. Cannabidiol promotes amyloid precursor protein ubiquitination and reduction of beta amyloid expression in SHSY5YAPP+ cells through PPARgamma involvement. Phytother Res 2014;28:1007–13.
78. Sonego AB, et al. Cannabidiol attenuates haloperidol-induced catalepsy and c-Fos protein expression in the dorsolateral striatum via 5-HT1A receptors in mice. Behav Brain Res 2016;309:22–8.
79. Sonego AB, et al. Cannabidiol prevents haloperidol-induced vacuos chewing movements and inflammatory changes in mice via PPARgamma receptors. Brain Behav Immun 2018;74:241–51.
80. Sugiura T, et al. 2-Arachidonoylglycerol: a possible endogenous cannabinoid receptor ligand in brain. Biochem Biophys Res Commun 1995;215:89–97.
81. Sylantyev S, et al. Cannabinoid- and lysophosphatidylinositol-sensitive receptor GPR55 boosts neurotransmitter release at central synapses. Proc Natl Acad Sci U S A 2013;110:5193–8.
82. Turner SE, et al. Molecular pharmacology of phytocannabinoids. Prog Chem Org Nat Prod 2017;103:61–101.
83. Varvel SA, et al. Delta9-tetrahydrocannbinol accounts for the antinociceptive, hypothermic, and cataleptic effects of marijuana in mice. J Pharmacol Exp Ther 2005;314:329–37.
84. Vilela LR, et al. Anticonvulsant effect of cannabidiol in the pentylenetetrazole model: Pharmacological mechanisms, electroencephalographic profile, and brain cytokine levels. Epilepsy Beh 2017;75:29–35.
85. Williams CM, Rogers PJ, Kirkham TC. Hyperphagia in pre-fed rats following oral delta9-THC. Physiol Behav 1998;65:343–6.
86. Xiong W, et al. A common molecular basis for exogenous and endogenous cannabinoid potentiation of glycine receptors. J Neurosci 2012;32:5200–8.
87. Yamauchi T, et al. Tetrahydrocannabinolic acid, a genuine substance of tetrahydrocannabinol. Chem Pharm Bull (Tokyo) 1967;15:1075–6.
88. Zimmer A, et al. Increased mortality, hypoactivity, and hypoalgesia in cannabinoid CB1 receptor knockout mice. Proc Natl Acad Sci U S A 1999;96:5780–5.
Dr. Cathrin Rohleder, Brain and Mind Centre, The University of Sydney, 94 Mallett Street, Camperdown, NSW, 2006, E-Mail: cathrin.rohleder@sydney.edu.au
Dr. Juliane K Müller, Klinik für Psychiatrie, Psychosomatik und Psychotherapie, Universitätsklinikum Frankfurt, Heinrich-Hoffmann-Str. 10, 60528 Frankfurt am Main
Pharmacology of cannabis and cannabinoids
The medical use of cannabis, cannabis preparations, and single cannabis ingredients for the therapy of various diseases is currently polarising the professional world.
On the one hand, cannabis is believed to have a broad therapeutic spectrum, including analgesic, antiemetic, anticonvulsive, antispastic, neuroprotective, anxiolytic, and antipsychotic effects. On the other hand, the medical benefit for some of the previously proposed areas of application is still unclear, and additional controlled clinical studies are required to prove efficacy and safety in the treatment of psychiatric and neurological diseases as well as chronic pain. At first glance, the broad efficacy spectrum appears impressive but can be attributed to the pharmacological properties of phytocannabinoids, specifically delta-9-tetrahydrocannabinol (∆9-THC) and cannabidiol. Cannabigerol and cannabidivarin are two additional phytocannabinoids that have come to the fore due to their possible therapeutic effects.
The diverse effects seem to be mediated primarily by the modulation of the endocannabinoid system, a system that is involved in the regulation of various physiological and cognitive processes. These include pain perception, energy homeostasis, appetite, lipid metabolism, cardiovascular functions, thermoregulation, immune response, sleep-wake rhythm, psychomotor activity, memory, and stress response. In addition, interactions with other molecular targets such as the serotonin receptor 5-HT1A, peroxisome proliferator-activated receptor gamma (PPARγ), transient receptor potential cation channels (e.g., TRPV1), other ion channels, and the G-protein coupled receptor GPR55, contribute to the different aspects of the therapeutic effects.
Key words: Phytocannabinoids, exogenous cannabinoids, tetrahydrocannbinol (THC), cannabidiol (CBD), cannabigerol (CBG), cannabidivarin (CBDV), mechanism of action
Psychopharmakotherapie 2020; 27(03)
