Gerd Laux, Soyen/Waldkraiburg/München, und Walter E. Müller, Worms/Frankfurt a.M.
Grundlagen, allgemeine Pharmakologie
Möglichkeiten und Probleme der experimentellen Verhaltenspharmakologie von Psychopharmaka
Die Entwicklung praktisch aller heutigen Psychopharmakaklassen geht auf eher zufällige Befunde am Patienten zurück. Das erste Antidepressivum Imipramin beispielsweise sollte ein Neuroleptikum werden und es ist der klinischen Beobachtung des Schweizer Psychiaters Dr. R. Kuhn zu verdanken, dass die antidepressive Wirksamkeit gesehen wurde. Natürlich hat man auf der Suche nach Tiermodellen, um auf ähnliche Substanzen zu testen, nicht auf Bekanntes zurückgreifen können, sondern musste solche Modelle erst entwickeln.
Veränderungen des Spontanverhaltens an gesunden (nicht depressiven) Tieren waren wenig aussagekräftig, zumal das Spontanverhalten deutlich durch die zusätzlichen Rezeptoreffekte geprägt ist, zum Beispiel durch die über den H1-Antagonismus ausgelöste Sedierung, die nicht im Bezug zur antidepressiven Wirkung steht. Die später entwickelten Tests zur Verstärkung der Catecholamin-Wirkung wie der Antagonismus verschiedener Reserpin-Effekte hatten zwar eine deutliche Vorhersagekraft („predictive validity“) für antidepressive Wirkung, aber nur für funktionelle Analoga der trizyklischen Antidepressiva (TZA) oder Monoaminoxidase-Hemmer (MAOH) mit direkten Effekten auf die Verfügbarkeit der Catecholamine. Selektive Serotonin-Wiederaufnahmehemmer (SSRI) sind hier eher nicht wirksam. Bei den Neuroleptika waren es verschiedene Tests auf der Basis von durch dopaminerge Stimulation ausgelösten Stereotypien, die die antidopaminerge Wirkung der Neuroleptika abbilden, aber eben nicht die antipsychotischen Eigenschaften.
Eine deutliche Verbesserung in der Verhaltenspharmakologie der Antidepressiva war der Behaviour-Despair-Test (Schwimmtest), in dem ermittelt wird, wie lange die Versuchstiere nach Eintauchen in einen oben offenen Wasserzylinder herumschwimmen, um eine Möglichkeit des Entkommens zu finden, bis sie aufgeben und ein immobiles Stadium (Rückenlage) annehmen. Dieses Aufgeben wird in Analogie zur Verzweiflung (Despair) in der Depression gesehen. Damit hat der Test schon eine gewisse „face validity“ oder Augenscheinvalidität, da er ein Verhalten testet, das in Zusammenhang mit der Depression gesehen werden kann, wenn auch an gesunden „nicht depressiven“ Versuchstieren. Ursprünglich entwickelt für nur wenige Applikationen von TZA, spricht der Test aber auch auf andere Antidepressiva wie die SSRI an, wenn die Substanzen über mehrere Tage gegeben werden. Der Test ist relativ leicht durchführbar und reproduzierbar und hat eine deutliche prädiktive Validität, allerdings gibt es eine Reihe von Substanzen mit falsch-positivem oder falsch-negativem Testergebnis.
Einige andere Tests zeigen, was man als „construct validity“ oder theoretische Validität bezeichnet, da man hier Tiere mit Depressions-ähnlichem Verhalten einsetzt. Im Separationsmodell werden Jungtiere sozial isoliert (Trennung von den Elterntieren). Als Folge kommt es nach einiger Zeit zu Depressions-ähnlichen Symptomen mit reduzierter Aktivität und beispielsweise Veränderungen der Körperhaltung. Antidepressiva heben diese Verhaltensänderungen auf. Auch hier gibt es verschiedene falsch-positive Substanzklassen. Darüber hinaus bilden die Tiere bestenfalls über die Verhaltensänderungen nur einen kleinen Teil des depressiven Syndroms ab. Auch im Modell des milden chronischen Stress nehmen die Tiere ein für die Depression typisches Verhalten ein. Hier werden die Tiere über längere Zeit einem milden chronischen Stress (Isolation, Lärm, Futterrestriktion) ausgesetzt. Nach einiger Zeit verlieren die Tiere ihre Präferenz für süßes Wasser über normales Trinkwasser. Dies wird als anhedones Verhalten interpretiert in Analogie zur häufig vorhandenen Anhedonie depressiver Patienten. Im Prinzip hat dieser Test damit eine gute theoretische Validität. Er ist aber schwierig durchzuführen und selbst im gleichen Labor zu standardisieren und zeigt große Variabilität von Labor zu Labor.
Ähnliches gilt für den Test der erlernten Hilflosigkeit (learned heplessness). In diesem Test erlernen die Tiere durch für sie unvermeidbare Stimuli eine Hilflosigkeit (Fehlen einer Vermeidungsreaktion), die sie auch nach dem Wegfall der Versuchssituation nicht mehr befähigt, Aufgaben durch eine Verhaltensreaktion zu beeinflussen. Diese Unfähigkeit zu reagieren wird durch Antidepressiva aufgehoben, nicht aber durch Neuroleptika und Anxiolytika. Der Test gilt als ein Beispiel für eine gute theoretische Validität, zumal nicht alle der so behandelten Tiere dieses hilflose Verhalten annehmen und biochemische Veränderungen zeigen, die man auch bei depressiven Patienten findet. Er wird damit nur an den Tieren durchgeführt die „depressiv“ sind. Der Test ist sehr aufwendig, schwierig durchzuführen und zu standardisieren, sodass er in der Pharmaforschung keine große Rolle spielt.
In der Interpretation solcher verhaltenspharmakologischer Befunde muss man sich immer vor Augen halten, dass die Tiere analoge Verhaltensmuster zeigen, aber eben nicht „depressiv“ oder gegebenenfalls auch „psychotisch“ sind (siehe die nächste Folge zur Pharmakologie der Antipsychotika). Keiner der Tests ist allein ausreichend aussagekräftig, sodass man immer versucht, für neue Substanzen möglichst in mehreren Tests positive Effekte zu sehen.
Klinische Psychopharmakotherapie: Antidepressiva (Fortsetzung)
Präparate-Übersicht
Die in Deutschland derzeit im Handel erhältlichen Antidepressiva sind in Tabelle 2-1 mit dem üblichen Dosierungsbereich aufgelistet.
Tab. 2-1. Derzeit in Deutschland im Handel erhältliche Antidepressiva
|
Freiname (INN) |
Handelsname (Beispiel) |
Substanzklasse |
Dosierung [mg/Tag] |
|
Agomelatin |
Valdoxan |
MT-Agonist, |
25–50 |
|
Amitriptylin |
Saroten |
TZA |
50–225 |
|
Amitriptylinoxid |
Amioxid |
modif. TZA |
60–150 |
|
Bupropion |
Elontril |
NDRI |
150–300 |
|
Citalopram |
Cipramil |
SSRI |
20–40 |
|
Clomipramin |
Anafranil |
TZA |
50–225 |
|
Doxepin |
Aponal |
TZA |
50–300 |
|
Duloxetin |
Cymbalta |
SNRI |
30–120 |
|
Escitalopram |
Cipralex |
SSRI |
10–20 |
|
Fluoxetin |
Fluctin |
SSRI |
20–60 |
|
Fluvoxamin |
Fevarin |
SSRI |
50–300 |
|
Imipramin |
Imipramin-Generikum |
TZA |
50–300 |
|
Johanniskraut |
Laif 900 |
Phytopharmakon (Trockenextrakte) |
900 |
|
Neuroplant |
600 |
||
|
Maprotilin |
Ludiomil |
TeZA |
50–225 |
|
Mianserin |
Mianserin-Generikum |
TeZA |
30–90 |
|
Milnacipran |
Milnaneurax |
SNRI |
25–100 |
|
Mirtazapin |
Remergil |
NaSSA |
15–45 |
|
Moclobemid |
Aurorix |
RIMA |
300–600 |
|
Paroxetin |
Seroxat |
SSRI |
10–50 |
|
Reboxetin |
Solvex |
NARI |
4–12 |
|
Sertralin |
Zoloft |
SSRI |
50–200 |
|
Tianeptin |
Tianeurax |
SRE |
25–37,5 |
|
Tranylcypromin |
Jatrosom |
MAOH |
20–60 |
|
Trazodon |
Trazodon-Generikum |
Rezeptorantagonist |
150–600 |
|
Trimipramin |
Stangyl |
TZA |
100–400 |
|
Venlafaxin |
Trevilor ret. |
SNRI |
75–375 |
MAOH: Monoaminoxidasehemmer; NARI: selektiver Noradrenalin-Rückaufnahme-Inhibitor; NaSSA: Noradrenalin-Serotonin selektives Antidepressivum; NDRI: selektiver Noradrenalin-Dopamin-Rückaufnahme-Inhibitor; RIMA: reversibler Inhibitor Monoaminoxidase A; SNRI: selektiver Serotonin-Noradrenalin-Rückaufnahme-Inhibitor; SRE: Serotonin-Rückaufnahme-Enhancer; SSRI: selektiver Serotonin-Rückaufnahme-Inhibitor; TZA: trizyklisches Antidepressivum; TeZA: tetrazyklisches Antidepressivum; MT: Melatonin-Rezeptor; 5-HT Serotonin-Rezeptor
a„Second-Line“ (Behandlung mit einem anderen Antidepressivum erfolglos)
Die ambulant meistverordneten Präparate in Deutschland waren 2016 Citalopram, Venlafaxin, Mirtazapin und Sertralin (Arzneiverordnungsreport 2017).
Das atypische Antipsychotikum Quetiapin ist jüngst auch zur Zusatzbehandlung (Add on) von (therapieresistenten) Depressionen zugelassen worden.
Zur Prophylaxe von Depressionen werden neben Antidepressiva auch Stimmungsstabilisierer wie Lithium und Lamotrigin eingesetzt, bei bipolaren Depressionen kommt Quetiapin die derzeit beste Evidenz zu. Für die Rezidivprophaxe unipolarer Depressionen ist Quetiapin nicht zugelassen, allerdings scheint es Studien nach auch wirksam zu sein.
Trizyklische Antidepressiva (TZA)
Trizyklische Antidepressiva (=NSMRI, nichtselektive Monoamin-Wiederaufnahmehemmer) wie Amitriptylin, Clomipramin, Doxepin oder Nortriptylin haben sich bei der Behandlung von Depressionen seit vielen Jahren bewährt und erwiesen sich bei etwa 70% der Patienten in kontrollierten Studien als wirksam. Die Dosierung erfolgt in der Regel einschleichend (initial 50–75 mg/Tag) bis zu Tagesdosen von 150 mg, die bei schwereren depressiven Episoden ambulant nicht selten erforderlich sind. Trimipramin ist zwar chemisch ein TZA, hat aber keinen Effekt auf die Monoaminaufnahme. Es wirkt als Antagonist an Histamin-, Serotonin- und Dopaminrezeptoren.
Serotonin-selektive Antidepressiva
In vielen Ländern haben sich inzwischen Serotonin-selektive Antidepressiva als „First-Line“-Standard-Antidepressiva etabliert. In Deutschland sind derzeit sechs Serotonin-selektive Rückaufnahmehemmer (SSRI) verfügbar. Hinsichtlich ihrer Wirksamkeit sind diese Substanzen basierend auf Tagesdosen von 20 mg Fluoxetin/20 mg Paroxetin/20 mg Citalopram/10 mg Escitalopram/50 mg Sertralin/150 mg Fluvoxamin vergleichbar, wobei höhere Dosen in der Regel nicht zu einer erhöhten Wirksamkeit führen. Für Escitalopram wurde in kontrollierten Vergleichsstudien eine Überlegenheit gegenüber Citalopram, Fluoxetin und Paroxetin belegt. Die einfache Verordnung (1 Tablette/Tag) impliziert, dass die in der ambulanten Praxis nicht seltene Unterdosierung von Antidepressiva bei diesen Substanzen kaum vorkommt.
Noradrenalin- und Serotonin-selektive Antidepressiva
Zu den Noradrenalin- und Serotonin-selektiven Antidepressiva (SNRI/NaSSA) gehören Duloxetin, Venlafaxin, Mirtazapin und Milnacipran. Für diese sogenannten dualen Antidepressiva liegen Studien und Metaanalysen einer möglicherweise überlegenen Wirksamkeit gegenüber SSRI vor, auch wird eine Wirkungsäquivalenz mit Trizyklika angenommen.
Das Noradrenalin-selektive Reboxetin (in Deutschland keine GKV-Kostenerstattung mehr) wirkt eher aktivierend.
Noradrenalin- und Dopamin-Wiederaufnahmehemmer
Seit 2007 ist der selektive Noradrenalin-Dopamin-Wiederaufnahmehemmer (NDRI) Bupropion zur Depressionstherapie in Deutschland zugelassen. Die Substanz besitzt ein aktivierendes Profil und wird in den USA häufig zur Augmentation eingesetzt.
Melatonin- und Serotonin-selektive Antidepressiva
Seit 2009 ist in Deutschland Agomelatin verfügbar. Der Melatonin-MT1/MT2-Rezeptoragonist und Serotonin-5-HT2C-Rezeptorantagonist scheint insbesondere den im Rahmen der Depression gestörten Schlaf-Wach-Rhythmus zu normalisieren.
Das seit 1988 in Frankreich, seit 2012 in Deutschland verfügbare Tianeptin moduliert glutamaterge Mechanismen, verkürzt die Verweildauer von Serotonin an der Synapse durch eine Aktivierung der Serotoninrückaufnahme und aktiviert besonders deutlich die Neuroplastizität. Die Wirkung scheint derjenigen der SSRI vergleichbar.
Multimodale Antidepressiva
Diese Antidepressiva weisen eine Kombination unterschiedlicher Angriffspunkte und Wirkungsmechanismen im gleichen Transmittersystem auf. Im Falle der Substanz Vortioxetin sind dies Effekte auf prä- und post-synaptische Serotoninrezeptoren sowie eine Hemmung des Serotonintransporters. Besondere Wirkeffekte auf kognitive Funktionen wurden beschrieben. Der Hersteller hat die Substanz 2017 in Deutschland vom Markt genommen, da ihr kein Zusatznutzen attestiert und ein unwirtschaftlicher Erstattungspreis angeboten wurde (Tagestherapiekosten unter 10 Cent). Sie ist aber beispielsweise in Österreich oder der Schweiz verfügbar. Auch die Altsubstanz Trazodon hat multimodale Eigenschaften (Hemmung der Serotoninaufnahme und 5-HT2-Antagonismus), ist aber auch ein Antagonist an Alpha-1- und Alpha-2-Rezeptoren.
MAO-Hemmer
Eine Sonderstellung unter den Antidepressiva nehmen die Monoaminoxidasehemmer (MAOH) ein. Verfügbar sind der irreversible, nichtselektive MAO-Hemmer Tranylcypromin sowie der reversible MAO-A-Hemmer (RIMA) Moclobemid. MAOH wird eine besondere Wirksamkeit bei sogenannten atypischen Depressionen attestiert, Tranylcypromin wird vor allem bei sogenannten therapieresistenten Depressionen eingesetzt. Trotz entsprechender Expertenempfehlungen werden irreversible MAOH (zu) selten verordnet.
Phytopharmaka (pflanzliche Präparate)
Bei leicht- bis mittelgradigen Depressionen kann – insbesondere wenn beim Patienten eine entsprechende Attitüde und Präferenz besteht – ein Behandlungsversuch mit einem Johanniskrautpräparat (Hypericum-Extrakt) gemacht werden.
Kontrollierte Untersuchungen der letzten Jahre an ambulanten Patienten belegen eine vergleichbare Wirksamkeit für einige Hypericum-perforatum-Extrakte vs. Citalopram, Paroxetin und Sertralin u.a. Nur für zwei Präparat (Neuroplant®, Laif® 900) sind die Daten ausreichend für eine Zulassung zur Therapie leichter bis mittelschwerer depressiver Episoden. Diese beiden Präparate werden auch durch die gesetzlichen Kassen erstattet. Für alle anderen Präparate liegen keine ausreichenden Belege für eine klinische Wirksamkeit vor. Zu bemerken ist, dass Johanniskraut zu den häufigen „Selbstmedikationen“ zählt (Over-the-Counter-Medikation) und über die Hälfte der Selbstanwender ihren Arzt über die Selbstmedikation nicht informiert. Dies ist angesichts möglicher Interaktionen zu beachten. Für andere zur „Stimmungsaufhellung“ propagierte Phytopharmaka liegt ebenso wie für homöopathische Präparate kein Wirksamkeitsbeleg vor.
Neuzulassungen und -entwicklungen
In den USA zur Depressionsbehandlung zugelassen wurden der nichtselektive irreversible MAO-Hemmer Selegilin (transdermal) und der Venlafaxin-Metabolit Desvenlafaxin, experimentelle Studien liegen unter anderem mit dem antimuskarinergen Scopolamin und dem N-methyl-D-Aspartat-Rezeptorantagonisten Ketamin (beide als schnell-, aber kurzwirksame Substanzen nach i.v. Applikation), mit Botulinumtoxin/(Botox)-Injektionen und dem COX-2-Hemmer Celecoxib vor.
Ketamin wird in subanästhetischen Dosen als i.v. Infusion (nur wenige Dosen) bei therapieresistenten Depressionen eingesetzt mit variabler Wirkung über wenige Tage. Das ähnliche Esketamin steht vor der Zulassung. Ketamin scheint bei Kurzzeitapplikation ähnliche Plastizitätsmechanismen anzustoßen wie Antidepressiva nach längerer Gabe. Botulinumtoxin wird einmalig in die Glabellaregion injiziert und unterbricht die Facial-Feedback-Schleife durch gezielte Hemmung mimischer Muskel. Ein neuer Review von 14 Studien mit über 6200 Patienten ergab erste Hinweise für eine antidepressive Wirksamkeit antiinflammatorischer Substanzen. Die meisten Daten liegen hierbei für Celecoxib vor. In Entwicklung sind Glutamat/NMDA-Rezeptorantagonisten/Modulatoren sowie neuronale Nikotin-Rezeptor-Modulatoren. Für einzelne Antidiabetika (Pioglitazon), Antibiotika (Minocyclin) und Darm-Mikrobiota („Psychobiotica“) wurden ebenfalls erste antidepressive Effekte beschrieben. Auch Omega-3-Fettsäuren (mehrfach ungesättigten Fettsäuren, PUFA) kommt möglicherweise eine antidepressive Wirksamkeit zu.
Perspektivisches Ziel ist eine personalisierte Antidepressiva-Therapie basierend auf Biomarkern und Genotypen. Angesichts der Komplexität der Genregulation und den multiplen Interaktionen mit Umweltfaktoren ist von einem weiten Forschungsweg auszugehen.
Behandlungsablauf
Akuttherapie
Nach Stellen der medikamentösen Behandlungsindikation und Vorliegen der Voruntersuchungsergebnisse (Labor, EKG, s.o.) sollte in der Regel mit einer niedrigen Anfangsdosis begonnen werden (gilt nicht für die SSRI), sedierende Substanzen werden bevorzugt als abendliche Einmaldosis verordnet. Bei der Dosierung ist zu beachten, dass zwischen einzelnen Substanzen pharmakokinetische Unterschiede bestehen, die eine Dosisreduktion bei Alterspatienten, Nieren- oder Lebererkrankungen erforderlich machen (Tab. 2-2).
Tab. 2-2. Dosierungsanpassung neuerer Antidepressiva bei speziellen Patientengruppen
|
Alterspatient |
Nierenerkrankung |
Lebererkrankung |
|
|
Agomelatin |
|||
|
Bupropion |
– |
↓ |
↓ |
|
Duloxetin |
|||
|
Escitalopram |
↓↓↓ |
– |
– |
|
Mirtazapin |
– |
↓↓ |
↓↓↓ |
|
Moclobemid |
– |
– |
↓↓↓ |
|
Paroxetin |
↓↓↓ |
↓↓↓ |
↓↓↓ |
|
Reboxetin |
↓↓↓ |
↓↓↓ |
↓↓↓ |
|
Sertralin |
↓↓ |
– |
– |
|
Venlafaxin |
– |
↓↓↓ |
↓↓↓ |
Triyzklische Antidepressiva werden aus Verträglichkeitsgründen schrittweise bis zur Zieldosis aufdosiert (Zieldosis 75 bis 150 mg täglich in der Regel). Auch die neueren Antidepressiva (SSRIs, SSNRIs) werden oft aufdosiert, für SSRIs führen Dosiserhöhungen aber nicht zu besseren Therapieerfolgen (Ausnahme niedrige Plasmaspiegel). Für Venlafaxin und Tranylcypromin sind Wirksamkeitssteigerungen durch höhere Dosen belegt.
Als äquivalente Tagesdosen wurden errechnet: Fluoxetin 40 mg, Paroxetin 34 mg, Agomelatin 53 mg, Amitriptylin 122 mg, Bupropion 349 mg, Clomipramin 116 mg, Doxepin 140 mg, Escitalopram 18 mg, Fluvoxamin 143 mg, Imipramin 137 mg, Lofepramin 250 mg, Maprotilin 118 mg, Mirtazapin 51 mg, Moclobemid 575 mg, Reboxetin 12 mg, Sertralin 99 mg, Trazodon 401 mg und Venlafaxin 149 mg.
Auswahlkriterien. Die allgemeinen Auswahlkriterien zur Auswahl eines Antidepressivums sind in Abbildung 2-1 zusammengefasst.
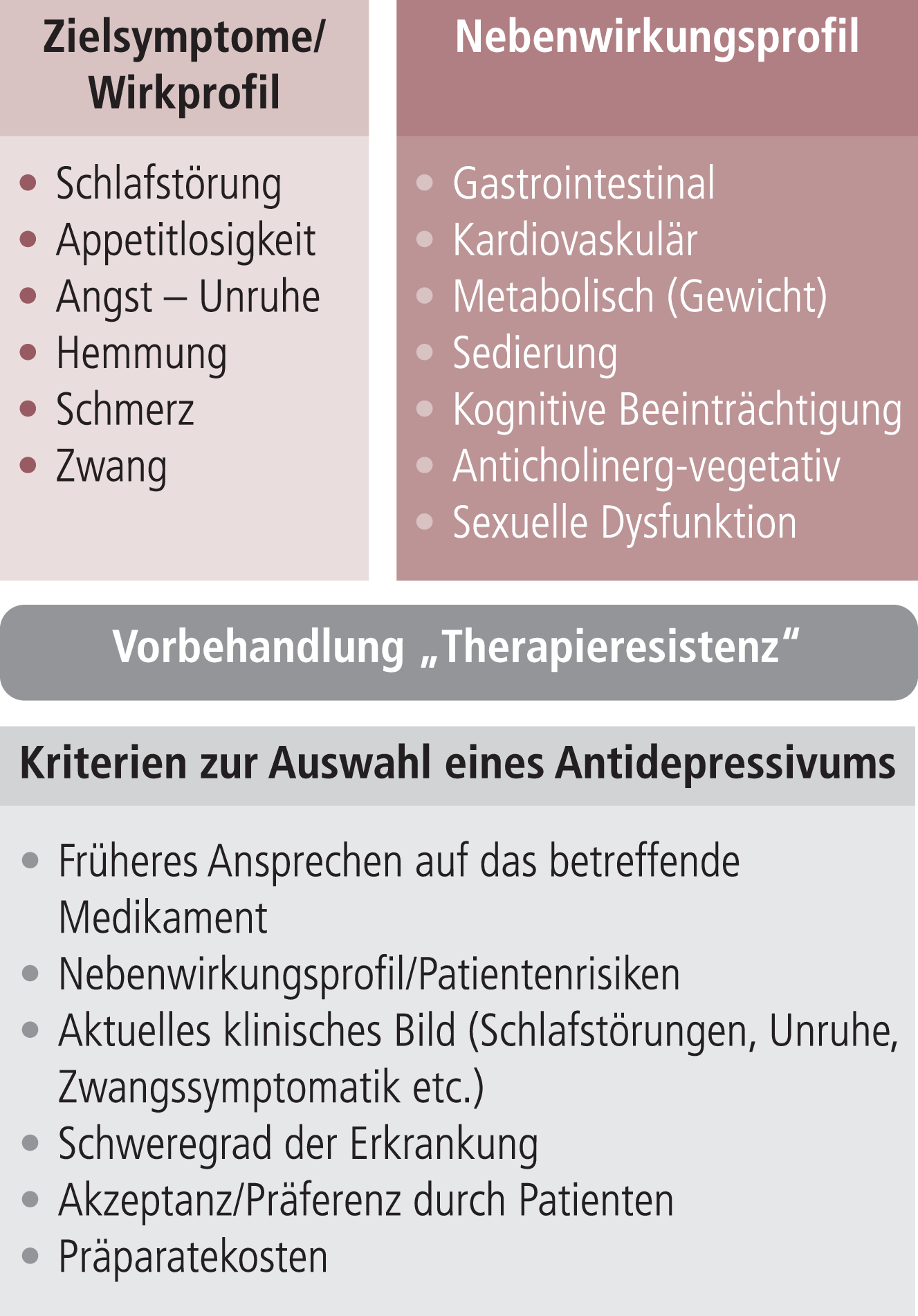
Abb. 2-1. Auswahlkriterien für Antidepressiva
Risikofaktoren und Nebenwirkungsprofil. Von großer Bedeutung sind eventuell vorliegende somatische Risikofaktoren wie Prostatahyperplasie, Hypertonie, koronare Herzkrankheit und Glaukom (s. Kontraindikationen für Trizyklika). Anfälligkeiten und Empfindlichkeiten des Patienten müssen mit dem Nebenwirkungsprofil des in Frage kommenden Antidepressivums in Einklang gebracht werden. Das Auftreten unerwarteter oder intensiver Nebenwirkungen sollte den Verdacht auf das Vorliegen einer Metabolisierungsstörung („poor metabolizer“) lenken und eine Plasmaspiegelkontrolle (therapeutisches Drug-Monitoring) nach sich ziehen Zu Beginn der Therapie mit einem SSRI sollte auf Blutungsneigung, Diarrhö, Hyponatriämie und auf die mögliche Zunahme von motorischer Unruhe, Angst und Suizidgedanken geachtet werden.
Für die Auswahl des Antidepressivums entscheidend sind die Arzneimittelsicherheit (Nutzen-Risiko-Index), die Verträglichkeit sowie Preis/Kosten. Diese Auswahlkriterien – v.a. der Faktor Toxizität – implizieren eine Präferenz neuerer Antidepressiva (SSRI, SNRI).
Klinisch-psychopathologisches Bild. Als wichtiges Auswahlkriterium sollte das aktuelle klinisch-psychopathologische Bild gelten: Bei deutlichen Schlafstörungen oder psychomotorischer Agitiertheit sollten sedierende Antidepressiva präferiert werden (Trimipramin, Mirtazapin, Agomelatin, Amitriptylin, Doxepin, Maprotilin, Trazodon), bei zwanghaften Depressionen serotonerge Antidepressiva wie SSRI oder Clomipramin. Bei wahnhaften Depressionen werden zusätzlich Neuroleptika/Antipsychotika eingesetzt (s. unten).
Tabelle 2-3 gibt eine Übersicht zur Auswahl nach Zielsymptomen bzw. UAWs.
Tab. 2-3. Auswahl nach Zielsymptomen bzw. UAWs
|
Therapie-Begleiteffekt |
Empfohlenes Antidepressivum |
Zu vermeidendes Antidepressivum |
|
Gewichtszunahme |
SSRI |
Mirtazapin, Amitriptylin |
|
Sexuelle Dysfunktion |
Agomelatin, Moclobemid, Bupropion, Reboxetin |
SSRIs, Venlafaxin |
|
Schlafförderung |
Mirtazapin, Agomelatin, Amitriptylin, Doxepin, Trimipramin |
MAOH, Bupropion |
|
Antriebssteigerung |
MAOH, Nortriptylin |
Amitriptylin, Doxepin, Trimipramin, Mirtazapin |
|
Kardiotoxizität |
Sertralin |
TZA |
|
Blutdruckerhöhung |
Venlafaxin, Milnacipran |
|
|
Krampfschwellensenkung |
SSRI |
Bupropion,Maprotilin |
|
Schmerzdistanzierung |
Duloxetin, Amitriptylin, Clomipramin, Venlafaxin, Mirtazapin |
|
|
Kognitive Dysfunktion |
Vortioxetin |
TZA |
Komedikation. Vor allem bei Patienten mit dominierender ängstlich-agitierter Symptomatik sowie bei gravierenden Schlafstörungen ist eine initiale Komedikation mit einem Benzodiazepin oder einem sedierenden, schwach potenten Neuroleptikum (z.B. Chlorprothixen, Pipamperon) empfehlenswert.
Responseprädiktoren. Eine erhöhte neuerliche Responsewahrscheinlichkeit besteht für das Präparat, auf das der Patient früher gut angesprochen hat. Mehrere Untersuchungen konnten zeigen, dass frühe Besserung innerhalb von zwei Wochen prädiktiv für den Behandlungserfolg (spätere stabile Response) ist. Umgekehrt macht ein Ausbleiben einer partiellen Besserung innerhalb der ersten beiden Behandlungswochen das Erreichen einer Remission unwahrscheinlich (<15%).
Aus klinischer Sicht gelten Wahnideen, neurotische Primärpersönlichkeit, schizoide Züge sowie Nichtansprechen auf frühere Antidepressiva-Behandlungen als prädiktiv für ein schlechtes Ansprechen. Mehrfach belegt ist, dass eine dominierende Angstsymptomatik ein Prädiktor für eine schlechte Antidepressiva-Response ist.
Relevante Geschlechtsunterschiede im Ansprechen auf Antidepressiva bestehen trotz gewisser pharmakokinetischer Unterschiede offenbar nicht.
Als genetische Prädiktoren vor allem für Response auf SSRI wurden Polymorphismen unter anderem in Serotonin-Transportergenen (5-HT1A- und 5-HT2A-Rezeptor) beschrieben. Visionär ist die Entwicklung von Gentests zur Responsevorhersage („personalisierte Medizin“), ein Ansatzbeispiel ist der (sehr umstrittene) ABCB1-Gentest für einen Polymorphismus eines Auswärtstransporters an der Blut-Hirn-Schranke.
Neue Bildgebungsstudien sprechen dafür, dass Dysfunktionen regionaler neuronaler Regelkreise (z.B. Amygdala, präfrontaler Kortex) eine Response-Vorhersage auf eine Antidepressiva-Therapie möglich erscheinen.
Prädiktoren für das Ansprechen auf MAO-Hemmer sind:
- Angstsymptome
- Atypische vegetative Symptome: Hypersomnie, Hyperphagie
- Vorliegen einer „atypischen Depression“
- „Neurotizismus“: Somatisierungstendenz, hysteriforme Persönlichkeit, Selbstmitleid, Beschuldigung anderer, Irritierbarkeit und Reizbarkeit
- Auslösender Stress, Life Events
Interessant ist der Befund, dass bei chronifizierten Depressionen die Behandlungspräferenz des Patienten wesentlich für das Therapieansprechen ist: Patienten mit einer Präferenz für die medikamentöse Therapie remittierten unter Medikation zu 46% (unter Psychotherapie nur zu 22%), Patienten mit Psychotherapiepräferenz sprachen auf diese zu 50% an (auf Medikation nur zu 7,7%; Kocsis et al. 2009).
EbM-Info. Zahlreiche Placebo-kontrollierte Studien belegen die Wirksamkeit der verschiedenen Antidepressiva: die Responseraten liegen nach Akuttherapiestudien (bis 12 Wochen) durchschnittlich bei 50 bis 70% vs. 25 bis 40% unter Placebo, die durchschnittliche Placebo-Verum-Differenz beträgt etwa 20%. Dies entspricht einer Effektstärke von 0,3 und einer „Number needed to treat“ (NNT) von 6. Die Remissionsraten in der Akutbehandlung mit einem Antidepressivum liegen in der Regel nur bei etwa 35 bis 45%, die NNT liegt bei 8 bis 11.
Langzeittherapie
Erhaltungstherapie. Wie in Abbildung 2-2 dargestellt, beginnt die Erhaltungstherapie nach Remission der Symptomatik im Sinne einer Remissionsstabilisierungsphase. Diese ist durch eine erhöhte psychobiologische Vulnerabilität definiert und umfasst einen Zeitraum von etwa 6 bis 18 Monaten. Für den Einsatz der neueren Antidepressiva spricht die insgesamt bessere Verträglichkeit bzw. geringere Nebenwirkungsrate sowie die damit in Zusammenhang stehende höhere Patientencompliance.
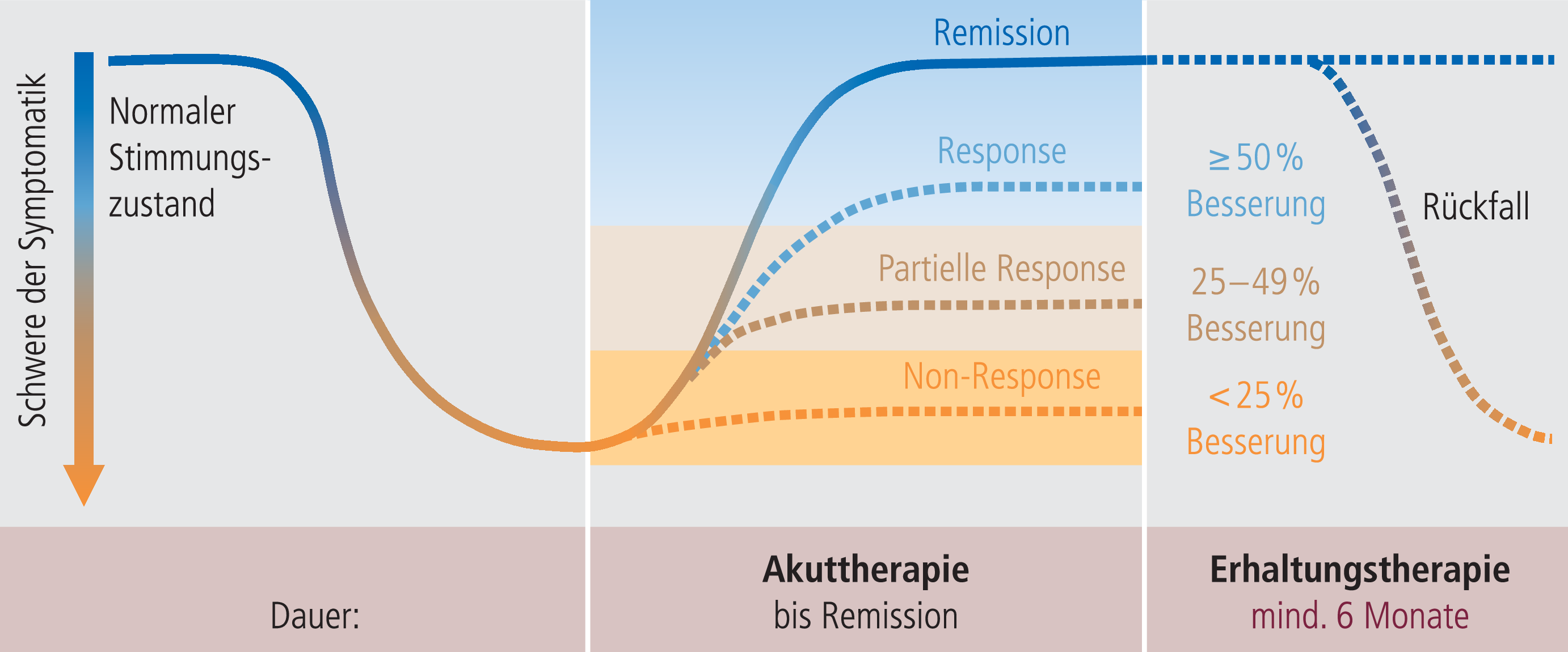
Abb. 2-2. Mögliche Verlaufsformen der unipolaren Depression und deren Therapie
Angesichts der oben dargestellten hohen Rezidiv-Wahrscheinlichkeit von Depressionen überrascht es nicht, dass 30 bis 50% der Patienten innerhalb von vier Monaten nach Absetzen einer erfolgreichen Antidepressiva-Medikation ein Rezidiv erleiden. Guidelines empfehlen deshalb eine Erhaltungstherapiedauer von etwa sechs Monaten ohne Dosisreduktion.
Untersuchungen in der Praxis ergeben leider ein anderes Bild: etwa die Hälfte der Patienten setzt die Antidepressiva binnen drei bis sechs Monaten ab, die Mehrzahl teilt das Absetzen ihrem behandelnden Arzt nicht mit. Insbesondere im Rahmen der primärärztlichen Versorgung herrscht ein inadäquates Verschreibungsmuster von Antidepressiva vor. Die Adhärenz-Einschätzung war zwischen Patienten und Ärzten signifikant unterschiedlich, Ärzte unterschätzen die Adhärenz.
Rezidivprophylaxe. Indikationen für eine rezidivprophylaktische Therapie sind:
- ≥3 Depressive Episoden oder ≥2 kurz aufeinanderfolgende Episoden
- Vorbestehende Dysthymie
- Höheres Ersterkrankungsalter
- Schwere, lang dauernde Episoden
- Positive Familienanamnese mit affektiven Erkrankungen
- (Partielle) Initiale Non-Response auf Antidepressivum
- Komorbidität (Angsterkrankung, Abhängigkeit)
Die Dauer der Rezidiv-prophylaktischen Behandlung variiert entsprechend und umfasst vor allem bei ungünstigen Prognosefaktoren (u.a. hohe Episodenzahl, Residualsymptome) Jahre.
Die evidenzbasierte Datenlage zur Antidepressiva-Langzeittherapie ist limitiert. In einem Review konnte eindrucksvoll gezeigt werden, dass die Rückfallrate bei Placebo-Respondern 24%, bei „echten“ Antidepressiva-Respondern nur 7% betrug. Ein Review der bei der FDA über 25 Jahre (1987–2012) eingereichten 15 Erhaltungstherapiestudien kam zu signifikant niedrigeren Rezidivraten unter dem entsprechenden Antidepressivum im Vergleich zu Placebo (mittlere Relapseraten-Differenz 18%, durchschnittliche Reduktion der Rückfallrate von 52% vs. Placebo). Eine Metaanalyse von 31 randomisierten Studien mit über 4400 Patienten fand ein Rezidiv-Risiko von knapp 18% unter Antidepressiva vs. 41% unter Placebo innerhalb von ein bis drei Jahren, was einer Rückfallrisikoreduktion von etwa 70% – trotz einer Abbruchrate von etwa 18% – entspricht (Abb. 2-3).
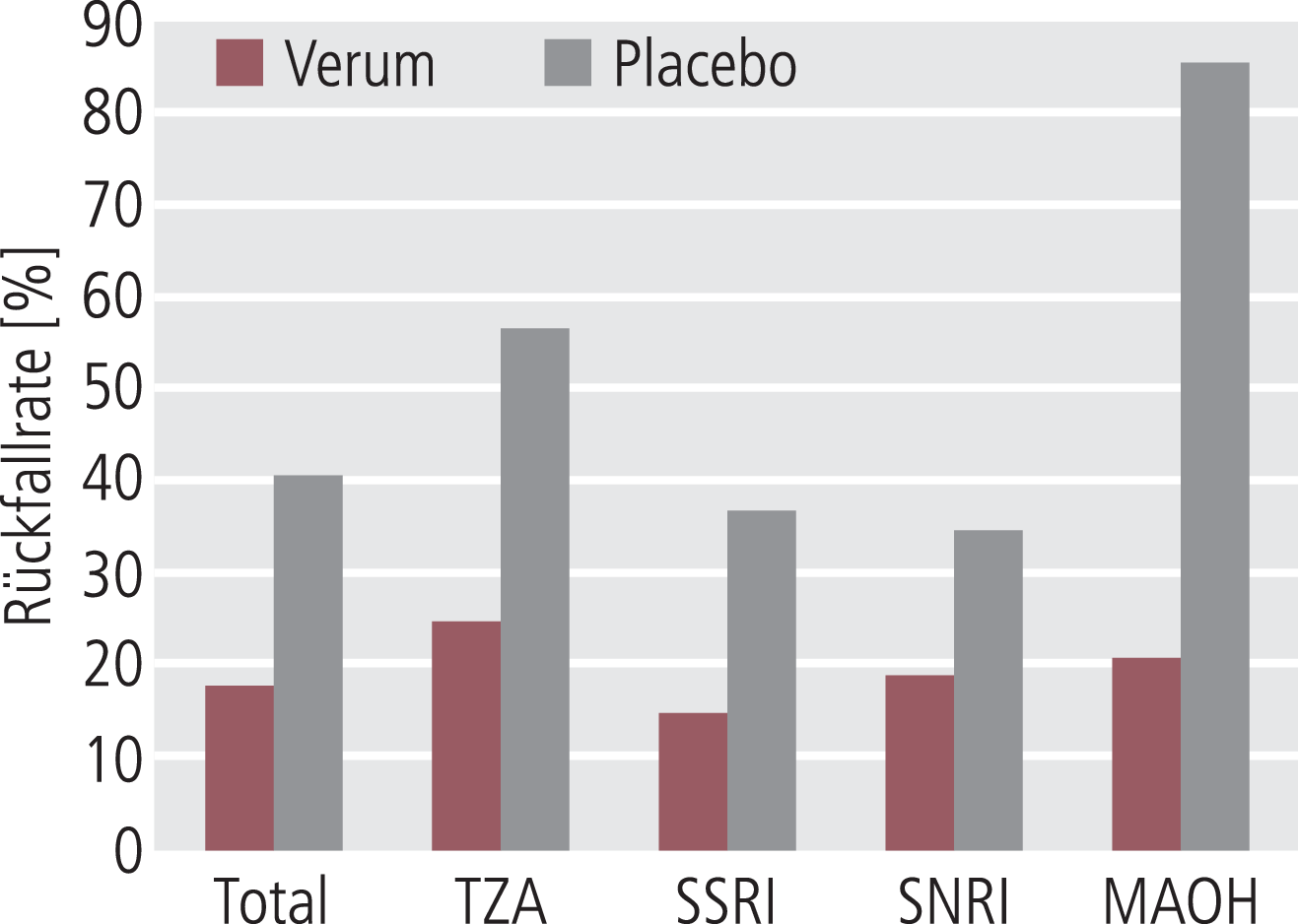
Abb. 2-3. Metaanalyse zum Rückfallrisiko unter Antidepressiva vs. Placebo (nach Geddes et al. 2003)
Aufgrund des methodologisch anspruchsvollen Studiendesigns verdienen die PREVERS-Studie (Prevention of recurrent depression with sertraline) sowie die PREVENT-Studie (Results from the prevention of recurrent episodes of depression with venlafaxine for two years) Beachtung. In ersterer Studie ergab sich unter Placebo ein 2,3-fach höheres Rezidiv-Risiko, bei chronifiziert Schwerkranken war die Differenz zwischen Verum und Placebo noch deutlicher. Die Venlafaxin 2-Jahres-Studie belegte ebenfalls das signifikant erhöhte Rezidiv-Risiko unter Placebo (28% vs. 47%).
EbM-Info. Die Effektstärke von Antidepressiva in der Rezidiv-Prophylaxe liegt bei etwa 0,6 und mit einer NNT von 5 in einem sehr gut wirksamen Bereich (Evidenzlevel Ia).
Von Kritikern wird immer wieder behauptet, dass Antidepressiva kaum wirksamer als Placebos seien. Hierzu ist unter anderem festzustellen, dass eine Zulassung durch die unabhängigen Behörden (BfArM, EMA) nur erfolgt wenn eindeutige positive Studienergebnisse vorliegen. Die geforderten randomisierten kontrollierten Studien (RCTs) müssen hohe methodische Standards erfüllen (höher als in Psychotherapie-Studien, in denen ja keine echte „Placebo-Kontrollgruppe“ möglich ist). Problematisch ist allerdings die hohe Patientenselektion (Ein- und Ausschlusskriterien, unter anderem keine multimorbiden Patienten, keine Komedikationen), weshalb sogenannte „Real-World“-Studien (randomisierte Vergleichsstudien, nichtinterventionelle Studien u. ä.) an Bedeutung gewinnen. In den letzten Jahren ist ein kontinuierliches Ansteigen der Placebo-Responseraten in klinischen Studien zu verzeichnen. Dies dürfte unter anderem damit zusammenhängen, dass in die überwiegend ambulant durchgeführten klinischen Prüfstudien immer breitere „depressive Syndrome“ (leichtgradige Depressionen im Grenzbereich zu „normalen Verstimmungen“) eingeschlossen werden und eine intensive Betreuung der Studienpatienten mit unspezifischen „Psychotherapieeffekten“ (Zuspruch, Aktivierung, Vermittlung von Hoffnung, Suggestivwirkungen) erfolgt. Metaanalysen von RCTs zeigen im Schnitt Placebo-Verum-Differenzen von 20%; dies wird nicht nur als signifikant, sondern unter Beachtung der Tatsache, dass auch in der Placebo-Gruppe „behandelt“ wird („clinical management, unspezifische Psychotherapie“), als klinisch relevant angesehen. Bei (mittel-)schweren Depressionen profitieren bis zu 30% der Patienten über die Placebo-Rate hinaus von Antidepressiva. Placebo-Responseraten nehmen mit der Depressionsschwere ab. Für den optimierten Einsatz von Antidepressiva ist die psychiatrische Diagnostik, die nicht nur Schweregrad, sondern auch Art der Depression berücksichtigt, von wichtiger Bedeutung. Eine Studie aus dem Netzwerk Depression zeigt aber, dass selbst bei leichten Depressionen Placebo zwar schlechter wirksam ist als Sertralin (signifikant), aber fast so gut ist wieVerhaltenstherapie, während keine Intervention praktisch keine Verbesserung zeigte.
Die Übertragbarkeit kontrollierter klinischer Prüfstudien auf die (Routine-)Versorgungsbedingungen in Klinik und Praxis ist limitiert. Es werden weit überwiegend ambulante Patienten eingeschlossen, zum Teil rekrutiert aus Registern, diagnostisch sehr heterogen mit kostenloser Behandlung ohne suffiziente Compliance-Kontrolle. Die Studiendauer beträgt in der Regel nur vier bis sechs Wochen. Außerdem handelt es sich hierbei um Mittelwertunterschiede, die nicht den Nutzen für den einzelnen Patienten abbilden. Metaanalysen beinhalten Synthesen heterogener Daten mit faszinierend großen Zahlen, die Ergebnisse können aber nur so valide sein wie die Qualität der in die Analyse einbezogenen einzelnen Studien.
Die International Study to Predict Optimised Treatment in Depression (iSPOT-D) untersuchte an 17 Zentren in fünf Ländern 1008 ambulante Patienten und behandelte randomisiert mit Escitalopram, Sertralin oder Venlafaxin über acht Wochen. Ohne Unterschied zwischen den einzelnen Substanzen betrugen die klinisch relevanten Responseraten etwa 62%, die Remissionsraten 45%. Die Nebenwirkungen wurden als minimal oder mild beschrieben bei einer Rate unter 25%.
In naturalistischen Studien stationär behandelter Patienten werden meist deutlich höhere Response- und Remissionsraten gefunden: Von n=1014 im Rahmen des Kompetenznetzes Depression behandelten Depressiven respondierten 69%, 52% remittierten, der HAMD-Gesamtscore sank von 22,3 auf 8,8). Im Munich Antidepressant Response Signature (MARS)-Projekt respondierten 81% der 842 MPI-Patienten, 58% remittierten.
Nota: Eine Metaanalyse kam zu dem interessanten Ergebnis, dass Psychopharmaka in ihrer Wirksamkeit im Vergleich „somatisch-internistischen“Medikamenten keinesfalls unterlegen sind.
Vielfach wird die Schwangerschaft als depressions-protektiv angesehen, eine große Studie konnte allerdings aufzeigen, dass 43% der Patientinnen mit früheren Depressionen während der Schwangerschaft wiedererkrankten (26% unter Medikation, 68% nach Absetzen des Antidepressivums in der Schwangerschaft). Dies sollte bei der Entscheidung über eine Medikation in der Schwangerschaft berücksichtigt werden (siehe später).
Ungünstige Dosisreduktion. Zur Verbesserung der Compliance und Verträglichkeit erfolgt in der Routineverordnungspraxis zumeist eine Dosisreduktion. Studienergebnisse sprechen jedoch dafür, dass signifikant bessere Rezidiv-prophylaktische Effekte bei Beibehaltung der vollen Antidepressiva-Dosis erzielt werden.
Für einzelne Antidepressiva wird neben zusätzlichen Indikationen – z.B. serotonerge Substanzen bei Zwangsstörungen, Angst- und Panikstörungen – eine differenzielle Wirkung auf einzelne Depressionssymptome postuliert. Für Duloxetin wurde eine besondere Wirksamkeit auf die Schmerzsymptomatik beschrieben, für Trimipramin auf wahnhafte Depressionen, für Mirtazapin und Agomelatin auf Schlafstörungen bzw. den Schlaf-Wach-Rhythmus, für Vortioxetin bezüglich kognitiver Symptome.
Unerwünschte Wirkungen von Antidepressiva
Je nach Datenbasis treten bei etwa 25 bis 64% der mit Antidepressiva behandelten Patienten unerwünschte Arzneimittelwirkungen (UAW) auf. In klinischen Studien sind UAWs typischerweise unterrepräsentiert, im europäischen (Deutschland, Österreich, Schweiz) Pharmakovigilanzprogramm AMSP (Arzneimittelsicherheit in der Psychiatrie) fand sich bei über 53000 überwachten stationär behandelten Patienten eine schwere UAW-Rate von 0,9%. Die unerwünschten Wirkungen treten typischerweise zu Beginn der Behandlung auf und lassen im Verlauf nach. Bei Auftreten unerwarteter UAWs oder von Nebenwirkungen unter geringer Dosierung empfiehlt sich ein therapeutisches Drug-Monitoring (TDM), um das Vorliegen von Poor-Metabolizern von Cytochrom-P450-Enzymen (z.B. CYP2D6) zu identifizieren.
Im Zentrum der Antidepressiva-Nebenwirkungen stehen vor allem folgende:
Zentrale und periphere anticholinerge Nebenwirkungen. Vor allem unter TZA können kognitive Defizite und Delirien sowie Obstipation (cave Ileus!), Mundtrockenheit, Schwitzen und Akkommodationsstörungen auftreten. Diese sind vor allem bei älteren Patienten von hoher klinischer Relevanz.
Gewichtszunahme. Neben ästhetischen Gründen ist Übergewicht mit deutlich erhöhter Morbidität assoziiert und deshalb nicht nur für die Compliance von hoher Bedeutung. Die Rolle krankheits- und verhaltensimmanenter Faktoren (ungünstige Ernährung, körperliche Inaktivität) ist bei der Beurteilung von Medikamenteneffekten schwer abzuschätzen. In einem umfassenden Review fand sich bei Kurzzeitbehandlung (<12 Wochen, n=14050 Patienten) die größte Gewichtszunahme unter Mirtazapin und Amitriptylin, bei Langzeitbehandlung (>4 Monate, n=5789 Patienten) unter Paroxetin, Amitriptylin und Mirtazapin.
Metabolische und endokrine Nebenwirkungen. Die Langzeittherapie mit Antidepressiva ist ungefähr mit einem doppelten Diabetesrisiko assoziiert.
Gastrointestinale Nebenwirkungen. Vor allem unter SSRIs kann es relativ häufig zu Übelkeit, Nausea, auch zu Erbrechen und Diarrhö kommen. Das Risiko von Blutungen des oberen Gastrointestinaltrakts ist erhöht. 0,5 bis 3% der Patienten unter Antidepressiva entwickeln asymptomatische leichte Erhöhungen der Transaminasen, Daten zur Leberschädigung sind rar, erhöhte Hepatotoxizität besteht für Amitriptylin, Duloxetin, Bupropion, Trazodon, Tianeptin und Agomelatin. Die geringste Hepatotoxizität weisen Citalopram, Escitalopram, Paroxetin und Fluvoxamin auf.
Sexuelle Dysfunktion. Diese Compliance-relevante Störung ist zum einen ein häufiges Depressionssymptom, zum anderen eine häufige Antidepressiva-UAW. Je nach Erhebungsmethode werden Inzidenzen von 10 bis 80% angegeben, wobei vor allem serotonerge Antidepressiva (SSRI, Clomipramin und Venlafaxin) ein hohes Potenzial für sexuelle Dysfunktion aufweisen, während Bupropion, Agomelatin, Trazodon, Moclobemid günstig bewertet werden.
Kardiovaskuläre Nebenwirkungen. Blutdruckerhöhung/-senkung, Tachykardie sowie gelegentlich Überleitungsblockierungen treten vor allem unter trizyklischen Antidepressiva und dem MAO-Hemmer Tranylcypromin auf. Signifikante QTc-Verlängerungen wurden für trizyklische Antidepressiva, Maprotilin und Mirtazapin, in den letzten Jahren vor allem für Citalopram und Escitalopram beschrieben. Zu den QT-Risiken zählen weibliches Geschlecht, kardiale Erkrankungen (auch bradykarde Sportler!), Hypokaliämie und Komedikation mit QT-verlängernden Substanzen. Kohorten-Studien der letzten Jahre weisen für SSRIs, auch für trizyklische Antidepressiva auf ein erhöhtes Schlaganfallrisiko (OR 1,45), ein Blutungsrisiko und eine leicht erhöhte Mortalität vor allem bei postmenopausalen Frauen hin. Selten können Blutbildveränderungen (Leukopenien) auftreten.
Neurologische Nebenwirkungen. Tremor kann besonders zu Behandlungsbeginn auftreten. Zerebrale Krampfanfälle sind sehr seltene Ereignisse (ca. 0,1%), gefährdet sind vor allem Patienten mit zerebraler Vorschädigung. Unter den Antidepressiva weisen das höchste epileptogene Risiko Maprotilin, Escitalopram und Bupropion auf. Vor allem Mirtazapin kann zu einer Auslösung oder Zunahme eines Restless-Leg-Syndroms (RLS) oder periodischer Gliedmaßenbewegungen (PLMD), auch im Schlaf (PLMS), führen.
Psychische Nebenwirkungen. Je nach Substanzprofil zählen hierzu Müdigkeit bzw. Unruhe, bei bipolaren Depressionen kann vor allem unter noradrenergen und trizyklischen Antidepressiva ein Switch in die Manie erfolgen. Kognitive Dysfunktionen (Beeinträchtigung von Vigilanz und Exekutivfunktionen) sind für Alltagssicherheit und Fahrtauglichkeit von hoher Relevanz. Manche Patienten beklagen eine emotionale Abstumpfung („blunting“).
Erhöhtes Suizidrisiko. Die Frage ob Antidepressiva Suizidgedanken und suizidales Verhalten induzieren können wird vor allem für SSRIs seit über zehn Jahren diskutiert. In Kasuistiken wurde dies vor allem durch initiale exzitatorische Nebenwirkungen wie Agitiertheit bei prädisponierten Patienten beschrieben. Epidemiologische Studien kamen zu dem Ergebnis, dass Patienten mit Suizidversuchen bzw. vollendeten Suiziden nur zu einem Bruchteil lege artis mit einem Antidepressivum behandelt wurden. In der großen AMSP-Datenbasis kam es bei über 142000 erwachsenen Patienten in 33 Fällen zu Suizidalität (12-mal Suizidgedanken, 18 Suizidversuche, 3 Suizide), sodass Suizidalität als sehr seltenes Ereignis unter Antidepressiva angesehen wird. Reviews sowie die Erfolge von Edukations- und Awareness-Programmen (z.B. Gotland-Studie, Nürnberger Bündnis des Kompetenznetzes Depression – Suizidalität) sprechen für eine positive Wirkung einer Antidepressiva-Therapie auf akut-suizidale Tendenzen. Der großen prospektiven naturalistischen Studie des Kompetenznetzes Depression ist zu entnehmen, dass eine frühe klinische Besserung unter Antidepressiva-Therapie protektiv auf Suizidgedanken wirkt. Die US-amerikanische Food and Drug Administration (FDA) veröffentlichte 2007 eine „Black Box“-Warnung für Kinder, Jugendliche und Erwachsene bis zum 24. Lebensjahr für ein erhöhtes Risiko suizidalen Verhaltens, nachdem entsprechende Daten und Publikationen bei Kindern und Jugendlichen vorgelegt wurden. Diese stark medienwirksamen Warnungen führten zu einem deutlichen Rückgang der Verordnung von Antidepressiva in den USA, was mit einem simultanen Anstieg von Suizidversuchen einherging. Die vermehrte Verschreibung von Antidepressiva war mit einer Abnahme der jeweiligen nationalen Suizidrate einhergegangen.
Zusammenfassend ist von einer deutlichen Altersabhängigkeit des Suizidrisikos unter Antidepressiva-Behandlung auszugehen: bei <25-Jährigen ist von einem erhöhten Suizidrisiko auszugehen, bei über 25-Jährigen ist unmittelbar nach Beginn der Antidepressiva-Einnahme bei beiden Geschlechtern von einer deutlichen und anhaltenden Abnahme der Suizidversuchsrate auszugehen. Ein RCT mit 291 Erwachsenen unter Behandlung mit einem SSRI oder interpersoneller Psychotherapie (IPT) zeigte bei knapp 14% ein Auftreten von Suizidgedanken unter der Behandlung. Hierbei war die Rate unter der SSRI-Therapie geringer als unter IPT. Unter beiden Behandlungen kam es zu keiner Zunahme von vorbestehenden Suizidgedanken, Suizidversuche traten nicht auf.
Sturzrisiko. Bei Älteren wurde für Antidepressiva ein erhöhtes Sturzrisiko beschrieben (OR: 1,6–1,7).
SIADH. Vor allem bei Alterspatienten und unter Komedikation mit Diuretika und ACE-Hemmern kann das Syndrom der inadäquaten ADH-Freisetzung (SIADH) auftreten. Unter SSRIs, SSNRIs, seltener TZAs kommt es zu einer Überwässerung des Körpers mit Absinken der Elektrolyte (vor allem Natrium). Klinisch treten Übelkeit, Erbrechen, Muskelkrämpfe und Verwirrtheit/Delir auf.
Von großer Bedeutung ist die unterschiedliche Toxizität verschiedener Antidepressiva angesichts des hohen Suizidrisikos Depressiver. Anhand des fatalen Toxizitätsindex ergibt sich folgende Rangreihe:
Tranylcypromin, trizyklische Antidepressiva und Venlafaxin weisen ein deutlich größeres Sicherheitsrisiko auf, SSRIs und Agomelatin besitzen geringe Toxizität.
Zu den schweren UAWs zählen Delirien, Harnverhalt und zerebrale Krampfanfälle.
Unterschiedliche Nebenwirkungsprofile lassen sich nach Substanzklassen und für Einzelsubstanzen aufzeigen (siehe Tab. 2-5).
Zusammenstellung der Nebenwirkungen nach Substanzklassen
Die möglichen typischen unerwünschten Arzneimittelwirkungen basierend auf den Fachinformationen und der klinischen Studienlage sind für Trizyklika in Tabelle 2-4, für neuere/nicht-trizyklische Antidepressiva in Tabelle 2-5 und 2-6 zusammengefasst.
Tab. 2-4. Mögliche Nebenwirkungen von trizyklischen Antidepressiva
|
Vegetativ/anticholinerg |
|
|
Neurologisch |
|
|
Psychisch |
|
|
Kardiovaskulär |
|
|
Endokrin |
|
|
Dermatologisch/allergisch |
|
Tab. 2-5. Übersicht unerwünschter Arzneimittelwirkungen von Antidepressiva
|
Anticholinerge NW |
Zentrale |
Kardiovaskuläre NW |
Gastrointestinale NW |
Gewichtszunahme |
Sexuelle Dysfunktion |
|
|
Agomelatin |
0 |
↓↓ |
0 |
++ ↑ Transaminasen |
0 |
0 |
|
Bupropion |
0 |
↑↑ Krampfanfälle |
0 |
++ |
0 |
0 |
|
Citalopram |
0 |
↑ |
(+) |
++ |
0 |
+ |
|
Duloxetin |
+ |
↑↑ |
0 |
++ |
0 |
++ |
|
Escitalopram |
0 |
↑ |
(+) |
++ |
0 |
+ |
|
Fluoxetin |
0 |
↑↑ |
0 |
++ |
0 |
++ |
|
Mirtazapin |
0 |
↓↓ |
0 |
0 |
++ |
0 |
|
Paroxetin |
0 |
↑ |
0 |
++ |
+ |
++ |
|
Reboxetin |
+ |
↑ |
0 |
0 |
0 |
0 |
|
Sertralin |
0 |
↑ |
0 |
++ |
0 |
++ |
|
Venlafaxin |
0 |
0 |
↑ RR |
++ |
0 |
++ |
|
Vortioxetin |
0 |
0 |
0 |
+ |
0 |
0 |
|
NSMRI/Trizyklika |
+++ |
↑↑↑ bis↓↓↓ |
++ |
+ |
+++ |
++ |
NW: Nebenwirkungen; NSMRI: nichtselektive Monoamin-Wiederaufnahmehemmer, 0: fehlend oder sehr gering; +: gering; ++: moderat; +++: stark, ↑: Agitation, Unruhe, Schlafstörungen (gering); ↑↑: moderat; ↑↑↑: stark, ↓: Sedierung (gering); ↓↓: moderat; ↓↓↓: stark
Tab. 2-6. Nebenwirkungen und Risiken neuerer Antidepressiva
|
Agomelatin |
Kopfschmerz, Schwindel, Leberfunktionsstörung |
|
Bupropion |
Übelkeit, Schlaflosigkeit, Blutdrucksteigerung, dosisabhängig zerebrale Krampfanfälle |
|
Duloxetin |
Übelkeit, Mundtrockenheit, Obstipation |
|
Mirtazapin |
Müdigkeit, verstärkter Appetit, Ödeme, Restless-Legs-Syndrom (RLS), Alpträume |
|
Moclobemid |
Schlafstörung, Unruhe |
|
Reboxetin |
Schlafstörung, Agitiertheit, Schwitzen, Schwindel, Hypotonie, Tachykardie, Miktionsstörung, Obstipation, Impotenz |
|
SSRI (Citalopram, Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin, Sertralin) |
Übelkeit, Diarrhö, Erbrechen, Unruhe, Schlafstörungen, Ejakulationsstörung, Kopfschmerzen; selten: Hyponatriämie, Blutungsrisiko, QTc-Verlängerung ([Es-]Citalopram) |
|
Trazodon |
Müdigkeit, Libidosteigerung, Priapismus (sehr selten) |
|
Venlafaxin |
Übelkeit, Schwindel, Nervosität, Anorexie, Blutdruckanstieg, Schwitzen |
Trizyklika. Im Vordergrund stehen zumeist anticholinerge Nebenwirkungen (Peripher: Mundtrockenheit, Obstipation, Akkommodations- und Miktionsstörungen; zentral: kognitive Störungen, Delir) sowie die Blutdrucksenkung (orthostatische Hypotonie). Diese unerwünschten Begleitwirkungen können bei (multimorbiden) Älteren und Risikopatienten unter Umständen schwerwiegende Folgen haben (siehe unten).
Serotonin-selektive Antidepressiva (SSRI). Die SSRI (Citalopram, Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin, Sertralin) weisen ein von den Trizyklika differentes Nebenwirkungprofil auf. Im Vordergrund stehen hier gastrointestinale Nebenwirkungen (Übelkeit, Nausea, Erbrechen, Diarrhö), Agitiertheit sowie im Behandlungsverlauf eine sexuelle Dysfunktion.
SSRI erhöhen das Blutungsrisiko im Gastrointestinum. Der Zusammenhang SSRI und Blutungen wurde in verschiedenen Studiendesigns beschrieben, eine aktuelle Analyse von zwei deutschen Pharmakovigilanz-Datenbasen (AkdÄ, BfArM) fand einen solchen (Serotonin-bedingten) aber nicht. Allerdings ist angesichts des Spontanmeldesystems ein „underreporting“ und keine kausale Zusammenhangsbeurteilung möglich. Bei einer Komedikation mit Antikoagulanzien und nichtsteroidalen Antirheumatika (siehe Interaktionen) besteht aber ebenso wie bei Schlaganfallpatienten und peri-operativ ein erhöhtes Blutungsrisiko.
Zu den selteneren Nebenwirkungen unter SSRI zählen extrapyramidal-motorische Symptome (vgl. Einsatz bei Parkinson-Depression); Risikofaktoren hierfür scheinen höheres Alter und genetische Polymorphismen zu sein. Einige Patienten beklagen unter SSRI-Therapie eine emotionale Abstumpfung („blunting“), die noch näherer Aufklärung bedarf.
Vergleich einzelner SSRI. Unterschiede zwischen einzelnen SSRI beziehen sich hauptsächlich auf pharmakokinetische Parameter: Fluoxetin besitzt einen pharmakologisch aktiven Metaboliten, der für die lange Eliminationshalbwertszeit dieser Substanz mit verantwortlich ist. Fluoxetin, Fluvoxamin und Paroxetin sind Inhibitoren verschiedener Cytochrom-P450-Isoenzymsysteme (v. a. CYP2D6), unter diesen Substanzen ist deshalb mit einem erhöhten Interaktionsrisiko zu rechnen.
Serotonin- und/oder noradrenalin-selektive Antidepressiva (SNRI). Typische Nebenwirkung von Mirtazapin bei insgesamt guter Verträglichkeit ist eine unerwünschte, zum Teil erhebliche Gewichtszunahme und Müdigkeit, auch das Auftreten von RLS und Gelenkschmerzen ist beschrieben. Unter Venlafaxin treten häufiger Nausea und Erbrechen, unter höherer Dosierung Blutdrucksteigerung auf. Bei vorbestehenden Herz-Kreislauf-Erkrankungen sollte es nicht verordnet werden. Das für Venlafaxin beschriebene erhöhte kardiovaskuläre Risiko wurde allerdings jüngst in einer kanadischen retrospektiven Kohorten-Studie bei älteren Patienten im Vergleich zu Sertralin nicht bestätigt. Unter Duloxetin werden Übelkeit, Mundtrockenheit, Obstipation und Schlafstörungen registriert.
Das noradrenalin-selektive Reboxetin wirkt deutlich aktivierend, typische Nebenwirkungen sind Schlaflosigkeit, Schwitzen und (seltener) Miktionsstörungen.
Noradrenalin-Dopamin-selektive Antidepressiva. Das Noradrenalin-/Dopamin-selektive Bupropion führt relativ häufig zu (unerwünschter) Stimulierung mit Schlafstörung, kann Blutdruckerhöhung verursachen und besitzt ein erhöhtes zerebrales Anfallpotenzial.
Melatonin-Serotonin-selektive Antidepressiva. Der Melatonin-Rezeptoragonist und selektive 5-HT2C-Rezeptorantagonist Agomelatin kann neben Schwindel zu Serumtransaminasenerhöhungen (<1%) führen, weshalb Leberfunktionstests erforderlich sind.
Multimodale Antidepressiva. Typische Nebenwirkung des jüngst verfügbaren Vortioxetin ist Übelkeit/Nausea vor allem innerhalb der ersten zwei Behandlungswochen.
MAO-Hemmer. Der irreversible MAO-Hemmer Tranylcypromin erfordert eine konsequente Tyramin-arme Diät; seltene, aber gefürchtete Nebenwirkung ist hier die Auslösung hypertensiver Krisen durch Tyramin-haltige Nahrungsmittel. Zu diesen zählen vor allem gereifter Käse, Rotwein, Hering, Leber, Avocados, Sojasoßen und dicke Bohnen. Typische Nebenwirkungen sind Unruhe, Schlafstörungen und Hypotonie. Unter dem reversiblen MAO-A-Hemmer Moclobemid sind keine Diätrestriktionen (abgesehen von großen Mengen Tyramin-reichem Käse) erforderlich; das Medikament sollte allerdings erst nach den Mahlzeiten eingenommen werden. Typische Nebenwirkungen sind hier innere Unruhe, Schlafstörungen und Übelkeit.
Bei der Verordnung von Tranylcypromin müssen Diätvorschriften (Tyramin-arme Kost) sowie kontraindizierte Arzneimittelkombinationen strikt beachtet werden (s. Übersicht). Bei der Umstellung auf andere Antidepressiva (Wiederaufnahmehemmer) muss ein Intervall von 14 Tagen eingehalten werden.
Entzugs-/Absetzsyndrome
Bei (fast) allen Antidepressiva kann es vor allem nach längerfristiger Einnahme bei abruptem Absetzen zu Absetzsymptomen kommen. Diese treten typischerweise innerhalb einer Woche nach dem Absetzen auf, sind dosisabhängig, von kurzer Dauer (maximal 2 Wochen) und üblicherweise mild. Sie äußern sich in grippeähnlichen Symptomen, Übelkeit/Erbrechen, Parästhesien, Angst, Schlafstörungen und Stimmungsschwankungen und sind bei SSRI und SNRI – insbesondere Paroxetin und Venlafaxin – besonders ausgeprägt. Sie können durch ein langsames Absetzen der Medikation (ca. ein Viertel der Dosis pro Monat) vermieden werden.
Umstellung
Bei der Umstellung von Antidepressiva (wegen Non-Response oder Unverträglichkeit) sind zum Teil Intervalle zu beachten, die in Tabelle 2-7 zusammengefasst sind.
Tab. 2-7. Umstellungsintervalle für Antidepressiva (AD)
|
Umstellung von |
Umstellung auf |
Therapiefreies Intervall |
Bemerkungen |
|
TZA (bis 75 mg/Tag) |
Andere AD |
Keines |
Gilt nicht für MAO-Hemmer |
|
TZA (>75 mg/Tag) |
Andere AD |
Ausschleichen des TZA über 3–7 Tage |
Ausschleichzeit abhängig von Dosis; gilt nicht für MAO-Hemmer |
|
Alle AD |
TZA |
Keines |
Gilt nicht für MAO-Hemmer |
|
Clomipramin |
SSRI/Duale Substanzen |
5 Tage |
Keinesfalls kombinieren |
|
SSRI/Duale Substanzen (außer Fluoxetin) |
Clomipramin |
5 Tage |
Keinesfalls kombinieren |
|
SSRI/Duale Substanzen (außer Fluoxetin) |
Andere SSRI/ |
1 Tag |
|
|
Fluoxetin |
Andere SSRI/ |
3 Wochen |
Keinesfalls kombinieren |
|
MAO-Hemmer a |
Alle AD |
2 Wochen |
Keinesfalls kombinieren |
|
TZA |
MAO-Hemmer* |
1 Woche |
Keinesfalls kombinieren |
|
SSRI/Duale Substanzen (außer Fluoxetin) |
MAO-Hemmer* |
2 Wochen |
Keinesfalls kombinieren |
|
Fluoxetin |
MAO-Hemmer* |
5 Wochen |
Keinesfalls kombinieren |
TZA: Tri- und tetrazyklische Antidepressiva (außer Clomipramin); SSRI: selektive Serotonin-Wiederaufnahmehemmer
aMAO-Hemmer (Monoaminoxidasehemmer) =Tranylcypromin; für den reversiblen MAO-Hemmer Moclobemid gibt es Befunde, dass eine Umstellung ohne therapiefreies Intervall möglich ist
Interaktionen, Kontraindikationen
Interaktionen
Multimorbidität und die häufige Polypharmazie machen heute – vor allem auch im Konsiliardienst – Kenntnisse zu Interaktionen unverzichtbar. Computergestützte Datenbanken (z.B. www.psiac.de, mediq.ch) bieten einen stets aktuellen und leichten Zugang. Tabelle 2-8 fasst die klinisch wichtigsten bei der Verordnung von Antidepressiva zu beachtenden Arzneimittelwechselwirkungen/-interaktionen zusammen.
Tab. 2-8. Auswahl wichtiger Interaktionen von neueren (selektiven) Antidepressiva (AD) mit Vorschlägen zum Prozedere (SSRI, Duloxetin, Venlafaxin, Mirtazapin, Bupropion, Agomelatin)
|
Wechselwirkung mit |
Klinische Effekte |
Empfehlungen |
|
Analgetika, zentrale Opioide (Morphinanaloga) |
Verstärkte serotonerge Effekte bei Tramadol, Tilidin, Dextromethorphan und Pethidin; Wirkverlust Tramadol |
|
|
Antidepressiva, trizyklische (TZA) |
Erhöhte Plasmaspiegel der TZA, dadurch vermehrt Nebenwirkungen möglich |
|
|
Antikoagulanzien |
Verstärkung der gerinnungshemmenden Wirkung Blutungsgefahr |
|
|
ASS/NSAR z.B. Diclofenac, Ibuprofen |
Verminderte Thrombozytenaggregation, verstärkte Blutungsneigung |
|
|
Betablocker (Metoprolol) |
Verstärkte Betablocker-Wirkung durch Enzyminhibition; Hypotonie, Bradykardie |
|
|
Carbamazepin |
Erhöhtes Risiko eines SIADH-Syndroms, dadurch Elektrolytverschiebungen (Delirgefahr) |
|
|
Ciprofloxazin |
Stark erhöhte Plasmaspiegel bei Agomelatin und Duloxetin möglich |
|
|
Clomipramin |
Potenzierung serotonerger Effekte |
|
|
Clozapin (mit Fluvoxamin) |
Erhöhte Clozapin-Spiegel infolge Enzyminhibition durch Fluvoxamin |
|
|
Diuretika vom Thiazid-Typ |
Erhöhtes Risiko eines SIADH-Syndroms, dadurch Elektrolytverschiebungen (Delirgefahr) |
|
|
L-Tryptophan |
Potenzierung serotonerger Effekte |
|
|
MAO-Hemmer (Moclobemid und Tranylcypromin) |
Potenzierung serotonerger Effekte Cave zentrales Serotonin-Syndrom! |
|
|
Migränemittel vom Triptan-Typ |
Potenzierung serotonerger Effekte |
|
|
Neuroleptika, klassische; |
Erhöhte Plasmaspiegel, dadurch vermehrt Nebenwirkungen, insbesondere EPMS möglich |
|
|
Tamoxifen |
Inhibition des Abbaus zum aktiven Metaboliten Erhöhte Tumor-Rezidivgefahr |
|
Für pharmakokinetische Interaktionen ist das für die Metabolisierung entscheidende Cytochrom-P450-Isoenzymsystem von entscheidender Bedeutung. Besonders potente Inhibitoren des CYP2D6-Isoenzyms sind Fluoxetin und Paroxetin. Von den SSRI bieten Citalopram, Escitalopram und Sertralin, von den NRI und SNRI Reboxetin und Venlafaxin den Vorteil, dass sie die Cytochrom-P450-Isoenzyme nicht oder nur minimal hemmen und entsprechende Arzneimittelinteraktionen nicht zu erwarten sind. Agomelatin und Duloxetin sind Substrate des CYP1A2 – gemeinsame Gabe mit Ciprofloxazin führt zu teilweise massiven Erhöhungen der Plasmaspiegel. Bei Rauchern können die Spiegel deutlich erniedrigt sein.
Johanniskraut-/Hypericum-Extrakte sind sehr gut verträglich, als starker Induktor des CYP3A4 besitzt Johanniskraut aber ein hohes Interaktionspotenzial mit Immunsuppressiva (z.B. Ciclosporin) und Protease-Inhibitoren (z.B. Indinavir). Zu den klinisch relevanten und potenziell gefährlichen Auswirkungen zählen daher Abschwächung der antiviralen bzw. immunsuppressiven Wirkung. Über eine mögliche Interaktion mit oralen Kontrazeptiva kann es zu Zwischenblutungen kommen. Die Möglichkeit ungewollter Schwangerschaften ist in Kasuistiken beschrieben, allerding in klinisch-pharmakologischen Untersuchungen nicht bestätigt worden. Trotzdem sollten Patienten auf dieses nicht auszuschließende Problem hingewiesen werden.
Aus klinisch-praktischer Sicht lässt sich folgende Interaktionshierarchie aufstellen: Tranylcypromin>Fluoxetin>TZA >Paroxetin>Mirtazapin>(Es-)Citalopram, Sertralin>Agomelatin.
Zusätzlich zu beachten sind pharmakokinetische Interaktionen mit Nahrungsmitteln (z.B. Grapefruitsaft).
Zu den wichtigsten bei Antidepressiva zu beachtenden pharmakodynamischen Wechselwirkungen zählen:
- Verstärkte anticholinerge Effekte vor allem bei der Kombination von Trizyklika (Amitriptylin, Doxepin, Trimipramin) mit gleichfalls anticholinerg wirkenden Substanzen (z.B. Antiallergika, Parkinson-Mittel, Urologika, Clozapin). Hieraus resultiert vor allem bei geriatrischen Patienten ein erhöhtes Delir-Risiko.
- Ein erhöhtes Risiko für kardiale Effekte (QT-Zeitverlängerung) besteht für die Kombination von TZA, Citalopram und Escitalopram mit QT-Zeit-verlängernden Antipsychotika wie Ziprasidon oder Sertindol sowie Antiarrhythmika, Azol-Antimykotika, Antihistaminika und Makrolid-Antibiotika.
- Die Gefahr eines zentralen Serotonin-Syndroms besteht bei Kombination von Antidepressiva mit serotonergem Wirkschwerpunkt (SSRI, Clomipramin, SNRI) mit anderen serotonergen Arzneimitteln (Opioidanalgetika, Triptane). Leitsymptome sind Agitiertheit, Tremor, Myoklonien, Fieber, Diarrhö und Bewusstseinstrübung.
- Die potenziell verstärkte Blutungsneigung unter SSRI/SNRI-Medikation kann durch die Kombination mit anderen Thrombozytenaggregations-hemmenden Substanzen wie ASS oder NSAR (nichtsteroidale Antirheumatika) deutlich steigen. Mit ASS verdoppelt sich das Blutungsrisiko annähernd, unter der Kombination eines SSRI mit einem NSAR ergab sich in einer Metaanalyse ein relatives Risiko von 6,3 im Vergleich zu Patienten, die keines der beiden Medikamente genommen hatten. Bei einer Vormedikation mit Cumarinen (Marcumar®) besteht kein erhöhtes Risiko bei der Kombination mit SSRI bzw. SNRI (Ausnahme Fluoxetin, Fluvoxamin).
Kontraindikationen
Antidepressiva dürfen nicht angewandt werden bei bekannter Überempfindlichkeit gegen die betreffende Substanz, bei akuter Intoxikation mit zentral dämpfenden Pharmaka (z.B. Hypnotika, Analgetika) sowie Alkohol, bei akutem Harnverhalt, Delirien und Manien.
- Trizyklische Antidepressiva sind außerdem kontraindiziert bei unbehandeltem Engwinkelglaukom, Pylorusstenose, Prostatahypertrophie mit Restharnbildung, paralytischem Ileus, höhergradigen AV-Blockierungen oder diffusen Erregungsleitungsstörungen und Zustand nach frischem Herzinfarkt.
- Selektive Serotonin-Wiederaufnahmehemmer (SSRI) dürfen aufgrund möglicher pharmakodynamischer Interaktionen nicht kombiniert werden mit MAO-Hemmern, L-Tryptophan und Opioiden (Tramadol, Pethidin). Dies kann zu einem potenziell letalen Serotoninsyndrom führen.
- Bupropion und Maprotilin sind bei Epilepsie-Anamnese kontraindiziert, Agomelatin bei Lebererkrankungen
- Irreversible MAO-Hemmer sind kontraindiziert bei Zustand nach Hirninfarkt oder intrakranieller Blutung, Porphyrie, Phäochromozytom, Karzinoid, arterieller Hypertonie, bevorstehender Operation mit notwendiger Narkose und gleichzeitiger Behandlung mit Clomipramin, SSRI, Venlafaxin, Serotoninagonisten, stark wirksame Analgetika sowie Sympathomimetika.
Schwangerschaft und Stillzeit
Grundsätzlich ist das Risiko embryo- und fetotoxischer sowie postnataler Effekte einer Medikation gegenüber den Risiken einer Exazerbation oder eines Rezidivs der psychischen Erkrankung sorgfältig und individuell abzuwägen (Prinzip der Nutzen-Risiko-Abwägung). Bei psychisch kranken Schwangeren muss unabhängig von einer Psychopharmaka-Medikation von einem erhöhten (Wieder-)Erkrankungsrisiko (insbesondere postpartal) ausgegangen werden.
Mögliche Auswirkungen einer pränatalen Psychopharmaka-Exposition auf das Kind sind Fehlbildung (Teratogenität), perinatale (peripartale) Toxizität und postnatale Entwicklungs- und Verhaltensstörungen (Verhaltensteratogenität).
Optimal ist eine geplante Schwangerschaft, da dann die Frage der Medikation nach differenzierter Beratung mit Berücksichtigung der individuellen Krankheitsgeschichte abgewogen und gegebenenfalls so angepasst werden kann, dass die Wahrscheinlichkeit einer möglichen psychischen Dekompensation gering ist und gleichzeitig das Risiko für das ungeborene Kind möglichst klein gehalten werden kann.
Die Entscheidung pro oder kontra Psychopharmaka in der Schwangerschaft kann nur auf Basis einer relativ schwachen Datenlage getroffen werden. Wichtig zu wissen ist, dass das Basisrisiko für Fehlbildungen (ohne Arzneitherapie), die sogenannte spontane Fehlbildungsrate etwa 3% beträgt. Insgesamt ist von keinem eindeutigen Risiko durch Antidepressiva auszugehen, als Mittel der 1. Wahl gelten Sertralin, Citalopram und Amitriptylin, für eine stabil auf Mirtazapin oder Venlafaxin eingestellte Schwangere gibt es keinen Grund zur Umstellung, nicht empfohlen werden Clomipramin und Paroxetin.
Die Datenlage bezüglich Stillen ist bislang unbefriedigend, für Amitriptylin, Nortriptylin, Clomipramin, Paroxetin und Sertralin dürfte infolge minimaler Brustmilchkonzentrationen für Säuglinge kein Stillrisiko bestehen.
Kontrolluntersuchungen
Die empfohlenen Kontrolluntersuchungen bei einer Antidepressiva-Therapie sind in Tabelle 2-9 wiedergegeben.
Tab. 2-9. Empfohlene Kontrolluntersuchungen bei der Therapie mit neueren, nicht-trizyklischen Antidepressiva
|
Vor Therapiebeginn |
Monate |
Halbjährlich |
||||||
|
Blutbild1 |
X |
X |
X |
X |
||||
|
Leberwerte14 |
X |
X |
X |
X |
||||
|
Nierenwerte |
X |
X |
X |
X |
||||
|
EKG |
X |
X |
||||||
|
EEG2 |
X |
X |
||||||
|
RR3, Puls3 |
X |
X |
X |
X |
X |
|||
|
Blutzucker bzw. HbA1c5 |
X |
X |
X |
X |
X |
|||
1 Bei Mianserin in den ersten 3 Monaten wöchentlich, später dann wie bei TZA
2 Bei Risikopatienten (z.B. Anfallsleiden, hirnorganische Störungen), bzw. bei Bupropion
3 Bei Venlafaxin, MAO-Hemmern und Bupropion kürzere Untersuchungsintervalle
4 Bei Agomelatin zu Beginn und nach 6, 12 und 24 Wochen sowie danach, wenn klinisch indiziert
5Bei Diabetikern (inbes. unter Mirtazapin)
Lithiumprophylaxe
EbM-Info. Zusammenfassend belegen die vorliegenden Studiendaten die Rezidiv-prophylaktische Wirksamkeit der Pharmakotherapie.Die Befunde zur Rezidiv-prophylaktischen Wirksamkeit von Lithium bei unipolaren Depressionen sind weniger klar als die für bipolare Erkrankungen. Die Guidelines der American Psychiatric Association (APA) empfehlen Lithium nicht, für die S3-Leitlinie Unipolare Depression ist Lithium 2. Wahl.
Gut belegt ist, dass Lithium langfristig das Suizidrisiko senken kann.
Sogenannte therapieresistente, chronische Depression (TRD)
Bis zu 30% der depressiven Patienten sprechen nicht auf die Behandlung mit einem Antidepressivum an, „chronische Depressionen“, d.h. eine trotz verschiedener Behandlungsversuche persistierende Symptomatik über zwei Jahre, finden sich bei etwa 15% der Depressiven. Bislang ungelöst sind die definitorischen Probleme: Es gibt keine allgemein akzeptierte Definition der Therapieresistenz. Eine tautologische Charakterisierung ist das „Ausbleiben einer Remission“, „Non-Response“ wird üblicherweise definiert als <25%ige Besserung in Depressionsskalen, als klinisch-pragmatische Definition gilt die folgende: keine ausreichende Besserung auf wenigstens zwei Antidepressiva mit unterschiedlichen Wirkungsschwerpunkten und in ausreichender Dosierung und Therapiedauer.
Da keine empirischen Definitionen für Therapieresistenz im Rahmen psychotherapeutischer Behandlungen vorliegen, beziehen sich Einteilungen hauptsächlich auf die Pharmakotherapie.
In Anlehnung an die Stadieneinteilung in der Onkologie wurde ein Staging-System vorgeschlagen:
- Stadium I: Non-Response auf ein adäquat eingesetztes Antidepressivum
- Stadium II: Non-Response auf 2. Antidepressivum aus anderer Substanzklasse
- Stadium III: Non-Response auf Trizyklikum
- Stadium IV: Non-Response auf MAOH
- Stadium V: Non-Response auf bilaterale EKT
Die Residualsymptome bei ambulanten Nonrespondern umfassen ein breites Spektrum, an der Spitze stehen Insomnie, Interessenverlust und kognitive Störungen.
Als mögliche Ursachen für Therapieresistenz können gelten:
- Diagnostische Faktoren
- Fehlende Compliance
- Inadäquate Behandlung
- Pharmakokinetische Faktoren
- Psychologische und Persönlichkeitsfaktoren
Pragmatisches Vorgehen bei TRD
Ausschluss einer Pseudotherapieresistenz. Initial sollte eine sogenannte Pseudotherapieresistenz ausgeschlossen werden: Durch Plasmaspiegelbestimmungen wird überprüft, ob der Patient compliant ist und die Dosierung ausreicht, um einen therapeutisch wirksamen Serumspiegel zu erreichen bzw. eine Metabolisierungsstörung („fast metabolizer“) vorliegt. Untersuchungen ergaben, dass bei Antidepressiva-Verordnungen von einer Non-Compliance-Rate von 30 bis 50% ausgegangen werden muss (s. oben). Erhebungen zeigten, dass etwa die Hälfte der Patienten die Medikation innerhalb von vier Wochen beendet.
Eine weitere Ursache für eine scheinbare Therapieresistenz können Arzneimittel mit einer depressiogenen oder depressionsverstärkenden Wirkung sein (pharmakogene Depression). Auch Wirkverlust von Antidepressiva infolge Arzneimittel-Interaktionen ist zu beachten (s.o.).
Ausschluss organischer Ursachen, Komorbidität. Zur Erkennung einer möglichen organischen Ursache sind verschiedene diagnostische Schritte notwendig, um hirnorganische und systemische organische Erkrankungen, die mit einem depressiven Syndrom einhergehen können, auszuschließen. Auch eine Komorbidität beispielsweise mit Alkoholabhängigkeit oder Persönlichkeitsstörungen kann für das Nichtansprechen auf die (Pharmako-)Therapie relevant sein.
Therapeutisches Vorgehen. Die prinzipiellen Möglichkeiten bei sogenannter Therapieresistenz (Non-Response) umfassen:
- Die Optimierung
- Die sequenzielle Behandlung (Wechsel der Medikation, Umstellung, „Switch“)
- Die Kombinationsbehandlung von Antidepressiva
- Die Augmentationstherapie
- Die Elektrokonvulsionstherapie
- Die Kombinationsbehandlung mit Psychotherapie
1. Optimierung
Zur „Optimierung“ der Behandlung gehört zum einen die Überprüfung der Vorgeschichte und der Diagnose, die Subtypisierung der Depression (z.B. Vorliegen einer psychotischen, einer sogenannten atypischen oder einer bipolaren Depression, oder aber einer Dysthymie – dies impliziert unter Umständen unterschiedliche therapeutische Ansätze wie beispielsweise den Einsatz von atypischen Neuroleptika oder Monoaminoxidasehemmern) sowie die Hochdosierung. Letztere wird für Trizyklika und irreversible MAOH (Tranylcypromin), nicht aber für SSRI empfohlen.
2. Sequenzielle Behandlung mit verschiedenen Antidepressiva
Eine sequenzielle Behandlung beinhaltet das Absetzen des bisherigen Medikaments und den Wechsel („Switch“) zu einem Antidepressivum bevorzugt einer anderen Medikamentenklasse. Dies ist in der klinischen Routine ein häufig praktiziertes Vorgehen. So kann nach einem Serotonin-selektiven Antidepressivum (SSRI) ein selektiver Noradrenalin- oder Noradrenalin-/Dopamin-Wiederaufnahmehemmer (z.B. Reboxetin, Bupropion) eingesetzt werden. Die Datenlage hierzu ist spärlich, es liegen nur wenige kontrollierte Studien vor. Neue systematische Reviews und Metaanalysen von RCTs kommen zu dem Ergebnis, dass die Switch-Strategie der Augmentation oder Kombination unterlegen ist.
Bei Patienten, die auf trizyklische Antidepressiva, SSRI oder andere Monoamin-Wiederaufnahmehemmer nicht ansprechen, sollte ein Therapieversuch mit einem Monoaminoxidasehemmer angeschlossen werden.
3. Antidepressiva Kombinationstherapien
Die Kombination verschiedener Antidepressiva bei Therapieresistenz erscheint unter theoretischen Gesichtspunkten im Sinne eines additiven Effektes plausibel, die Kombination von vorwiegend noradrenergen Substanzen mit SSRI kann als sinnvoll angesehen werden, die neuen dualen Antidepressiva stellen eine derartige „fixe“ Kombination dar. Ergebnisse aus kontrollierten Studien zeigen vor allem, dass die Kombination eines Wiederaufnahmehemmers (TZA oder SSRI) mit einem Rezeptorantagonisten (Mianserin, Mirtazapin) effektiv ist. Die Kombination von trizyklischen Antidepressiva mit MAO-Hemmern wurde kontrovers diskutiert, inzwischen liegen einige kontrollierte Studien vor, die zeigen, dass diese Kombination effektiv und bei ausreichender Vorsicht unter Verträglichkeitsaspekten vertretbar ist. Hierzu gehört die sorgfältige Einhaltung einer Tyramin-armen Diät, die Beachtung von Interaktionen mit anderen Medikamenten und Blutdruckkontrollen.
Zumindest klinisch etabliert ist die Kombination von Antidepressiva mit (atypischen) Neuroleptika bei psychotischen Depressionen.
4. Augmentationsstrategien
EbM-Info. Die Augmentationstherapie beinhaltet die Zugabe eines zweiten Medikaments, das nicht zur Gruppe der Antidepressiva gehört. Unter den Strategien ist die Lithiumaugmentation für TRD die mit Abstand am besten belegte (Evidenzgrad 1a).
Eine Metaanalyse über neun Placebo-kontrollierte Studien bestätigte, dass Lithiumaugmentation mit einer durchschnittlichen Responserate von etwa 40 bis 50% dem Placebo in allen Studien überlegen war. Die Lithiumaugmentation sollte für zwei bis vier Wochen durchgeführt werden, die empfohlene Dosis erreicht Spiegel von wie üblich 0,6 bis 0,8 mmol/l. Auch eine Erhaltungstherapie über mindestens ein Jahr wurde empfohlen.
Zur Augmentation wurden außerdem Psychostimulanzien (z.B. Modafinil), Pindolol, Buspiron und Lamotrigin eingesetzt. Die evidenzbasierte Datenlage ist hier nicht ausreichend, um den Einsatz zu empfehlen.
In letzter Zeit wurde über positive Resultate einer Augmentation mit atypischen Antipsychotika (Olanzapin, Risperidon, Quetiapin) bei TRD berichtet. Eine Metaanalyse von 16 randomisierten Studien ergab eine signifikante Überlegenheit der atypischen Antipsychotika gegenüber Placebo-Augmentation, was aber mit einer erhöhten Absetzrate infolge unerwünschter Arzneimittelwirkungen einherging.
Placebo-kontrollierte RCTs liegen inzwischen für Aripiprazol, Ziprasidon und Quetiapin vor. Quetiapin ist inzwischen zur Add-on-Therapie in Deutschland zugelassen. Im Vergleich zu Placebo waren höhere Abbruchraten sowie die UAWs Akathisie und Parkinsonismus zu verzeichnen.
Verordnungspraxis, Pharmakoökonomie, Sozialpharmakologie
Die Verordnungszahlen der Antidepressiva insgesamt und einzelner Substanzen kann für den ambulanten Sektor (GKV) jährlich dem Arzneiverordnungsreport entnommen werden. Etwa 10% der Europäer im mittleren Alter nehmen jährlich Antidepressiva ein, Frauen nahezu doppelt so häufig wie Männer. Depressionen waren für 7% der erfassten Fehltage verantwortlich, im Mittel war jede Erwerbsperson gut einen Tag aufgrund von Depressionen arbeitsunfähig gemeldet, die Arbeitsunfähigkeit dauerte durchschnittlich 64 Tage. 49% der Antidepressiva-Verordnungen erfolgten durch Psychiater und Neurologen, 33% von Allgemeinmedizinern, 10% durch Internisten. Das höchste Verordnungsvolumen wird in der Altersgruppe der 55- bis 59-Jährigen erreicht. Am meisten Antidepressiva-Verordnungen erhielten Versicherte mit den Tätigkeitsgruppen „Erziehung, soziale und hauswirtschaftliche Berufe, Reinigungsberufe und nicht-medizinische Gesundheits-, Körperpflege- und Wellnessberufe, Medizintechnik“. Die Verordnungsraten sinken mit steigender Schulbildung (Techniker Krankenkasse 2015). Etwa 50 bis 60% der wegen Depressionsdiagnose Arbeitsunfähigen werden mit Antidepressiva behandelt. Die GKV-Depressions-Diagnosen müssen allerdings aus diagnostischer Sicht hinterfragt werden, Antidepressiva werden sicherlich zu einem erheblichen Prozentsatz bei „Befindlichkeitsstörungen, psychosomatischen Bildern, Verstimmungszuständen“ und Schlafstörungen verordnet.
Etwa 90% der verordneten Antidepressiva in Deutschland sind Generika, die durchschnittlichen Tagestherapiekosten liegen bei etwa 0,25 Euro. Die derzeit meistverordneten Antidepressiva in Deutschland sind Citalopram, Mirtazapin, Venlafaxin und Sertralin.
Interessenkonflikterklärung
WEM: Vortrags- und Beraterhonorare von Neuraxpharm und Schwabe
GL: Kongressreisekosten, Honorare für Vorträge und wissenschaftliche Tätigkeit in Advisory/Expert Boards von den Firmen Bayer, Janssen-Cilag, Lundbeck, Otsuka und Servier
Weiterführende Literatur
1. Bauer M. Neurobiologie und Therapie depressiver Erkrankungen. 5. Auflage. Bremen: Uni-Med, 2016.
2. Benkert O, Hippius H, et al. Psychiatrische Pharmakotherapie. 11. Auflage. Heidelberg: Springer, 2017.
3. Laux G. Aktuelle Pharmakotherapie der Depression. Nervenheilkunde 2015;34:888–99.
4. Laux G. Depressionen. In: Möller HJ, Laux G, Kapfhammer HP (Hrsg.). Psychiatrie, Psychosomatik, Psychotherapie. 5. Auflage, Band 3, Kapitel 68. Berlin: Springer, 2017.
5. Müller WE, Eckert A. Psychopharmakotherapie – pharmakologische Grundlagen. In: Möller HJ, Laux G, Kapfhammer HP (Hrsg.). Psychiatrie, Psychosomatik, Psychotherapie. 5. Auflage, Band 2, Kapitel 31. Berlin: Springer, 2017.
Prof. Dr. med. Dipl.-Psych. Gerd Laux, Institut für Psychologische Medizin (IPM), Nussbaumstraße 9, 83564 Soyen, E-Mail: ipm@ipm-laux.de
Prof. Dr. Walter E. Müller, Höhenstraße 49A, 67550 Worms
Psychopharmakotherapie 2018; 25(01):21-35
