Walter E. Müller, Frankfurt a. M.
1. Unsere heutigen Antidepressiva: viele unterschiedliche akute Angriffspunkte, aber eher eine gemeinsame Endstrecke
In Deutschland sind zurzeit über 20 verschiedene Antidepressiva (AD) im Handel, die sich zum Teil erheblich im Hinblick auf ihre akuten Angriffspunkte unterscheiden (Tab. 1 und Abb. 1). Im Vordergrund stehen hier Effekte in der noradrenergen (NA), besonders aber der serotonergen (5-HT) Neurotransmission. Dazu zählen die Hemmung der neuronalen Wiederaufnahme, aber auch die MAO-Hemmung und verschiedene Rezeptoraktivierungen, sodass es entweder über eine erhöhte Transmitterverfügbarkeit oder durch direkte Rezeptoreffekte zu einer verstärkten Aktivierung von 5-HT- bzw. NA-Rezeptoren kommt. Alle diese akuten Effekte sind aber nicht direkt mit der antidepressiven Wirksamkeit korreliert, da sie sehr schnell auftreten, die antidepressive Wirksamkeit sich aber langsam über ein bis drei Wochen entwickelt, was sich auch in den meisten Tiermodellen abbilden lässt. Man hat daher angenommen, dass adaptive Veränderungen in weiten Bereichen der Neurotransmission, die im ähnlichen Zeitfenster ablaufen, sehr viel näher mit der eigentlichen Wirksamkeit der Antidepressiva in Verbindung stehen (Abb. 1). Hier hat man früher primär Veränderungen der direkten neurochemischen Ebene als relevant erachtet, beispielsweise die Down-Regulation von Beta-Rezeptoren oder Serotonin-2-Rezeptoren bzw. die Zunahme der Dichte von Serotonin-1a-Rezeptoren. Die Hoffnung, besonders in der Beta-Down-Regulation eine gemeinsame Endstrecke im Wirkungsmechanismus aller Antidepressiva gefunden zu haben, hat sich dann nicht bestätigen können, obwohl Beta-Down-Regulation auch bei nicht noradrenergen Antidepressiva gesehen wurde [27]. In den heutigen Vorstellungen sind diese Veränderungen direkter Mechanismen der Neurotransmission zwar Ausdruck solcher adaptiver Prozesse, scheinen aber nicht primär für die antidepressive Wirksamkeit verantwortlich zu sein. Man geht heute vielmehr davon aus, dass adaptive Veränderungen auch an den Strukturen der Nervenzelle (Abb. 2) auftreten und einen wichtigen Aspekt des Phänomens Neuroplastizität darstellen, der Eigenschaft unseres Nervensystems, sich Phasen veränderter Aktivität anpassen zu können. Dies betrifft funktionelle Einschränkungen, besonders aber Phasen erhöhter Aktivität, wie sie besonders auch nach chronischem Stress auftreten, der als Risikofaktor für depressive Störungen gilt [5, 48, 54, 66]. Die individuelle Ausprägung der Neuroplastizität wird heute als ein Aspekt des zurzeit stark diskutierten Phänomens „Resilience“ [36] gesehen oder ganz einfach als Erklärung, warum nicht jeder nach chronischem Stress, trotz auftretender biochemischer Veränderungen, auch depressiv krank wird. Neuroplastizität umfasst praktisch alle Bereiche der Informationsübertragung im Gehirn. Diese betreffen neben Veränderungen der Signaltransduktion (Rezeptor- bzw. Transporter-Dichte bzw. -Funktion) (Abb. 1), die postsynaptischen Feinstrukturen (Spine-Struktur und Spine-Dichte), aber auch Veränderungen von Neuritenlänge und Neuritenverzweigung und die in wenigen hippocampalen Strukturen mögliche Neusynthese von Nervenzellen (Neurogenese) (Abb. 2). Man geht heute daher davon aus, dass Veränderungen auf der Ebene der Neuroplastizität die eigentliche Ursache der sich langsam ausbildenden antidepressiven Wirkung praktisch aller Antidepressiva sind, wobei die initialen Angriffspunkte sehr unterschiedlich sein können (Abb. 3). Ebenfalls unterschiedlich können die intrazellulären Signalwege sein, die dann letztlich, bevor es zu den eigentlichen histologisch fassbaren Veränderungen kommt, den Transkriptionsfaktor pCREP als gemeinsame Endstrecke aktivieren. Dieser führt dann seinerseits zur Synthese neurotropher Faktoren (besonders BDNT, [47]) und damit zum Anstoßen von Neuroplastizitätsphänomenen. Die gemeinsame Endstrecke erklärt, dass sich die Substanzen in der finalen antidepressiven Wirksamkeit wahrscheinlich nicht wesentlich unterscheiden (Tab. 1).
Tab. 1. Wichtige Kernaussagen über Gemeinsamkeiten und Unterschiede der heute genutzten Antidepressiva
|
Allgemeines zu Antidepressiva |
|
Eher keine Unterschiede in der globalen antidepressiven Wirkung in kontrollierten Studien und im Zeitverlauf (gleiche Wirklatenz), ungeachtet des primären pharmakologischen Angriffspunkts → Ähnlicher finaler Wirkungsmechanismus |
|
Individuelles Ansprechen auf einzelne primäre Wirkprinzipien kann unterschiedlich sein → Unzureichende Verbesserung auf ein erstes Antidepressivum schließt eine gute Verbesserung auf ein zweites Antidepressivum nicht aus |
|
Primäre Wirkungsmechanismen (meist direkter Eingriff in die Neurotransmission von Serotonin, Noradrenalin, Dopamin) führen zum Teil zu erheblichen UAW → Wichtiger Aspekt der differenzialtherapeutischen Entscheidungen |
|
Die antidepressive subchronische Wirkung ist mit adaptiven subchronischen Veränderungen der Neurotransmission und besonders der Neuroplastizität assoziiert → Diese Ebene scheint eher weniger UAW-relevant zu sein |
UAW: Unerwünschte Arzneimittelwirkung
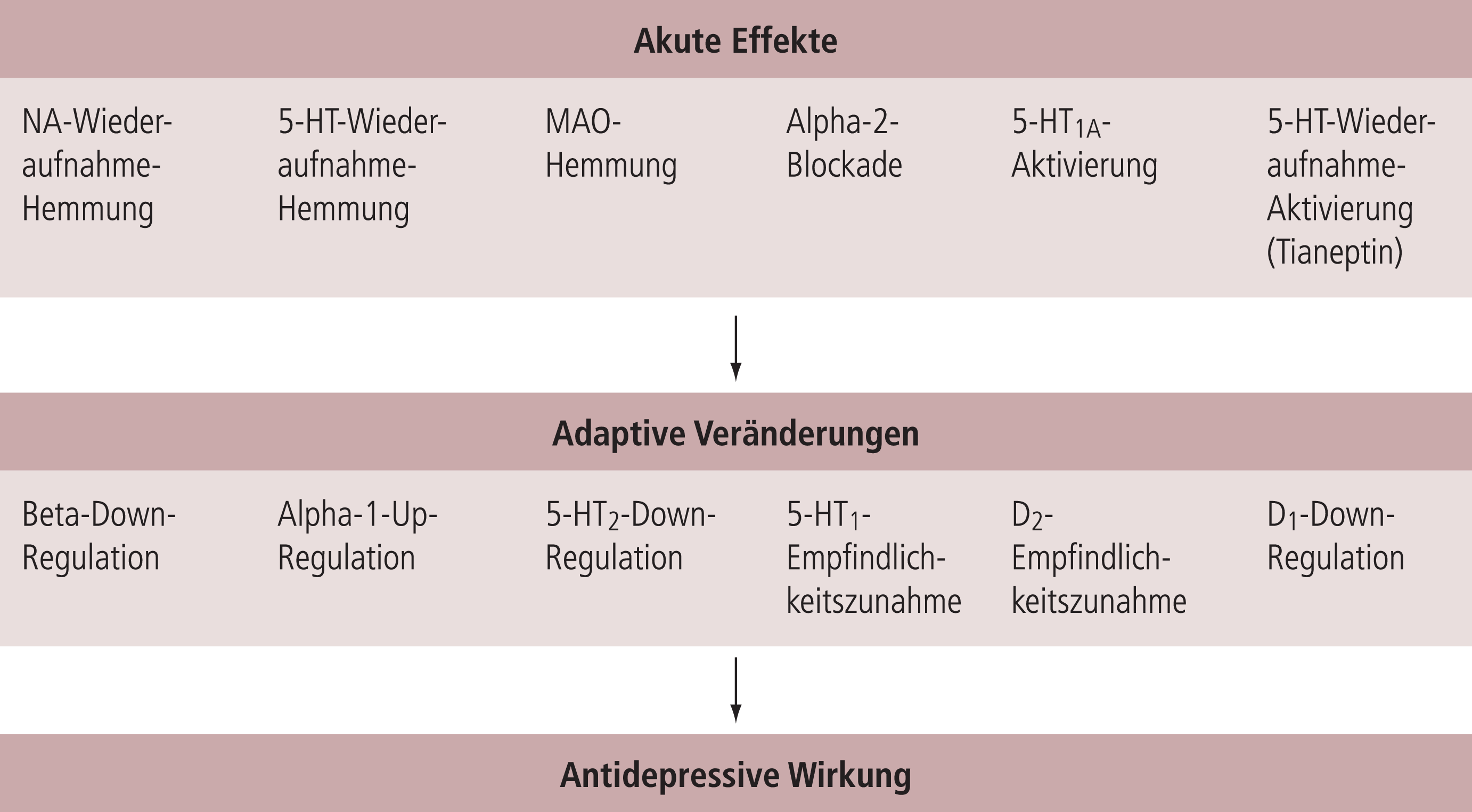
Abb. 1. Adaptive Veränderungen der synaptischen Übertragung als gemeinsame Endstrecke aller Antidepressiva In ursprünglichen Hypothesen wurde in adaptiven Veränderungen der Neurotransmission von Noradrenalin, Serotonin und Dopamin die gemeinsame verzögerte Endstrecke der Antidepressiva-Wirkung vermutet [mod. aus 45]. Weiterführende Untersuchungen und die Erkenntnis, dass die gleichen intrazellulären Signalkaskaden nicht nur Rezeptorveränderungen als Teil der synaptischen Plastizität vermitteln, sondern auch viele Bereiche der strukturellen Plastizität [4, 15, 46] haben dann zu den aktuellen Vorstellungen geführt, dass Veränderungen auf der Ebene der strukturellen Plastizität die wesentliche funktionell relevante gemeinsame Endstrecke aller Antidepressiva darstellen [9, 16, 50, 60, 66].
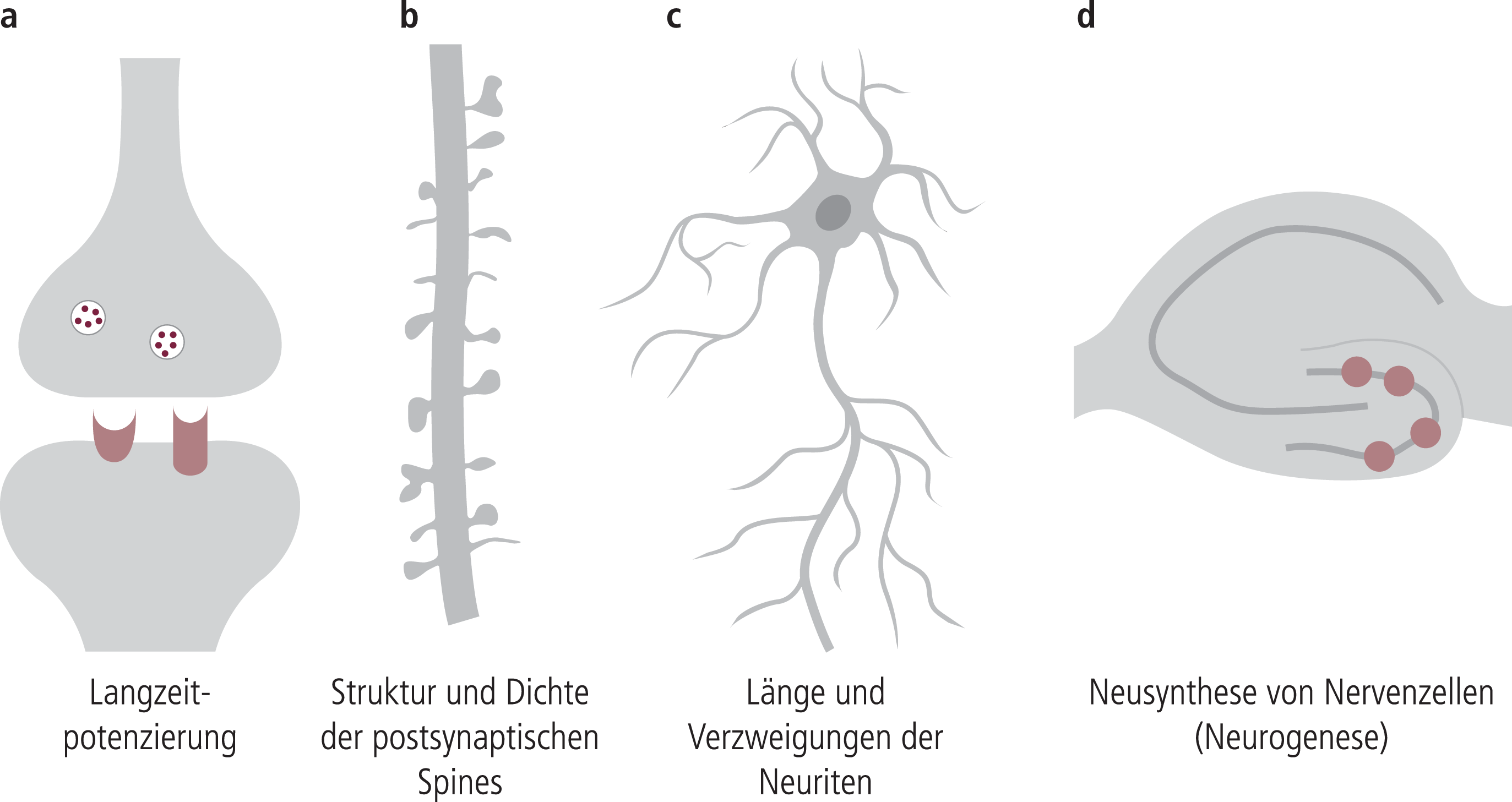
Abb. 2. Neuronale Plastizität Neben der synaptischen Plastizität auf der Ebene der Signaltransduktion (Rezeptoren, Transporter, Enzyme, siehe Abb. 1) umfasst die neuronale Plastizität auch funktionelle Aspekte der Synapse wie a) die Langzeitpotenzierung (ein Mechanismus der Signalprägnierung) und b) histologisch fassbare Veränderungen (wie Dichte und Struktur der postsynaptischen Spines), c) Länge und Verzweigungen der Neuriten und d) die Neusynthese von Nervenzellen (Neurogenese), die allerdings hauptsächlich zwei kleinen Arealen des Hippocampus vorbehalten bleibt.
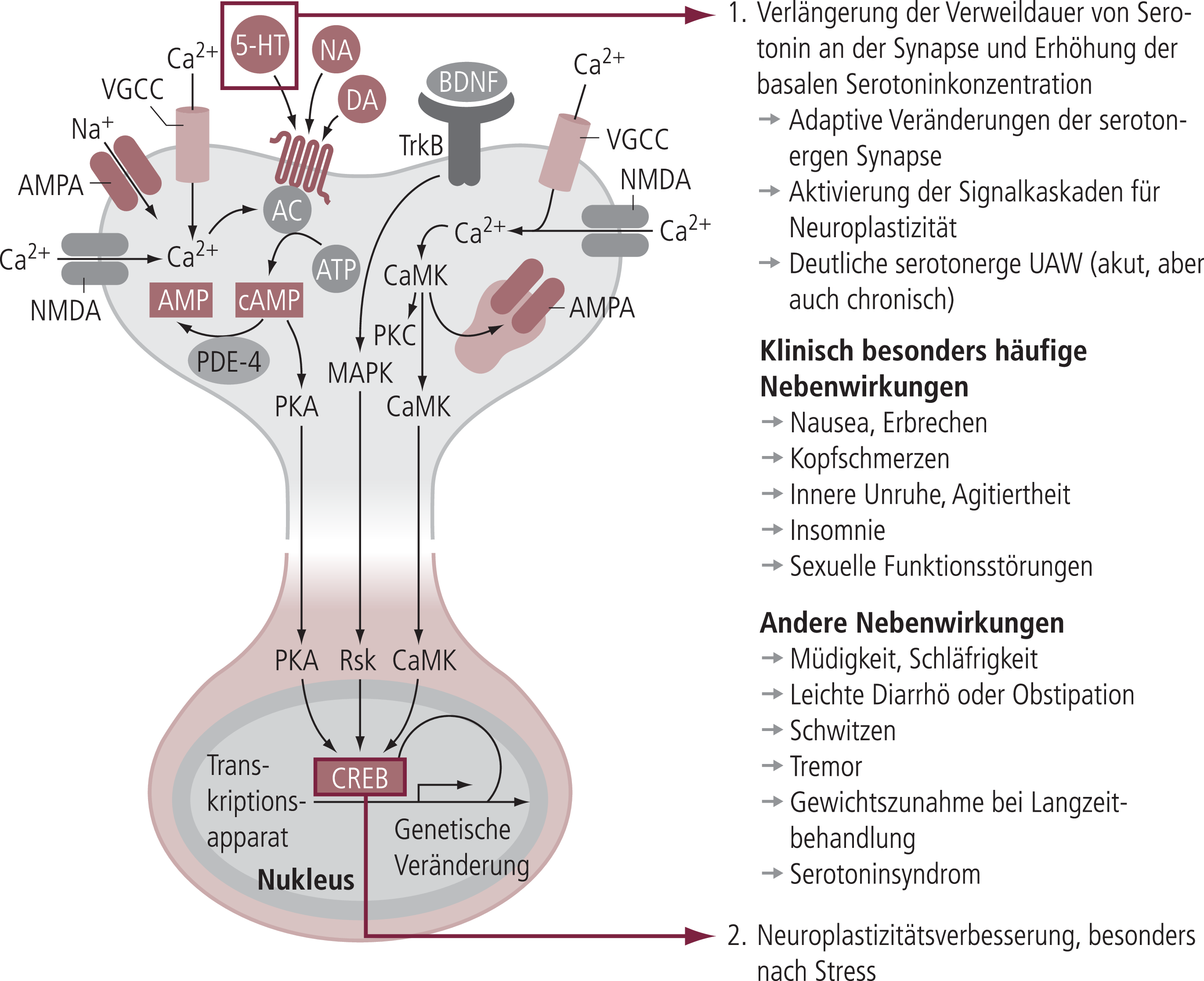
Abb. 3. Die Rolle molekularer Mechanismen der Neuroplastiziät bei der Wirkung von SSRI (Serotonin-Wiederaufnahmehemmer) Bei den SSRI werden verschiedene intrazelluläre Signalkaskaden durch die Erhöhung der synaptischen Serotoninkonzentration angestoßen, die aber auch gleichzeitig Ursache der vielen serotonergen UAW der SSRI ist [adaptiert nach 54]
Während damit der akute Wirkungsmechanismus eher nicht von großer Bedeutung für die finale antidepressive Wirksamkeit ist, scheint er für den individuellen Patienten doch eine große Rolle zu spielen, sodass es klinischer Standard ist, bei Nichtansprechen auf ein Antidepressivum alternativ eine Substanz mit anderem biochemischem Angriffspunkt zu wählen. Die akuten Angriffspunkte der Antidepressiva (Wiederaufnahmetransporter, Rezeptoren, Enzyme) spielen darüber hinaus eine sehr große Rolle für die zahlreichen, unterschiedlichen unerwünschten Arzneimittelwirkungen (UAW) der einzelnen Antidepressiva, die sehr häufig den Patienten sehr belasten und Therapie-limitierend sein können (Abb. 3). Die Wahl eines bestimmten Antidepressivums für einen bestimmten Patienten ist daher auch sehr deutlich von der zu erwartenden Verträglichkeit im Hinblick auf die UAW, bezogen auf den akuten Wirkungsmechanismus, bestimmt (Tab. 1).
Diese Zusammenhänge sind in Abbildung 3 schematisch am Beispiel der spezifischen Serotonin-Wiederaufnahmehemmer (SSRI), der heute am meisten eingesetzten Klasse von Antidepressiva, dargestellt. Diese Substanzen führen durch eine Blockade des Serotonintransporters (SERT) zu einer Erhöhung der synaptischen Serotoninkonzentration und über eine damit verbundene konstante Überaktivierung von Serotoninrezeptoren über eine Anstoßung bestimmter Signalkaskaden zu einer Erhöhung des Transkriptsfaktors pCREB und damit zu einer neurotrophen Wirkung. Das heißt, die Erhöhung der Serotoninkonzentration ist nur sehr indirekt mit der antidepressiven Wirksamkeit verbunden, zumal die SSRI auch eine Reihe von adaptiven Veränderungen auf der Ebene der Mechanismen der Signaltransduktion auslösen (Abb. 1). Dies deckt sich auch mit unseren Vorstellungen zur Neurochemie der Depression, die eher nicht mit einer veränderten synaptischen Serotoninkonzentration verbunden ist, sondern sich nach heutigen Evidenzen eher auf andere Mechanismen der serotonergen Neurotransmission bezieht, die im Rahmen des Depressionsprozesses verändert sind und sich zumindest zum Teil unter SSRI-Therapie normalisieren können (Tab. 2). Die Vorstellung, dass zu wenig Serotonin Depressionen auslöst, die durch Erhöhung der Serotoninkonzentration, beispielsweise durch SSRI, behoben werden können, ist in dieser Vereinfachung nicht haltbar. Es ist aber mit Sicherheit belegt, dass unter den meisten Antidepressiva eine Reihe von adaptiven Veränderungen im Rahmen der serotonergen Neurotransmission auftritt. Daher werden auch unter SSRI auftretende Veränderungen der Neuroplastizität (Abb. 3) primär über den Einfluss auf die synaptische Serotoninkonzentration erklärt. Die damit verbundene verstärkte Aktivierung von verschiedenen Serotoninrezeptoren führt dann zur vermehrten Phosphorylierung intrazellulärer Signalkinasen, die wiederum eine Neuroplastizitätszunahme in der gesamten Bandbreite auslösen [55]. Damit ist die „Neuroplastizitäts-Hypothese“ der Antidepressiva-Wirkung keine Ablösung der früheren Serotonin- bzw. Noradrenalin-Hypothesen, sondern deren Weiterentwicklung.
Tab. 2. Neurochemische Veränderungen innerhalb der serotonergen Neurotransmission bei depressiven Patienten [nach 10]. Trotz aller Variabilität weisen die Befunde auf eine biochemische Störung innerhalb der serotoninergen Neurotransmission bei depressiven Patienten hin, in den meisten Fällen als „trait“-Veränderung im Sinne einer biologischen Narbe [10]
|
Veränderter serotonerger Parameter |
Veränderung |
Signifikanz |
|
Serotonin-Aufnahme in Thrombozyten |
Erniedrigt |
Sehr gut |
|
Imipramin-Bindung an Thrombozyten |
Erniedrigt |
Gut |
|
5-HT2A-Rezeptorbindung an Trombozyten |
Erhöht |
Mäßig |
|
Tryptophan im Plasma |
Erniedrigt |
Sehr gut |
|
5-HIAA im Liquor |
Erniedrigt |
Mäßig |
|
Prolactin-Freisetzung durch SSRI |
Erniedrigt |
Sehr gut |
|
5-HT1A-Rezeptordichte im Gehirn (PET) |
Erniedrigt |
Sehr gut |
|
5-HT2A-Rezeptorbindung im Gehirn |
Variabel |
Schlecht |
5-HIAA: 5-Hydroxyindolylessigsäure, primärer Serotoninmetabolit; SSRI: Serotonin-Wiederaufnahmehemmer
2. Tianeptin: Serotonin-Reduktion an der Synapse anstatt Serotonin-Erhöhung
Vor diesem Hintergrund muss zunächst die atypische Substanz Tianeptin verstanden werden, die, wie frühere Untersuchungen gezeigt haben, durch eine Aktivierung des Wiederaufnahmeprozesses eher zu einer Serotonin-Reduktion als zu einer Serotonin-Erhöhung an der Synapse führt [12, 18, 43, 75]. Dass sie trotzdem gut antidepressiv wirksam sein kann, lässt sich anhand der oben formulierten Zusammenhänge sehr gut ableiten, da die Serotonin-Erhöhung durch die SSRI nicht per se der auslösende Mechanismus für die antidepressive Wirksamkeit ist, sondern wahrscheinlich nachgeschaltete adaptive Prozesse. Dies gilt auch für Tianeptin, das zunächst in der Klinik, dann aber auch im pharmakologischen Experiment eine sehr gute, mit anderen Substanzen vergleichbare antidepressive Wirksamkeit gezeigt hat [23, 24, 72].
Analog zu anderen Antidepressiva (z.B. SSRI) führt auch Tianeptin zu adaptiven Veränderungen im Bereich der serotonergen (Tab. 3) und zum Teil auch mit den serotonergen Neuronen verschalteten dopaminergen bzw. noradrenergen Synapsen (Abb. 1) [17, 42, 62]. Das heißt, obwohl die Substanz akut zunächst das Gegenteil von den SSRI bewirkt, hat sie im Hinblick auf die adaptiven Veränderungen im Bereich serotonerger Neurotransmission dann doch Parallelen zu den anderen Antidepressiva (Tab. 3). Bezogen auf das Schema in Abbildung 1 scheint also damit auch eine Verstärkung der Serotonin-Wiederaufnahme ein Mechanismus zu sein, der über ähnliche adaptive Veränderungen dann auch zu einer antidepressiven Wirksamkeit führen kann. Nicht analog zu den anderen Antidepressiva, besonders den SSRI, sind aber die durch die akute Serotonin-Erhöhung an der Synapse ausgelösten unerwünschten Arzneimittelwirkungen. Diese sind für Tianeptin weniger vorhanden, da die Substanz nicht zu einer Dauererhöhung von Serotonin führt, sondern eher zu einer Reduktion (Abb. 4). Typische über die Serotonin-Erhöhung erklärbaren unerwünschten Arzneimittelwirkungen der SSRI (Abb. 3) werden daher bei Tianeptin weniger gesehen [23, 24, 72]. Während diese Konzepte zunächst den Wirkungsmechanismus der atypischen Substanz Tianeptin im Zusammenhang mit allen anderen Antidepressiva – wenn auch unzureichend – beschreiben konnten, haben spätere Untersuchungen zur Neuroplastizität (Abb. 4) ein sehr überzeugendes Konzept zum Wirkungsmechanismus geliefert. Dies wurde auch durch in den USA aufkommende Untersuchungen über Effekte von Antidepressiva auf alle Mechanismen der Neuroplastizität bestätigt, in denen das in nur wenigen europäischen Ländern verfügbare Tianeptin eine sehr wichtige Rolle spielte [41].
Tab. 3. Veränderungen an der serotonergen Synapse durch chronische Applikation von Tianeptin
|
Verkürzung der Verweildauer von Serotonin an der Synapse, ohne die basale Serotoninkonzentration zu beeinflussen [34, 51, 75] |
|
Zunahme der Dichte des Serotonintransporters (SERT) [51] |
|
Erhöhte Bmax für synaptosomale Serotoninaufnahme [43] |
|
Antagonisierung von Stress-induzierter Reduktion der synaptosomalen Serotoninaufnahme [44] |
|
Erhöhte Dichte von SERT-immunreaktiven Neuronen [77] |
|
Interaktion mit der inhibitorischen Wirkung präsynaptischer 5-HT1B-Rezeptoren [6, 7] |
Bmax: maximale Bindungskapazität
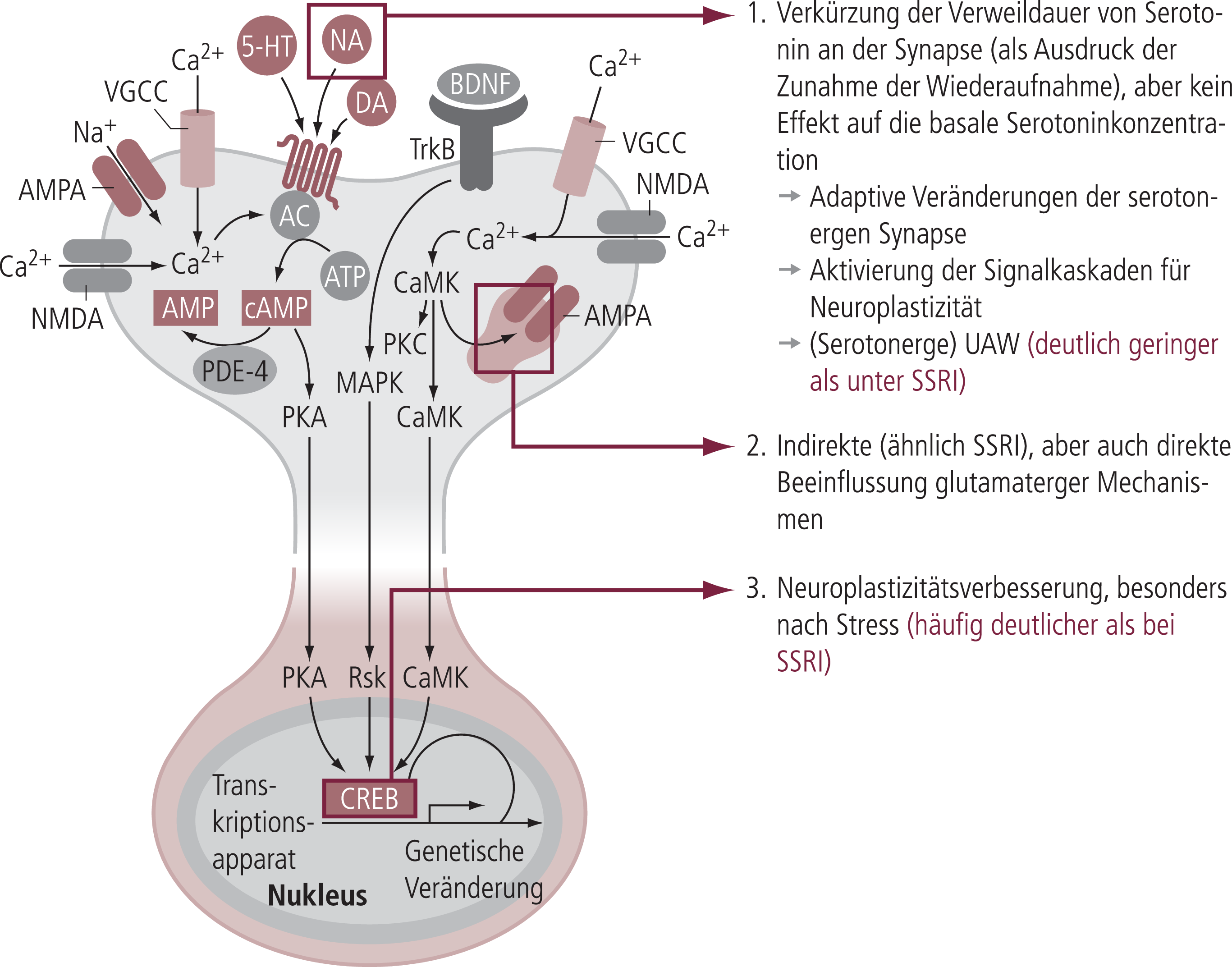
Abb. 4. Die Rolle molekularer Mechanismen der Neuroplastizität bei Tianeptin Tianeptin stößt die Kaskade über eine verstärkte Serotoninaufnahme an, führt aber nicht zu einer synaptischen Serotoninerhöhung. Tianeptin zeigt daher weniger die typischen UAW [nach 54].
3. Mechanismen der Neuroplastizität als Angriffspunkt von Antidepressiva
Wie bereits erwähnt, geht man heute davon aus, dass Veränderungen der Neuroplastizität bei der Entstehung der Depression eine wichtige Rolle spielen und dass diese als gemeinsame Endstrecke von praktisch allen Antidepressiva zumindest partiell wieder hergestellt wird (Abb. 3). Aus diesem Grund hat man erste Berichte, dass auch Tianeptin zu Verbesserungen besonders nach Stress eingeschränkter Neuroplastizität führt, eher als Beleg dafür gesehen, dass die Veränderungen der serotonergen Neurotransmission, die bei Tianeptin von einem anderen Mechanismus ausgehen, in die gleiche gemeinsam Endstrecke aller Antidepressiva münden. Allerdings hat man immer wieder gesehen, dass Neuroplastizitätsveränderungen unter Tianeptin oft ausgeprägter waren als bei antidepressiven Vergleichssubstanzen. Dies hat dazu geführt, dass Tianeptin heute ein Antidepressivum ist, für das Effekte auf die neuronale Plastizität in der ganzen Breite (Abb. 1) mit am besten belegt sind. Dies ist umso bemerkenswerter, da die Substanz nur in wenigen Ländern verfügbar ist, darunter seit wenigen Jahren in Deutschland. Tianeptin war damit ein Vorreiter der Befunde über eine Verbesserung der Neuroplastizität [32, 73] durch praktisch alle Antidepressiva [35]. Effekte auf die Stress-gestörte Neuritogenese wurden in diesen ersten Arbeiten für zwei SSRI zunächst nicht gesehen [32] und werden als Ausdruck der atypischen Beeinflussung der serotonergen Neurotransmission interpretiert [32]. Befunde, dass Taneptin neben Effekten auf die Neuritogenese auch andere Effekte auf die Neuroplastizität zeigt (z.B. Neurogenese) [11], haben dazu geführt, dass eine Verbesserung gestörter Mechanismen der Neuroplastizität als gemeinsame Endstrecke aller Antidepressiva diskutiert werden konnte.
Es würde den Rahmen dieser kurzen Zusammenfassung sprengen, alle diese Befunde aufzuzählen. Hier sei nur auf eine ganze Reihe von Übersichten verwiesen, die diesen wesentlichen Aspekt von Tianeptin zusammengefasst haben [19, 20, 37, 38, 40, 41, 70]. Wichtig ist hier festzuhalten, dass die Plastizität-verbessernden Effekte von Tianeptin sich über die ganze Bandbreite von Neuroplastizitätsmechanismen erstrecken. Eine der Übersicht von McEwen und Olié [41] entnommene und erweiterte Zusammenfassung zeigt dies sehr schön (Tab. 4). Diese Verbesserungen, häufig nach stressinduzierter Verschlechterung, beziehen sich auf strukturelle Aspekte wie Neuritogenese, Neurogenese, hippocampale Volumenveränderung, aber auch auf Mechanismen der neuronalen Erregbarkeit besonders von verschiedenen Hirnstrukturen. Auch gewisse neuroprotektive bzw. Apoptose-hemmende Effekte hat man für die Substanz gesehen. Da Plastizitätsphänomene auch eine sehr wichtige Rolle in kognitiven Prozessen spielen, ist es nicht verwunderlich, dass Tianeptin in verschiedenen Tiermodellen auch eine Kognitions-verbessernde Wirkung gezeigt hat, die wie bereits erwähnt, auch in zwei Untersuchungen an depressiven Patienten gesehen wurde (siehe Absatz 4).
Tab. 4. Wichtige Effekte von Tianeptin auf Mechanismen der synaptischen Plastizität [mod. nach 41]
|
Strukturelle Plastizität |
|
Verhindert Stress- und Corticosteroid-induzierte dendritische Atrophie im Hippocampus [32, 73] |
|
Verhindert die Stress-induzierte Reduktion der Proliferation von neuronalen Stammzellen im Gyrus dentatus [11] |
|
Verhindert die Stress-induzierte Volumenabnahme des Hippocampus [11, 76] |
|
Verhindert die Stress-induzierte Abnahme des Markers N-Acetylaspartat [11] |
|
Verhindert Atrophie von Dendriten in der Amygdala [61] |
|
Verbessert Stress-induzierte Volumenabnahme des Hippocampus [30] |
|
Neuronale Erregbarkeit |
|
Verhindert die Stress-induzierte Abnahme von LTP im Hippocampus [67] |
|
Antagonisiert den hemmenden Effekt von Stress auf LTP an hippocampal-frontalen Synapsen [61] |
|
Antagonisiert die Stress-induzierte Reduktion von synaptischer Plastizität im Hippocampus [71] |
|
Antagonisierung Stress-induzierter Down-Regulation der Genexpression neutrotropher Faktoren [2] |
|
Neuroprotektion |
|
Reduktion von Apoptose im Hippocampus und im temporalen Cortex [31] |
|
Kognition |
|
Hemmt Stress-induzierte Einschränkung des räumlichen Gedächtnisses [8] |
|
Antagonisiert den reduzierenden Effekt von Alkohol auf die Gedächtnisleistung [11] |
|
Verbessert fokussierte Aufmerksamkeit [13] |
|
Verbessert Gedächtnisleistung [21, 53] |
LTP: Langzeitpotenzierung
Bei dieser ungewöhnlichen Breite der Effekte von Tianeptin auf Mechanismen der Neuroplastizität stellte sich immer wieder die Frage, ob die relativ geringen Effekte in der serotonergen Neurotransmission ausreichen, alle Neuroplastizitätsveränderungen zu verbessern oder ob noch andere Bereiche involviert sind. Diese hat man dann in sehr deutlichen Effekten auf die glutamaterge Neurotransmission gesehen (siehe Absatz 4), die unabhängig von einer Beeinflussung der serotonergen Neurotransmission waren.
4. Eingriffe in die glutamaterge Neurotransmission, ein zusätzlicher antidepressiver Mechanismus von Tianeptin
Über die serotonerge Transmission hinaus hat sich für Tianeptin noch ein weiterer wichtiger neurochemischer Wirkungsmechanismus herauskristallisiert. Während auch andere Antidepressiva durch die komplexe Verschaltung der Neurone im zentralen Nervensystem gewisse sekundäre Veränderungen an glutamatergen Mechanismen auslösen können, hat Tianeptin direkte Effekte auf die glutamaterge Neurotransmission (Abb. 4), die zusätzlich die häufig deutlicher zu sehenden Neuroplastizitätsveränderungen unter Tianeptin im Vergleich zu anderen Antidepressiva wie SSRI erklären können [5].
Der Neurotransmitter Glutamat ist für die Pharmakologie von Antidepressiva schon immer als ein mögliches beteiligtes Target diskutiert worden, da Glutamat zum einen eine deutliche regulatorische Funktion für Neuroplastizitätsphänomene hat und zum anderen glutamaterge Mechanismen für die Steuerung der Kognition eine große Bedeutung haben [63]. Die Evidenzen, die es bisher für Antidepressiva im Hinblick auf eine Beteiligung glutamaterger Mechanismen gab, waren aber eher begrenzt und wurden meist durch indirekte Mechanismen erklärt, das heißt eine Beeinflussung glutamaterger Neurone über die bekannten Targetneurone der Antidepressiva wie das serotonerge System [14, 49]. In neuerer Zeit hat dieses Konzept weitere Bestätigung durch die antidepressive Wirkung von niedrig dosiertem Ketamin gefunden, das über einen Angriff in der glutamatergen Neurotransmission zur Aktivierung der bereits bekannten intrazellulären Signalkaskaden führt, die letztlich über Effekte auf Neuroplastizitätsmechanismen eine antidepressive Wirkung auslösen [1]. Im Fall von Tianeptin ist die Datenlage anders als bei den übrigen Antidepressiva, da heute eine ganze Reihe von Evidenzen belegen, dass die Substanz direkt glutamaterge Mechanismen moduliert und nicht indirekt durch eine Beeinflussung beispielsweise serotonerger Neurone. Tianeptin hat auch direkte neurotrophe Eigenschaften, wie Untersuchungen an Zellkulturen gezeigt haben, wo kein glutamaterger Input vorhanden ist. So konnten Lee et al. [29] an humanen SY5Y-Zellen (Neuroblastomzellen) zeigen, dass Tianeptin zu einer Zunahme der Expression des für die Bildung neurotropher Faktoren wichtigen Transkriptionsfaktors CREB führt. Dies bewirkt die vermehrte Expression eines Adhäsionsproteins, das durch Interaktion mit verschiedenen Oberflächenproteinen Signalkaskaden aktiviert, die für die Synaptogenese eine wichtige Rolle spielen. Auch an primären hippocampalen Neuronen konnte man zeigen, dass Tianeptin die Synaptogenese fördert, gemessen über verschiedene synaptische Marker und die Synthese von BDNF [65].
Wenn auch das molekulare Target dieses Effekts noch nicht identifiziert ist, spricht vieles dafür, dass Tianeptin direkt verschiedene Proteinkinasen aktiviert, die wiederum die für die Depression und auch die für die antidepressive Wirkung relevanten Targetproteine phosphorylieren, beispielsweise Wachstumsfaktoren und ganz besonders auch Transporter sowie Rezeptorstrukturen. Wie in Tabelle 5 zusammengefasst, haben sich hier in den letzten Jahren ganz besonders Effekte von Tianeptin auf die Phosphorylierung des AMPA-Rezeptors herausgestellt, die die sehr deutlichen Effekte von Tianeptin auf Mechanismen der Neuroplastizität erklären können (Abb. 4). Tianeptin ist damit eine Substanz, die nicht nur modulierend in die serotonerge Neurotransmission eingreift, sondern auch modulatorische Effekte auf Mechanismen der glutamatergen Neurotransmission hat. Die Betonung liegt hier auf modulatorischen Effekten und nicht etwa direkten Effekten, da die Substanz mit keinem der bekannten Targets der glutamatergen Neurotransmission (Rezeptoren, Transporter) interagiert. Dies ist wiederum für das Nebenwirkungsspektrum der Substanz günstig, da man sich von einem Rezeptorliganden innerhalb der glutamatergen Neurotransmission doch eine Reihe von störenden unerwünschten Arzneimittelwirkungen vorstellen könnte.
Tab. 5. Effekte von Tianeptin auf Mechanismen der glutamatergen Neurotransmission
|
Tianeptin reguliert die Stress-veränderte Balance von NMDA- vs. AMPA-Rezeptor-Funktion in vivo und hat in vitro einen direkten Effekt auf beide Parameter. Eine Rolle von Kinasen und geänderte Rezeptorphosphorylierung wird vermutet [26] |
|
Tianeptin antagonisiert die durch chronischen Stress ausgelöste Up-Regulation des Glutamat-Transporters GLT-1 [58] |
|
Tianeptin hemmt eine durch chronischen Stress ausgelöste Zunahme der extrazellulären L-Glutamat-Konzentration in der Amygdala [59] |
|
Stress-induzierte glutamaterge Defizite (reduzierter Efflux und reduzierte Expression des vesikulären Glutamat-Transporters vGLUT2) werden durch Tianeptin aufgehoben [52] |
|
Tianeptin führt zu einer vermehrten Phosphorylierung der AMPA-Rezeptor-Untereinheit GInR1 deutlicher als Fluoxetin, die für die antidepressive Wirkung mit verantwortlich ist [68] |
|
Die vermehrte GluA1-Phosphorylierung durch Tianeptin führt zu einer Zunahme der AMPA-Rezeptor-Funktion [3] |
|
Tianeptin führt zu einer AMPA-Rezeptor(GluA1)-Phosphorylierung durch verschiedene Kinasen (CaMKII, PKA, MAPK, JNK) [69] |
|
Tianeptin verändert die AMPA-Rezeptor-Sequestrierung [76] |
|
Stress führt zu einer Abnahme der Langzeitpotenzierung im präfrontalen Cortex (PFC). Dieser Effekt wurde von Tianeptin, nicht aber von Imipramin gehemmt. Der Effekt von Tianeptin war begleitet von einer Zunahme der Phosphorylierung verschiedener neurotropher Faktoren [56] |
Wie bereits erwähnt, würde man von einer glutamatergen Substanz nicht nur Effekte im Hinblick auf die Neuroplastizität erwarten, was für Tianeptin gut belegt ist, sondern würde auch bestimmte Effekte auf kognitive Prozesse erwarten. Diese sind auch vorhanden, und so ist beispielsweise für Tianeptin im Tierversuch eine Kognitions-verbessernde Wirkung beschrieben worden [21]. Allerdings hat man diese Eigenschaft von Tianeptin nicht weiter intensiv untersucht, obwohl zwei klinische Studien eine gute Wirkung auf kognitive Dysfunktionen depressiver Patienten zeigen [22, 25]. In der letzten Studie konnte sogar gezeigt werden, dass die kognitiven Verbesserungen durch Tianeptin deutlich ausgeprägter waren als durch die Vergleichssubstanz Escitalopram.
5. Zusammenfassung
Die Substanz Tianeptin zeichnet sich [65] durch einige wesentliche Besonderheiten im Wirkungsmechanismus im Vergleich zu anderen Antidepressiva aus. Sie führt auch analog zu den meisten anderen Antidepressiva zu einer Modulation der serotonergen Neurotransmission, allerdings ist der primäre Angriffspunkt eine Beschleunigung der Serotonin-Wiederaufnahme, deutlich unterschieden von den anderer Antidepressiva, die in der Regel die synaptische Serotoninkonzentration erhöhen. Die sich dann anschließenden adaptiven serotonergen Veränderungen sind wahrscheinlich für die bei der Substanz deutlich zu sehenden Neuroplastizitätsverbesserungen mitverantwortlich, auch hier in Analogie zu anderen Antidepressiva. Da durch diesen Mechanismus die Substanz nicht zu einer Erhöhung der synaptischen Serotoninkonzentration führt, sind typische serotonerge unerwünschte Arzneimittelwirkungen geringer, da diese unseren heutigen Vorstellungen nach sehr stark von der Erhöhung der Serotoninkonzentration initiiert werden.
Die Substanz führt offensichtlich auch zu einer Aktivierung intrazellulärer Signalmoleküle (verschiedene Kinasen), unter deren Aktivierung Targetmoleküle verstärkt phosphoryliert und damit aktiviert werden. Dies bewirkt zum einen eine verbesserte AMPA-Rezeptor-Funktion und damit übergreifende Effekte in der glutamatergen Neurotransmission, zum anderen aber auch eine vermehrte direkte Aktivierung der für Neuroplastizitätsprozesse wichtigen Signalmoleküle.
Beide Prozesse erklären die breiten Effekte von Tianeptin auf die Neuroplastitizät, die ausgeprägter zu sein scheinen als bei den meisten anderen Antidepressiva.
Interessenkonflikterklärung
WEM hat Vortrags- und Beraterhonorare erhalten von Lundbeck, Neuraxpharm Arzneimittel GmbH und Dr. Willmar Schwabe GmbH.
Literatur
1. Abdallah CG, Sanacora G, Duman RS, Krystal JH. Ketamine and rapid-acting antidepressants: a window into a new neurobiology for mood disorder therapeutics. Annu Rev Med 2015;66:509–23.
2. Alfonso J, Frick LR, Silberman DM, Palumbo ML, et al. Regulation of hippocampal gene expression is conserved in two species subjected to different stressors and antidepressant treatments. Biol Psychiatry 2006;59:244–51.
3. Barkóczi B, Juhász G, Averkin RG, Vörös I, et al. GluA1 phosphorylation alters evoked firing pattern in vivo. Neural Plast 2012;2012: 286215.
4. Benusková L. Antidepressants and synaptic plasticity: a hypothesis. Med Hypotheses 1991;35:17–22.
5. Berton O, Nestler EJ. New approaches to antidepressant drug discovery: beyond monoamines. Nat Rev Neurosci 2006;7:137–51.
6. Bolaños-Jiménez F, de Castro RM, Fillion G, De Simoni MG, et al. Antagonism by citalopram and tianeptine of presynaptic 5-HT1B-heteroreceptors inhibiting acetylcholine release. Eur J Pharmacol 1993;242:1–6.
7. Bolaños-Jiménez F, Manhães de Castro R, Fillion G. Effect of chronic antidepressant treatment on 5-HT1B presynaptic heteroreceptors inhibiting acetylcholine release. Neuropharmacology 1994;33:77–81.
8. Campbell AM, Park CR, Zoladz PR, Muñoz C, et al. Pre-training administration of tianeptine, but not propranolol, protects hippocampus-dependent memory from being impaired by predator stress. Eur Neuropsychopharmacol 2008;18:87–98.
9. Castrén E, Hen R. Neuronal plasticity and antidepressant actions. Trends Neurosci 2013;36:259–67.
10. Cowen PJ. Serotonin and depression: pathophysiological mechanism or marketing myth? Trends Pharmacol Sci 2008;29:433–6.
11. Czéh B, Michaelis T, Watanabe T, Frahm J, et al. Stress-induced changes in cerebral metabolites, hippocampal volume, and cell proliferation are prevented by antidepressant treatment with tianeptine. Proc Natl Acad Sci U S A. 2001;98:12796–801.
12. De Simoni MG, De Luigi A, Clavenna A, Manfridi A. In vivo studies on the enhancement of serotonin reuptake by tianeptine. Brain Res 1992;574:93–7.
13. Delagrange P, Bouyer JJ, Montaron MF, Durand C, et al. Action of tianeptine on focalization of attention in cat. Psychopharmacology (Berl) 1990;102:227–33.
14. Deutschenbaur L, Beck J, Kiyhankhadiv A, Mühlhauser M, et al. Role of calcium, glutamate and NMDA in major depression and therapeutic application. Prog Neuropsychopharmacol Biol Psychiatry 2015 Mar 4; pii: S0278–5846(15)00049–4.
15. Duman RS, Heninger GR, Nestler EJ. Molecular psychiatry. Adaptations of receptor-coupled signal transduction pathways underlying stress- and drug-induced neural plasticity. J Nerv Ment Dis 1994;182:692–700.
16. Dupin N, Mailliet F, Rocher C, Kessal K, et al. Common efficacy of psychotropic drugs in restoring stress-induced impairment of prefrontal plasticity. Neurotox Res 2006;10:193–8.
17. Dziedzicka-Wasylewska M, Rogoz Z, Skuza G, Dlaboga D, et al. Effect of repeated treatment with tianeptine and fluoxetine on central dopamine D(2)/D(3) receptors. Behav Pharmacol 2002;13:127–38.
18. Fattaccini CM, Bolaños-Jimenez F, Gozlan H, Hamon M. Tianeptine stimulates uptake of 5-hydroxytryptamine in vivo in the rat brain. Neuropharmacology 1990;29:1–8.
19. Fuchs E, Czeh B, Kole MH, Michaelis T, et al. Alterations of neuroplasticity in depression: the hippocampus and beyond. Eur Neuropsychopharmacol 2004;14(Suppl 5):S481–90.
20. Fuchs E, Czéh B, Michaelis T, de Biurrun G, et al. Synaptic plasticity and tianeptine: structural regulation. Eur Psychiatry 2002;17(Suppl 3):311–7.
21. Jaffard R, Mocaer E, Poignant JC, Micheau J, et al. Effects of tianeptine on spontaneous alternation, simple and concurrent spatial discrimination learning and on alcohol-induced alternation deficits in mice. Behav Pharmacol 1991;2:37–46.
22. Jeon HJ, Woo JM, Lee SH, Kim EJ, et al. Improvement in subjective and objective neurocognitive functions in patients with major depressive disorder: a 12-week, multicenter, randomized trial of tianeptine versus escitalopram, the CAMPION study. J Clin Psychopharmacol 2014;34:218–25.
23. Kasper S, McEwen BS. Neurobiological and clinical effects of the antidepressant tianeptine. CNS Drugs 2008;22:15–26.
24. Kasper S, Olié JP. A meta-analysis of randomized controlled trials of tianeptine versus SSRI in the short-term treatment of depression. Eur Psychiatry 2002;17(Suppl 3):331–40.
25. Klasik A, Krysta K, Krupka-Matuszczyk I. Effect of tianeptine on cognitive functions in patients with depressive disorders during a 3-month observation. Psychiatr Danub 2011;23(Suppl 1):S18–22.
26. Kole MH, Swan L, Fuchs E. The antidepressant tianeptine persistently modulates glutamate receptor currents of the hippocampal CA3 commissural associational synapse in chronically stressed rats. Eur J Neurosci 2002;16:807–16.
27. Kopanski C, Türck M, Schultz JE. Effects of long-term treatment of rats with antidepressants on adrenergic-receptor sensitivity in cerebral cortex: Structure activity study. Neurochem Int 1983;5:649–59.
28. Kuroda Y, Watanabe Y, McEwen BS. Tianeptine decreases both serotonin transporter mRNA and binding sites in rat brain. Eur J Pharmacol 1994;268:R3–5.
29. Lee MG, Oh D, Choi MR, Chai YG, et al. NCAM140 and pCREB expression after tianeptine treatment of SH-SY5Y cells. Psychiatry Investig 2014;11:313–8.
30. Liu W, Shu XJ, Chen FY, Zhu C, et al. Tianeptine reverses stress-induced asymmetrical hippocampal volume and N-acetylaspartate loss in rats: an in vivo study. Psychiatry Res 2011;194:385–92.
31. Lucassen PJ, Fuchs E, Czéh B. Antidepressant treatment with tianeptine reduces apoptosis in the hippocampal dentate gyrus and temporal cortex. Biol Psychiatry 2004;55:789–96.
32. Magariños AM, Deslandes A, McEwen BS. Effects of antidepressants and benzodiazepine treatments on the dendritic structure of CA3 pyramidal neurons after chronic stress. Eur J Pharmacol 1999;371:113–22.
33. Magariños AM, Deslandes A, McEwen BS. Effects of antidepressants and benzodiazepine treatments on the dendritic structure of CA3 pyramidal neurons after chronic stress. Eur J Pharmacol 1999;371:113–22.
34. Malagié I, Deslandes A, Gardier AM. Effects of acute and chronic tianeptine administration on serotonin outflow in rats: comparison with paroxetine by using in vivo microdialysis. Eur J Pharmacol 2000;403:55–65.
35. Malberg JE, Eisch AJ, Nestler EJ, Duman RS. Chronic antidepressant treatment increases neurogenesis in adult rat hippocampus. J Neurosci 2000;20:9104–10.
36. Manji HK, Moore GJ, Rajkowska G, Chen G. Neuroplasticity and cellular resilience in mood disorders. Mol Psychiatry 2000;5:578–93.
37. McEwen BS, Chattarji S, Diamond DM, Jay TM, et al. The neurobiological properties of tianeptine (Stablon): from monoamine hypothesis to glutamatergic modulation. Mol Psychiatry 2010;15:237–49.
38. McEwen BS, Chattarji S. Molecular mechanisms of neuroplasticity and pharmacological implications: the example of tianeptine. Eur Neuropsychopharmacol 2004;14(Suppl 5):S497–502.
39. McEwen BS, Conrad CD, Kuroda Y, Frankfurt M, et al. Prevention of stress-induced morphological and cognitive consequences. Eur Neuropsychopharmacol 1997;7(Suppl 3):S323–8.
40. McEwen BS, Magarinos AM, Reagan LP. Structural plasticity and tianeptine: cellular and molecular targets. Eur Psychiatry 2002;17(Suppl 3):318–30.
41. McEwen BS, Olié JP. Neurobiology of mood, anxiety, and emotions as revealed by studies of a unique antidepressant: tianeptine. Mol Psychiatry 2005;10:525–37.
42. Meneses A. Tianeptine: 5-HT uptake sites and 5-HT1–7 receptors modulate memory formation in an autoshaping Pavlovian/instrumental task. Neurosci Biobehav Rev 2002;26:309–19.
43. Mennini T, Mocaer E, Garattini S. Tianeptine, a selective enhancer of serotonin uptake in rat brain. Naunyn Schmiedebergs Arch Pharmacol 1987;336:478–82.
44. Mennini T, Taddei C, Codegoni A, Gobbi M, et al. Acute noise stress reduces [3H]5-hydroxytryptamine uptake in rat brain synaptosomes: protective effects of buspirone and tianeptine. Eur J Pharmacol 1993;241:255–60.
45. Müller WE, Eckert A. Psychopharmakotherapie, pharmakologische Grundlagen. In: Möller HJ, Laux G, Kapfhammer H-P (Hrsg.). Psychiatrie, Psychosomatik, Psychotherapie. Heidelberg: Springer-Verlag, 1999.
46. Nakamura S. Axonal sprouting of noradrenergic locus coeruleus neurons following repeated stress and antidepressant treatment. Prog Brain Res 1991;88:587–98.
47. Ninan I. Synaptic regulation of affective behaviors; role of BDNF. Neuropharmacology 2014;76(Pt C):684–95.
48. Ota KT, Duman RS. Environmental and pharmacological modulations of cellular plasticity: role in the pathophysiology and treatment of depression. Neurobiol Dis 2013;57:28–37.
49. Pehrson AL, Sanchez C. Serotonergic modulation of glutamate neurotransmission as a strategy for treating depression and cognitive dysfunction. CNS Spectr 2014;19:121–33.
50. Pilar-Cuéllar F, Vidal R, Díaz A, Castro E, et al. Neural plasticity and proliferation in the generation of antidepressant effects: hippocampal implication. Neural Plast 2013;2013: 537265.
51. Piñeyro G, Deveault L, Blier P, Dennis T, et al. Effect of acute and prolonged tianeptine administration on the 5-HT transporter: electrophysiological, biochemical and radioligand binding studies in the rat brain. Naunyn Schmiedebergs Arch Pharmacol 1995;351:111–8.
52. Piroli GG, Reznikov LR, Grillo CA, Hagar JM, et al. Tianeptine modulates amygdala glutamate neurochemistry and synaptic proteins in rats subjected to repeated stress. Exp Neurol 2013;241:184–93.
53. Pitkänen A, Savander V, LeDoux JE. Organization of intra-amygdaloid circuitries in the rat: an emerging framework for understanding functions of the amygdala. Trends Neurosci 1997;20:517–23.
54. Pittenger C, Duman RS. Stress, depression, and neuroplasticity: a convergence of mechanisms. Neuropsychopharmacology 2008;33:88–109.
55. Popoli M, Mori S, Brunello N, Perez J, et al. Serine/threonine kinases as molecular targets of antidepressants: implications for pharmacological treatment and pathophysiology of affective disorders. Pharmacol Ther 2001;89:149–70.
56. Qi H, Mailliet F, Spedding M, Rocher C, et al. Antidepressants reverse the attenuation of the neurotrophic MEK/MAPK cascade in frontal cortex by elevated platform stress; reversal of effects on LTP is associated with GluA1 phosphorylation. Neuropharmacology 2009;56:37–46.
57. Reagan LP, Hendry RM, Reznikov LR, Piroli GG, et al. Tianeptine increases brain-derived neurotrophic factor expression in the rat amygdala. Eur J Pharmacol 2007;565: 68–75.
58. Reagan LP, Rosell DR, Wood GE, Spedding M, et al. Chronic restraint stress up-regulates GLT-1 mRNA and protein expression in the rat hippocampus: reversal by tianeptine. Proc Natl Acad Sci U S A. 2004;101:2179–84.
59. Reznikov LR, Grillo CA, Piroli GG, Pasumarthi RK, et al. Acute stress-mediated increases in extracellular glutamate levels in the rat amygdala: differential effects of antidepressant treatment. Eur J Neurosci 2007;25:3109–14.
60. Rief W, Barsky AJ, Bingel U, Doering BK, et al. Rethinking psychopharmacotherapy: The role of treatment context and brain plasticity in antidepressant and antipsychotic interventions. Neurosci Biobehav Rev 2016;60:51–64.
61. Rocher C, Spedding M, Munoz C, Jay TM. Acute stress-induced changes in hippocampal/prefrontal circuits in rats: effects of antidepressants. Cereb Cortex 2004;14:224–9.
62. Rogóz Z, Skuza G, Dlaboga D, Maj J, et al. Effect of repeated treatment with tianeptine and fluoxetine on the central alpha(1)-adrenergic system. Neuropharmacology 2001;41:360–8.
63. Sanacora G, Treccani G, Popoli M. Towards a glutamate hypothesis of depression: an emerging frontier of neuropsychopharmacology for mood disorders. Neuropharmacology 2012;62:63–77.
64. Sanchez C, Asin KE, Artigas F. Vortioxetine, a novel antidepressant with multimodal activity: review of preclinical and clinical data. Pharmacol Ther 2015;145:43–57.
65. Seo MK, Lee CH, Cho HY, Lee JG, et al. Effects of antidepressant drugs on synaptic protein levels and dendritic outgrowth in hippocampal neuronal cultures. Neuropharmacology 2014;79:222–33.
66. Serafini G. Neuroplasticity and major depression, the role of modern antidepressant drugs. World J Psychiatry 2012;2:49–57.
67. Shakesby AC, Anwyl R, Rowan MJ. Overcoming the effects of stress on synaptic plasticity in the intact hippocampus: rapid actions of serotonergic and antidepressant agents. J Neurosci 2002;22:3638–44.
68. Svenningsson P, Bateup H, Qi H, Takamiya K, et al. Involvement of AMPA receptor phosphorylation in antidepressant actions with special reference to tianeptine. Eur J Neurosci 2007;26:3509–17.
69. Szegedi V, Juhász G, Zhang X, Barkóczi B, et al. Tianeptine potentiates AMPA receptors by activating CaMKII and PKA via the p38, p42/44 MAPK and JNK pathways. Neurochem Int 2011;59:1109–22.
70. Uzbay TI. Tianeptine: potential influences on neuroplasticity and novel pharmacological effects. Prog Neuropsychopharmacol Biol Psychiatry 2008;32:915–24.
71. Vouimba RM, Muñoz C, Diamond DM. Differential effects of predator stress and the antidepressant tianeptine on physiological plasticity in the hippocampus and basolateral amygdala. Stress 2006;9:29–40.
72. Wagstaff AJ, Ormrod D, Spencer CM. Tianeptine: a review of its use in depressive disorders. CNS Drugs 2001;15:231–59.
73. Watanabe Y, Gould E, Daniels DC, Cameron H, et al. Tianeptine attenuates stress-induced morphological changes in the hippocampus. Eur J Pharmacol 1992;222:157–62.
74. Watanabe Y, Sakai RR, McEwen BS, Mendelson S. Stress and antidepressant effects on hippocampal and cortical 5-HT1A and 5-HT2 receptors and transport sites for serotonin. Brain Res 1993;615:87–94.
75. Whitton PS, Sarna GS, O’Connell MT, Curzon G. The effect of the novel antidepressant tianeptine on the concentration of 5-hydroxytryptamine in rat hippocampal dialysates in vivo. Neuropharmacology 1991;30:1–4.
76. Zhang H, Etherington LA, Hafner AS, Belelli D, et al. Regulation of AMPA receptor surface trafficking and synaptic plasticity by a cognitive enhancer and antidepressant molecule. Mol Psychiatry 2013;18:471–84.
77. Zhou L, Huang KX, Kecojevic A, Welsh AM, et al. Evidence that serotonin reuptake modulators increase the density of serotonin innervation in the forebrain. J Neurochem 2006;96:396–406.
Univ.-Prof. Dr. Walter E. Müller, Höhenstraße 49A, 67550 Worms, E-Mail: w.e.mueller@em.uni-frankfurt.de
Improvement of disturbed mechanisms of neuroplasticy as common final pathway of the mechanisms of action of antidepressant drugs – The specific role of tianeptine
The clinically used antidepressant drugs show large differences of the primary mechanisms of action which explains the different side effect profiles, but are rather similar in respect to the delayed onset of antidepressivant activity and the overall clinical efficacy. This led to the hypothesis that adaptive mechanisms downstream of the primary targets are relevant. While the initial assumption of adaptive changes of receptor densities and function as being relevant could not be proven, adaptive alterations of mechanisms of neuroplasticity seem to be relevant, especially since these mechanisms are altered by chronic stress as relevant risk factor of depression.
Tianeptine played an important role for the development of the neuroplasticity hypothesis as it has profound effects on all mechanisms of neuroplasticity (long-term potentiation, spine density, neuritogenesis, neurogenesis). While tianeptine also affects serotonergic neurotransmission by a rather atypical mechanism (enhanced serotonin uptake) its profound effects on neuroplasticity are also mediated by adaptive changes of glutamatergic transmission mainly by changes of AMPA-receptor availability.
Key words: Antidepressants, neuroplasticity, tianeptine, glutamatergic neurotransmission
Psychopharmakotherapie 2016; 23(06)
