Walter E. Müller, Anita Schuwald, Frankfurt, Michael Nöldner, Karlsruhe, Siegfried Kasper, Wien, und Kristina Friedland, Erlangen
Von der Aromatherapie zum wirksamen Arzneistoff
Lavendelöl wird seit mehreren tausend Jahren in der Medizin, aber auch als Kosmetikum eingesetzt [4], beispielsweise zu pharaonischen Zeiten als Konservierungsstoff zur Mumifizierung und im antiken Rom als Parfüm und Badezusatz, aber auch als Antiseptikum. In den folgenden Jahrhunderten war der medizinische Einsatz von Lavendelöl begrenzt, obwohl man ihm analgetische, antibakterielle, entzündungshemmende, muskelrelaxierende, sedierende, fungizide und andere Wirkungen zusprach. Keiner dieser Effekte war aber sehr prominent, sodass es in der moderneren Zeit als Arzneistoff kaum eine Rolle spielte, aber breite Anwendung aufgrund des angenehmen Dufts hatte. Als Parfüm war es die Duftnote unserer Urgroßmütter, aber auch heute wird es noch als Bestandteil vieler Parfümmischungen verwendet. In der neuesten Zeit hat es eine populäre Anwendung in der Aromatherapie gefunden, die allerdings auch schon auf antike Beispiele zurückgeht. Heute gibt es keinen Wellnessbereich, in dem nicht auch Lavendelöl seine typische Duftnote verbreitet. Das Gefühl von Wohlbefinden, „Wellness“, ist geradezu unzertrennlich mit Lavendelöl verbunden. Sehr viel schwieriger ist es, wenn man versucht, die zweifelsfrei vorhandenen „Wellness-vermittelnden“ Effekte des Lavendelöls zu analysieren. Natürlich spielen hier der angenehme Geruch und die sehr gut bekannte Regulation unseres Gemütszustands durch Gerüche eine wichtige Rolle. Auf der anderen Seite haben sich in den letzten Jahrzehnten vermehrt Hinweise ergeben, dass der Wohlbefinden-vermittelnde Effekt von Lavendelöl möglicherweise über die reine Duftkomponente hinausgeht. Dies geht unter anderem darauf zurück, dass die psychologische Forschung sich vermehrt mit dem Gefühl Wohlbefinden bzw. Wellness beschäftigt hat und versucht hat, hinter diesen unspezifischen Wahrnehmungen psychologische Domänen zu erfassen [60]. Hierbei wurde Wohlbefinden als ein psychologisches Konstrukt identifiziert, welches etliche persönlichkeitsbezogene Domänen wie Selbstakzeptanz, Sinn des Lebens sowie einige andere umfasst [43]. Demnach könnten Lavendelöl-induzierte Wahrnehmungen möglicherweise auf eine Besserung von negativem Befinden (ill-being) zurückzuführen sein, zumal in der psychologischen Literatur die oben erwähnten Gemütszustände deutliche Überschneidungen mit Angst und Anspannung im mehr medizinischen Sinn aufweisen [42–44]. Diese „Medizinialisierung“ des Begriffs Wellness ging dann mit einer ganzen Reihe von experimentellen Untersuchungen an Tieren einher, wo man zeigen konnte, dass das Einatmen von Lavendelöl tatsächlich angst- und spannungslösende Effekte hat (siehe Abschnitt „Verhaltenspharmakologie“). Dies hat dazu geführt, dass Aromatherapien auch bei neuro-psychiatrischen Erkrankungen untersucht wurden [39]. Allerdings hat man schon hier Hinweise erhalten, dass die reine Duftwirkung von Lavendelöl eher begrenzte Effekte zeigte, während beispielsweise die dermale Applikation von Lavendelöl bei einer Massage schon eher Effekte im Sinne von pharmakodynamischen Wirkungen aufwies und mit messbaren Plasmaspiegeln einherging [19]. Die Annahme einer solchen direkten pharmakodynamischen Wirkung wurde in den letzten Jahren durch eine Reihe von tierexperimentellen Untersuchungen bestätigt, die eine direkte anxiolytische Wirkung von Lavendelöl belegten.
Verhaltenspharmakologie: Anxiolyse über pharmakodynamische Effekte
Aus den vielen vorliegenden Daten sollen hier nur einige der wichtigsten Untersuchungen zu anxiolytischen Effekten von Lavendelöl zusammengefasst werden, wo Lavendelöl ursprünglich inhalativ, später aber auch systemisch (oral bzw. intraperitoneal) verabreicht wurde. Dies ist wichtig, da bei Versuchstieren der Lavendelgeruch eher als irritierend und unangenehm wahrgenommen wird. So konnten Takahashi et al. [54] zeigen, dass die Inhalation von Lavendelöl allein eher anxiogene Effekte zeigte, aber anxiolytische Wirkungen bei Tieren hatte, die Stress-induzierte Angst aufwiesen.
Sowohl das Open-Field-Modell, das Elevated-Plus-Maze, die Hell-Dunkel-Box als auch der Geller-Konflikt-Test wurden herangezogen, um anxiolytische Effekte des ätherischen Öls an unterschiedlichen Spezies mit differierenden Applikationsmethoden zu demonstrieren [55–59]. Im Open-Field-Modell, einem validierten und extensiv für die Untersuchung anxiolytischer Substanzen (z.B. Benzodiazepinen) verwendeten Verhaltensmodell, zeigten Ratten nach inhalativer Applikation in vier angstrelevanten Verhaltensparametern Wirkungen analog zum als Positivkontrolle geprüften Chlordiazepoxid [48].
Ebenfalls nach einstündiger inhalativer Präexposition bewirkte Linalool, einer der beiden Hauptinhaltsstoffe des Lavendelöls, einen positiven anxiolytischen Effekt in der Hell-Dunkel-Box an Mäusen, charakterisiert durch Zunahme der Verweildauer im hellen Kompartiment. Diese Befunde wurden durch vermindertes aggressives Verhalten (erhöhte Latenzzeit, verminderte Anzahl und Dauer von Attacken) sowie erhöhte soziale Interaktion (verstärktes Beschnüffeln und Fellpflege, Besteigen des Versuchspartners) bekräftigt [33]. Eine einmalige intraperitoneale Lavendelölapplikation 20 Minuten vor Versuchsbeginn resultierte in signifikant verbessertem Antikonflikt-Verhalten von Mäusen im Geller-Konflikt-Test [58]. Zuvor wurden die Tiere in einer entsprechenden Apparatur trainiert, wobei sie durch Hebelbetätigung in der fünfminütigen Sicherheitsphase Nahrung erhielten, während jedes 20. Drücken in der durch ein Warnsignal eingeleiteten ebenfalls fünf Minuten andauernden Alarmphase in einem Elektroschock resultierte. Lavendelöl-behandelte Mäuse zeigten konzentrationsabhängiges anxiolytisches Verhalten durch vermehrtes Betätigen des Nahrungshebels in der Alarmperiode, ähnlich wie nach der Verabreichung der Positivkontrolle Diazepam [58].
Die mongolische Rennmaus (Gerbil) ähnelt dem Menschen aus neuroendokrinologischer Sicht deutlich stärker als Ratten oder Mäuse und lässt somit besser übertragbare Befunde zu. Nach akuter Lavendelöl-Inhalation zeigten die Tiere milde Anxiolyse, die sich nach zweiwöchiger Applikation noch deutlicher ausprägte, charakterisiert durch gesteigertes exploratorisches und reduziertes gefährdungsvermeidendes Verhalten [5]. Weitere Befunde sprechen für eine stressreduzierende Wirkung von Lavendelöl. Das dafür verwendete Modell der Stressinduktion durch Ether-Inhalation resultierte in erhöhten ACTH(Adrenocorticotropes Hormon)- und erniedrigten Catecholamin-Spiegeln im Plasma. Ratten, die zweimal täglich für drei Tage einer inhalativen Linalool-Behandlung unterzogen wurden, zeigten nach Ether-Inhalation im Vergleich zur Kontrollgruppe signifikant geringere ACTH-Level und auf nahezu basale Werte normalisierte Dopamin-Spiegel [63]. Diese Beobachtungen unterstützen Befunde der Gruppe um Nakamura, die zeigen, dass Linalool-Inhalation die durch Stress induzierten Veränderungen der Expression Stress-relevanter Gene signifikant hemmt [35].
Shaw und Kollegen [48] konnten den zuvor beschriebenen Effekt von Lavendelöl nach einstündiger Inhalation (0,5 ml) auf das Verhalten im Open-Field-Modell reproduzieren, einhergehend mit Verminderung von Defäkation und Bewegungsunruhe, aber einer Verstärkung bezüglich exploratorischen Aufrichtens. Zusätzlich zu früheren Untersuchungen wurden postexperimentell Hirnschnitte der behandelten Tiere angefertigt und acht angstrelevante Hirnareale hinsichtlich ihrer c-fos-Expression nach histologischer Anfärbung analysiert. C-fos stellt einen frühen Marker neuronaler Aktivierung dar und gehört zu der Immediate early gene-Familie, deren Mitglieder schnell nach eingegangener Stimulation transkribiert werden und die Expression von Genen, die in schnellen situationsbezogenen Adaptationen involviert sind, kontrollieren. Analog zu früheren Befunden, resultierte die Exposition der Versuchstiere mit dem Open-Field in einem Anstieg der c-fos-Expression in allen acht untersuchten Hirnarealen. Während die Positivkontrolle Chlordiazepoxid diesen Anstieg in sieben Regionen aufhob, bewirkte die Behandlung mit Lavendelöl partielle Reversion der c-fos-Expression im Nucleus paraventricularis, sowie im Kerngebiet des dorsomedialen Hypothalamus. Im Gegensatz dazu erhöhten beide Substanzen die Expression des Transkriptionsfaktors im zentralen Kerngebiet der Amygdala. Obwohl beide anxiolytischen Agenzien nur sehr begrenzt ein ähnliches Muster bezüglich der Modulation der Expression des neuronalen Aktivitätsmarkers zeigten, spekulierten die Autoren, dass beide über einen ähnlichen, wahrscheinlich den GABAA-Rezeptor involvierenden Mechanismus wirken. In einer weiteren Untersuchung von Shaw et al. [47] konnten neurobiologische Effekte von inhalativem Lavendelöl auf Genexpressionsmuster bei Mäusen bestätigt werden. Die Spekulation einer Benzodiazepin-artigen Wirkung von Lavendelöl wäre vor dem Hintergrund der gut belegten und breiten anxiolytischen Wirkung der bei vielen Angstsyndromen einsetzbaren Benzodiazepine nicht uninteressant. Dies konnte allerdings nicht bestätigt werden, da zwei andere Publikationen relativ klar belegten, dass die anxiolytische Wirkung von Lavendelöl nicht über Benzodiazepin-Bindungsstellen bzw. sogar über den GABAA-Rezeptor vermittelt wird. In der Untersuchung von Chioca et al. [10] konnte Lavendelöl nicht an die Benzodiazepin-Bindungsstelle binden und die anxiolytische Wirkung von Lavendelöl konnte nicht durch Picrotoxin aufgehoben werden, das den durch den GABAA-Rezeptor aktivierten Chloridkanal blockiert und damit alle GABAA-Rezeptor-assoziierten möglichen Wirkungsmechanismen von Lavendelöl ausschließen kann. Interessanterweise konnte der anxiolytische Effekt von Lavendelöl durch einen Serotonin-1A-(5-HT1A)Rezeptorantagonisten aufgehoben werden, was zumindest indirekt für eine Beteiligung serotonerger Mechanismen an der anxiolytischen Wirkung spricht. Dies ist letztlich nicht überraschend, stellt aber einen indirekten Effekt dar, da Lavendelöl mit keinem der bekannten Mechanismen der serotonergen Synapse interagiert (unveröffentlichte Befunde aus unseren Laboren). Darüber hinaus konnte die Untersuchung von Cline et al. [11] keinen Effekt von Flumazenil auf die anxiolytische Wirkung von Linalool an der Ratte zeigen. Flumazenil antagonisiert die Benzodiazepin-Bindungsstelle am GABAA-Rezeptor-Komplex, sodass dieser Befund ein weiteres Indiz dafür ist, dass Lavendelöl nicht den gleichen neuronalen Wirkungsmechanismus wie die Benzodiazepine bedient.
Damit bleibt festzuhalten, dass, obwohl die anxiolytische Wirkung von Lavendelöl innerhalb des Spektrums anxiolytischer Substanzen eher Analogien zu den Benzodiazepinen als zu den spezifischen Serotonin-Wiederaufnahmehemmern zeigt, auf zellulärer Ebene der anxiolytische Effekt sicher nicht über den GABAA-Rezeptor vermittelt ist, sondern dass zumindest indirekt serotonerge Mechanismen eingebunden zu sein scheinen. Dies wird durch die Untersuchungen von Kehr et al. [28] bestätigt, die nach Gabe von Silexan eine Erhöhung der extrazellulären Serotoninkonzentration im frontalen Kortex der Ratte fanden.
Auch aktuelle Befunde von Baldinger et al. [3] zeigen eine Beeinflussung serotonerger Mechanismen durch Silexan. Analog zu spezifischen Serotonin-Wiederaufnahmehemmern führte die Gabe von Silexan über Wochen zu einer Reduktion der 5-HT1A-Rezeptordichte im menschlichen Gehirn.
Frühere Untersuchungen zu einem möglichen zellulären Wirkungsmechanismus
Auf der Suche nach einem möglichen molekularen Wirkungsmechanismus von Lavendelöl hat man zunächst überprüft, inwieweit GABAerge Mechanismen relevant sein können, sicher in Analogie zu den Benzodiazepinen, die als GABAerge Substanzen eine dominierende Rolle in der Therapie mit Anxiolytika spielen. Dies ließ sich allerdings nicht bestätigen, da Lavendelöl keinerlei Affinität zu wichtigen Targets innerhalb der GABAergen Synapse zeigte, wie den GABA-Rezeptor selbst und die Benzodiazepin-Bindungsstelle [10, 21]. Die von Huang et al. [21] beschriebene Bindung von Lavendelöl an die Chloridkanal-Bindungsstelle des GABAA-Rezeptors, an die auch Picrotoxin bindet, scheidet als Target aus, da Picrotoxin die anxiolytische Wirkung von Lavendelöl nicht aufheben konnte [10]. Darüber hinaus waren für die Bindung an die Chloridkanal-Bindungsstelle relativ hohe Lavendelölkonzentrationen notwendig (halbmaximale Bindung bei 300 µg/ml, was von den zu erwartenden In-vivo-Konzentrationen weit entfernt ist (siehe Absatz „Pharmakokinetik an Ratte und Mensch“). Auch die in der bereits erwähnten Arbeit von Huang et al. [21] und in einer Arbeit von Aoshima and Hamamoto [2] beschriebenen elektrophysiologischen Daten an GABAA-Rezeptoren wurden bei Konzentrationen erhoben, die nicht relevant sind, wobei im einen Fall eine GABA-Verstärkung, im anderen Fall eine GABAA-Hemmung gesehen wurde, was mit der Pharmakologie von Lavendelöl nicht vereinbar ist.
Während damit klassische serotonerge bzw. GABAerge Targets nicht zur Erklärung der anxiolytischen Effekte von Lavendelöl herangezogen werden konnten, hat man schon relativ früh mögliche Effekte auf glutamaterge Mechanismen untersucht. Dies ist darauf zurückzuführen, dass verschiedene experimentelle Substanzen, die im glutamatergen System angreifen, anxiolytische Effekte zumindest experimentell zeigen, während es im Spektrum der zur Verfügung stehenden Anxiolytika keine therapeutisch eingesetzten glutamatergen Substanzen gibt [17].
Im Gegensatz zu den zunächst genannten postulierten Wirkungen auf die inhibitorische GABA-Transmission richtete die Gruppe um Elisabetsky ihren Fokus auf das exzitatorische, glutamaterge System. An kortikalen Membranen der Ratte verdrängte Linalool konzentrationsabhängig und kompetitiv [3H]-Glutamat von seinen Bindungsstellen, den maximalen Effekt bei einer Konzentration von 6,5 mmol/l aufweisend. Dabei schien das Monoterpen unspezifisch alle exprimierten glutamatergen Rezeptoren zu beeinträchtigen, die ionotropen NMDA-, AMPA- und Kainat-Rezeptoren, aber auch metabotrope Quisqualat- und ACPD-sensitive Rezeptoren [16].
In weiteren Bindungsstudien verdrängte Linalool (0,3–5 mmol/l) nichtkompetitiv den NMDA-Antagonisten [3H]-MK801 von seiner Bindungsstelle am entsprechenden Rezeptor. Ausgehend von diesen Beobachtungen schlussfolgern die Autoren, dass Linalool möglicherweise durch seine Bindung am NMDA-Rezeptor dessen Öffnung verhindert, was in einer reduzierten [3H]-MK801-Interaktion resultieren würde, da MK801 an den Ionenkanal nur in seinem geöffneten Zustand bindet [51].
Als weitere Targets des Monoterpens im glutamatergen System konnten murine synaptosomale Glutamat-Reuptake-Prozesse (0,3–3 mmol/l) sowie Glutamat-Ausschüttung identifiziert werden. Linalool inhibierte die KCl-induzierte Glutamat-Freisetzung signifikant (1 und 3 mmol/l), ohne basale Level zu beeinflussen und wies inhibitorische Interferenz bezüglich der Wiederaufnahme des exzitatorischen Neurotransmitters auf [52].
Vor dem Hintergrund der zum Teil extrem hohen In-vitro-Konzentrationen, die auf der Suche nach einem möglichen Wirkungsmechanismus von Lavendelöl eingesetzt wurden, stellt sich die Frage, mit welchen Plasma- bzw. Gewebekonzentrationen man unter Bedingungen rechnen muss, bei denen Lavendelöl am Tier bzw. am Menschen nach inhalativer oder äußerer Anwendung pharmakologische Effekte zeigt. Die ältere Literatur zu dieser Frage ist begrenzt. Buchbauer et al. [7] konnten schon 1991 zeigen, dass bei inhalativer Anwendung von Lavendelöl unter Konzentrationsbedingungen, die zu einer eindeutigen Einschränkung der motorischen Aktivität von Mäusen führte, Linalool-Plasmakonzentrationen im Bereich von einigen ng/ml gesehen wurden. Höhere Konzentrationen wurden von der gleichen Gruppe ein Jahr später nach transdermaler Anwendung von Lavendelöl am Menschen festgestellt [19]. Auch hier wurden Plasmakonzentrationen im nanomolaren Bereich gefunden, die allerdings etwa 10-fach höher (also bis 100 ng/ml) unter Peak-Bedingungen lagen. Wenn auch diese Befunde zunächst nur episodisch sind, setzen sie doch eine gewisse Marke, in welchem Konzentrationsbereich man suchen muss, um pharmakologisch bzw. klinisch relevante Mechanismen zum Wirkungsmechanismus von Lavendelöl zu identifizieren. Die gerade beschriebenen Effekte auf GABAerge oder glutamaterge Mechanismen liegen viele Zehnerpotenzen über diesem Wert und erscheinen damit mit Sicherheit als nicht relevant. Dieser Aspekt wird im Absatz zur Pharmakologie von Silexan noch einmal ausführlich besprochen.
Anxiolytische Effekte am Menschen
Im Gegensatz zu der relativ breiten tierexperimentellen Literatur zu möglichen verhaltenspharmakologischen oder sogar anxiolytischen Effekten von Lavendelöl ist die ältere klinische Literatur sehr beschränkt. Die meisten in die breite Übersicht von Perry et al. [40] eingeschlossenen klinischen Untersuchungen (erfasst bis Ende 2010) beziehen sich auf inhalative oder kutane Anwendungen. Daher ist es schwer zu beurteilen, ob es sich tatsächlich um eine eigentliche pharmakodynamische Wirkung von Lavendelöl handelt oder nur um einen Geruchseffekt, also eine Aromatherapie-ähnliche Wirkung. Nur drei Arbeiten wurden erfasst, in denen Lavendelöl oral Patienten bzw. gesunden Probanden verabreicht wurde. Interessanterweise war die Dosierung in allen drei Untersuchungen im Bereich von 80 mg pro Tag. Zwei der Untersuchungen [22, 62] entstammen dem klinischen Entwicklungsprogramm zu Silexan und werden ausführlich in der Übersicht von Kasper et al. (2015 , dieses Heft) besprochen.
Die dritte Untersuchung von Bradley et al. [6] untersucht in einem Doppelblind-Design den Effekt von oralem Lavendelöl auf das Befinden von freiwilligen gesunden Probanden nach Exposition auf einem angstauslösenden Film. Die Dosen von 100 µl Öl bzw. 200 µl Öl pro Proband entsprechen in etwa den im Silexan-Entwicklungsprogramm eingesetzten Dosierungen von 80 bzw. 160 mg pro Tag und Patient. In diesen Untersuchungen wurden Effekte von Lavendelöl auf den Angstlevel (State Anxiety) der Probanden unter Kontrollbedingungen gesehen, bei einem geringen Effekt auf die deutlich höheren Angstsymptome nach Anschauen des eingesetzten Films. Lavendelöl bewirkte auch Veränderungen von autonomen Parametern, was von den Autoren auch als Ausdruck anxiolytischer Effekte gesehen wird. Die Autoren [6] interpretieren diesen Befund, dass Lavendelöl durchaus einen leichten anxiolytischen Effekt zeigt, der allerdings bei sehr ausgeprägter Angst, wie in diesem Experiment durch den Film bewirkt, nicht so deutlich zum Ausdruck kommt. Obwohl die Effekte relativ gering sind, geben sie einen Hinweis auf anxiolytische Effekte von Lavendelöl am Menschen. Einschränkend muss hier allerdings erwähnt werden, dass nur eine Einzelgabe eingesetzt wurde, was sicher vor dem Hintergrund des protrahierten Einsetzens einer anxiolytischen Wirkung bei Angstpatienten nicht ausreichend ist und möglicherweise auch die relativ geringen Effekte erklärt. Umso bemerkenswerter ist, dass trotz der Einmalgabe bereits anxiolytische Effekte erkennbar sind.
Eine Reduktion autonomer Aktivierungsparameter wurde auch für Linalool an gesunden Probanden nach transkutaner [20] bzw. nach oraler [30] Applikation gesehen. Bei der letzten Untersuchung hatte Linalool auch positive Effekte auf die Stimmung. Sehr ausgeprägte anxiolytische Effekte wurden im Rahmen des ausführlichen klinischen Entwicklungsprogramms für Silexan gesehen, wo Patienten mit subsyndromaler Angst behandelt wurden [22, 23, 26, 56], aber auch in zwei Studien an Patienten mit einer generalisierten Angsterkrankung [26, 27, 62].
Präklinische Entwicklung des standardisierten Lavendelöls Silexan als Anxiolytikum
Pharmazeutische Spezifikation
Die im Vorangegangenen referierten Daten lassen erkennen, dass Lavendelöl offensichtlich substanzielle angst- und spannungslösende Effekte hat, die nicht nur dem angenehmen Geruch bei der Anwendung als Aromatherapeutikum zuzuschreiben sind, sondern offensichtlich auch bei systemischer Applikation oral bzw. subkutan am Menschen oder oral bzw. intraperitoneal im Tierversuch darstellbar sind. Bei genauer methodischer Kontrolle waren hier schon sehr niedrige Konzentrationen bei systemischer Anwendung wirksam [6]. Linalool und Linalylacetat wurden als die primär anxiolytisch wirksamen Komponenten identifiziert. Auf der Basis dieser Erkenntnisse wurde die Substanz Silexan entwickelt, ein Lavendelöl, dessen gleichmäßige Zusammensetzung auch über verschiedene Ernten garantiert werden kann, mit sehr hohem Anteil an Linalool und Linalylacetat. Die phytochemische Charakterisierung von Silexan entspricht der Monographie Lavendelöl des europäischen Arzneibuchs, wobei die Gehalte von bestimmten Komponenten einer engeren Spezifikation unterliegen. Durch das Einatmen von Lavendelöl wurden bessere anxiolytische Effekte erzielt als durch analoge Konzentrationen der einzelnen Komponenten, was nicht nur über pharmakokinetische Effekte erklärt werden konnte [53]. Diese mögliche Synergie von Einzelkomponenten auf pharmakodynamischer Ebene wird noch durch pharmakokinetische Befunde an der Ratte unterstützt, wo die orale Bioverfügbarkeit von Linalool bei Gabe der beiden einzelnen Komponenten geringer war als bei Gabe von Silexan [36].
Verhaltenspharmakologie
Die Wirksamkeit von Silexan in verschiedenen verhaltenspharmakologischen Modellen, die in Beziehung zu angst- bzw. spannungslösenden Effekten, Sedierung und motorischer Aktivität stehen, wurde ausführlich von Kumar [29] beschrieben. Eingesetzt wurden hier Ratten, die über sieben Tage mit Silexan in Tagesdosen von 3, 10 bzw. 30 mg/kg intraperitoneal behandelt wurden, also mit relativ niedrigen Dosierungen. Als Vergleichssubstanzen dienten je nach Test entweder Lorazepam 5 mg/kg oder Diazepam 3 mg/kg. In fast allen Modellen wurden mit 3 mg/kg Silexan halbmaximale Effekte erreicht, bei 10 mg/kg etwa 70 bis 80% des Maximaleffekts und 30 mg/kg waren praktisch immer so wirksam wie der Vergleich Lorazepam bzw. Diazepam (Abb. 1).
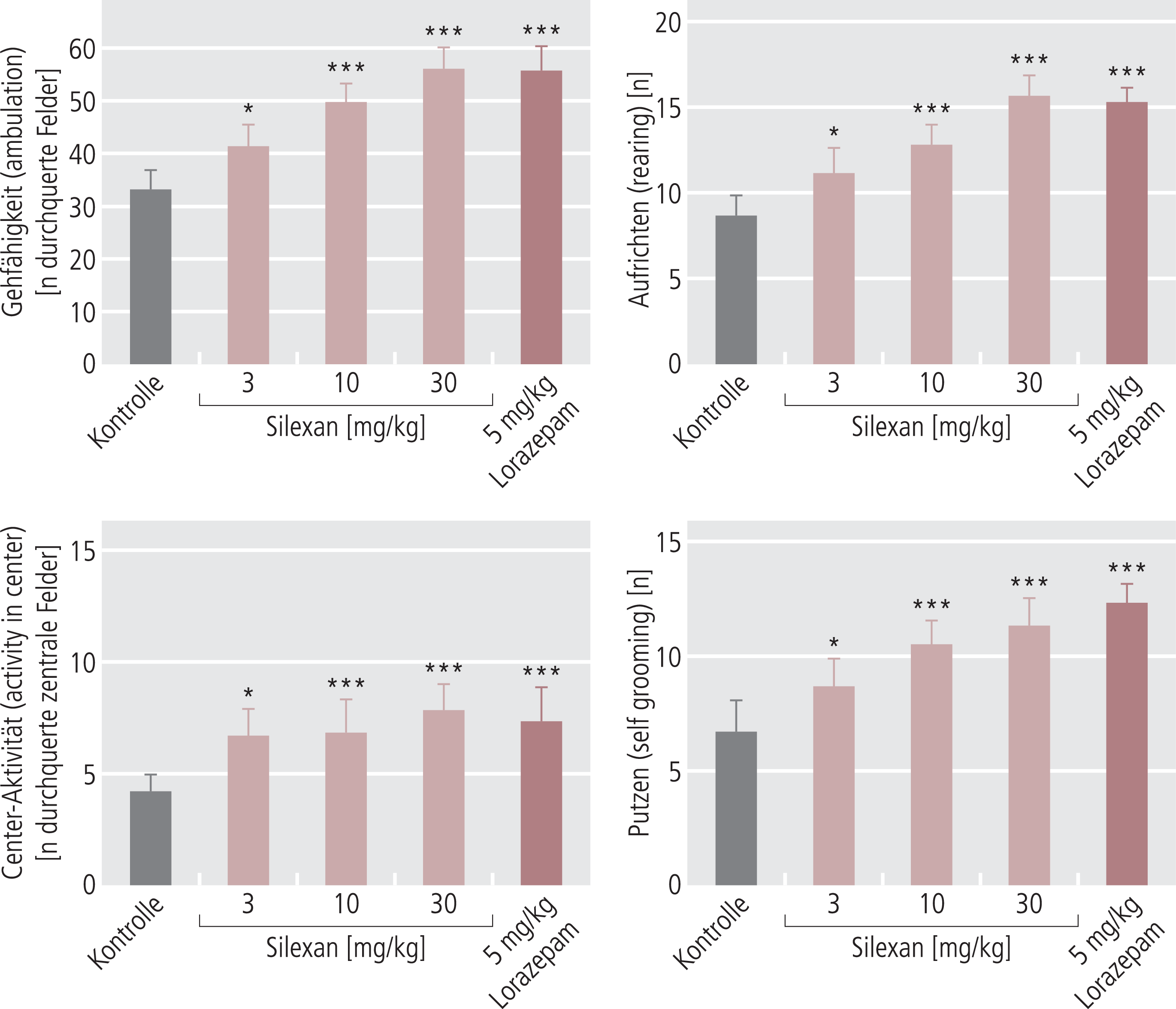
Abb. 1. Anxiolytische Effekte von Silexan (i.p. über 7 Tage) auf das Verhalten von Ratten in neuer Umgebung im Vergleich zu Lorazepam [nach 29]. Dargestellt sind die beobachteten Verhaltensweisen während 5 min im „Open Field“ (61×61 cm, 16 Quadrate). Ähnlich zu Lorazepam äußert sich der anxiolytische Effekt von Silexan in einer Zunahme der allgemeinen Bewegung im Feld, des Aufrichtens, des Putzverhaltens und der Bewegung zur Feldmitte (ängstliche Tiere halten sich am Rand des Feldes auf). Die Daten sind Mittelwerte ± SEM von jeweils 4 Tieren. *p<0,05, *** p<0,001 im Vergleich zu den Kontrollen.
Beim Explorationsverhalten im offenen Feld zeigte Silexan ähnlich wie Lorazepam Verhaltensweisen, die auf reduzierte Angst vor der neuen Umgebung zurückzuführen sind, wie ein vermehrtes Hin- und Herlaufen, ein vermehrtes Aufrichten (in der Regel zum Schnuppern), vermehrtes Putzverhalten und eine Reduktion des Fäkalverhaltens. Im sehr typischen Angstmodell des erhöhten kreuzförmigen Labyrinths (Elevated-Plus-Maze-Test) wurde die Zeit im umschlossenen Arm, den die Tiere aufgrund der größeren Sicherheit zunächst anlaufen, deutlich reduziert, während die Zeit auf den offenen Bereichen des Balkens im Sinne einer Angstminderung deutlich erhöht war. Die Anzahl der Bewegungen in die jeweiligen Teile des Balkens verhielt sich analog. Ähnlich war es auch im Elevated-Zero-Maze-Test, wo die Zeit in den offenen Bereichen sowie die Zeit bis zum Eintritt in den offenen Bereich zunahmen. Im „Social Interaction Test“, bei dem zwei Ratten zum ersten Mal zusammengesetzt werden, wurde ebenfalls typisches angstreduziertes Verhalten gesehen, indem die Anzahl der Interaktionen zwischen den beiden Tieren wieder analog zu Lorazepam zunahm.
Alle Tests sind typisch für Anxiolytika vom Benzodiazepin-Typ, die sich hier als besonders wirksam erwiesen und wo die analoge Wirksamkeit von Silexan in niedrigen Dosierungen auf ein ebenso gutes anxiolytisches Potenzial hinweist. Das Gleiche gilt für den Test, mit dem überprüft wird, wie lange es dauert, bis eine Ratte nach Einsetzen in eine neue Umgebung so viel Angst und Spannung abgebaut hat, dass sie wieder anfängt zu fressen (novelty suppressed feeding). Auch hier war Silexan ähnlich wirksam wie die Vergleichssubstanz Lorazepam. Silexan war nicht wirksam auf Lokomotoraktivität, wo die Bewegung der Tiere mithilfe eines Photosignals erfasst wurde. Selbst bei 30 mg/kg reduzierte Silexan dieses Bewegungsverhalten nicht, im Gegensatz zur Vergleichssubstanz Diazepam, die hier eine deutliche Reduktion als Ausdruck einer primären Sedierung zeigte. Auch auf dem Drehstab (rota rod), als Ausdruck von eingeschränkter Koordinationsfähigkeit und gegebenenfalls zentral ausgelöster Muskelrelaxation, war Silexan nicht wirksam, selbst bei der hohen Dosierung von 30 mg/kg, wohingegen Diazepam zu einer hoch signifikanten Reduktion der Zeit führte, bis die Tiere sich nicht mehr halten konnten und vom Drehstab herunterfielen.
Im Gegensatz zu diesen Effekten, bei denen Silexan im Vergleich zu Benzodiazepinen keinen Hinweis auf Sedierung und möglicherweise damit verbundene Koordinationsproblematik bzw. Muskelrelaxation zeigte, war Silexan ähnlich wie Diazepam in der Verlängerung der Pentobarbital-induzierten Schlafzeit wirksam, mit einer hoch signifikanten Reduktion der Zeit bis zum Eintritt des Schlafes (Latenz), aber auch einer deutlichen Verlängerung der Zeit, die die Tiere im Schlaf verbringen [29]. Damit führt Silexan zwar zu einer Verstärkung der Schlaf-induzierenden Wirkung von anderen sedierenden Substanzen wie Pentobarbital, scheint aber keine intrinsische sedierende bzw. Schlaf-anstoßende Wirkung zu haben, ein Effekt der auch in anderen Untersuchungen bestätigt wird (siehe unten) und der auch für die fehlenden sedierenden unerwünschten Arzneimittelwirkungen von Silexan am Patienten offensichtlich die Erklärung bietet.
Auch in unseren Untersuchungen an Mäusen [45] wurde nach oraler Applikation ein ähnliches verhaltenspharmakologisches Profil im offenen Feld gesehen wie in der Arbeit von Kumar mit Ratten (Abb. 1). Ebenso zeigte Silexan einen sehr deutlichen Effekt im „Elevated Plus Maze“, wo in diesem Fall bei einer Dosierung von 3 mg/kg für drei Tage schon maximale Effekte erreicht waren, die absolut den Effekten entsprachen, die die Vergleichssubstanzen Diazepam (2,5 mg/kg) und Pregabalin (100 mg/kg) erreichten (Abb. 2). Auch im Hinblick auf die Pentobarbital-Schlafzeit wurden ähnliche Effekte wie an der Ratte gesehen, wo Silexan dosisabhängig einen sehr deutlichen Effekt im Sinne einer Verlängerung der Schlafzeit zeigte, der bei 10 mg/kg oral für neun Tage in etwa das Ausmaß der Vergleichssubstanz Pregabalin (100 mg/kg für 9 Tage) erreichte. Trotz dieses Effekts auf die hypnotische Wirkung von Pentobarbital hat Silexan keine primär sedativ-hypnotischen Eigenschaften, was auch die oben erwähnten Effekte im „open field“ gezeigt haben [45].
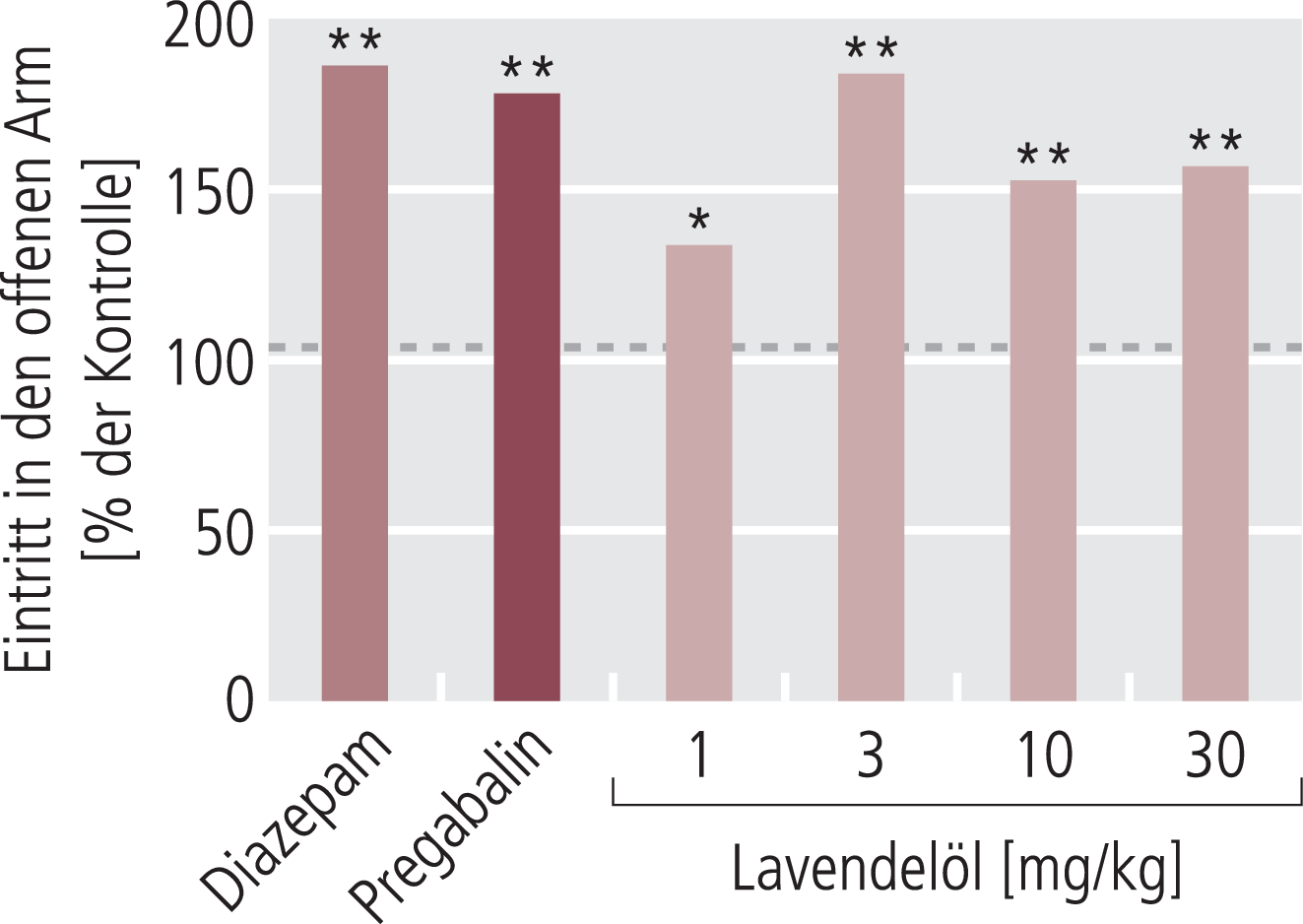
Abb. 2. Lavendelöl (Silexan) zeigt angstlösende Wirkung bei Mäusen im Elevated Plus Maze nach oraler Gabe von 1–30 mg/kg für drei Tage [nach 45]. Diese Effekte waren identisch ausgeprägt wie bei Diazepam (2,5 mg/kg) oder Pregabalin (100 mg/kg). Neben der Häufigkeit des Betretens des offenen Arms (Abb.) verlängert Silexan wieder identisch zu beiden Vergleichssubstanzen die Zeit, die die Tiere insgesamt auf dem offenen Arm verbrachten (nicht gezeigt). *p<0,05 im Vergleich zu den jeweiligen Kontrollen, **p<0,01 (100%-Wert)
In zwei Phase-I-Studien wurde die Verträglichkeit von Silexan in einer Einzeldosierung von 80 bis 640 mg bzw. in einer 14-tägigen Studie in Dosierungen von 160 bzw. 320 mg pro Tag untersucht. Hinweise auf Müdigkeit und Sedierung wurden in beiden Studien in den Silexan-Gruppen nicht häufiger als in den Placebo-Gruppen gefunden [13, 14]. In einer präliminären Untersuchung an Patienten mit einer primären Insomnie (DSM-IV) wurde an insgesamt 34 männlichen und weiblichen Patienten Silexan in einer Einzeldosierung von 80 mg pro Tag gegen Placebo über eine Behandlungszeit von 14 Tagen bzw. 14 Nächten geprüft. Weder subjektive (Schlafeffizienz) noch objektive (Schlaf-EEG) Auswertungen ergaben einen signifikanten Effekt von Silexan auf die vorliegenden Schlafstörungen [12]. Diese Untersuchungen bestätigen letztlich die Hinweise aus der Verhaltenspharmakologie, dass trotz des sicheren Befunds eine Verlängerung der Barbiturat-Schlafzeit an Ratten und Mäusen Silexan keine relevanten primär sedativ-hypnotischen Eigenschaften besitzt. Die bei den klinischen Prüfungen an Angstpatienten häufig gesehenen positiven Effekte auf den gestörten Schlaf [26] sind damit Ausdruck der anxiolytischen Wirkung. Ähnliches kennt man von den SSRI, die auch ohne eigene primär sedativ-hypnotische Eigenschaften den im Rahmen der affektiven Erkrankung (Angst, Depression) gestörten Schlaf verbessern.
Pharmakokinetik an Ratte und Mensch
Die Pharmakokinetik von Silexan wurde an der Ratte nach oraler Einmaldosierung bzw. 14-tägiger Mehrfachdosierung von 100 mg/kg oral untersucht. Nach einmaliger Gabe wurden Peak-Konzentrationen des Inhaltsstoffs Linalool innerhalb von weniger als einer halben Stunde im Plasma, Gehirn, Leber und Niere gesehen, während maximale Konzentrationen im Fettgewebe erst nach vier Stunden erreicht wurden. Dies gilt für die Einfachdosierung, aber auch für die 14-tägige Dosierung. Während die Hirnkonzentration etwa 100% (Einmaldosierung) bzw. 50% (Mehrfachdosierung) höher war als die jeweilige Plasmakonzentration, waren die Konzentrationen von Linalool in der Leber, in der Niere und im Fettgewebe um ein Vielfaches höher als im Plasma (Tab. 1). Linalylacetat erreicht bei substanziellen Linalool-Konzentrationen, ungeachtet der Applikationszeit, nur sehr niedrige Gewebe- und Plasmakonzentrationen, was die Erwartung eines schnellen Metabolismus des Linalylacetats zum Linalool bestätigt. Die relative Bioverfügbarkeit von Linalool und Linalylacetat war bei Verabreichung von Silexan höher als im Falle einer Verabreichung der gleichen Menge Linalool bzw. Linalylacetat-Reinsubstanz [36, 37]. Die Spitzenkonzentration von Linalool im Plasma und Gehirn nach Einmaldosierung bzw. Mehrfachdosierung bewegten sich im Bereich zwischen 100 und 200 ng/ml bzw. ng/g. Unter der Annahme einer linearen Kinetik wäre das bei der pharmakologisch relevanten Dosierung von 10 mg/kg ein Wert zwischen 10 und 20 ng/ml. Umgerechnet ergäbe das für das Linalool eine Plasma- bzw. Gewebekonzentration von etwa 65 bis 130 nmol/l bzw. nmol/kg.
Tab. 1. Verteilung von Silexan in der Ratte nach einmaliger oder 14-tägiger Applikation
|
Maximale Gewebekonzentration (Cmax) |
||||
|
Einmalgabe |
Mehrfachdosierung |
|||
|
Linalool |
Linalylacetat |
Linalool |
Linalylacetat |
|
|
Plasma |
77 |
n. d. |
108 |
n. d. |
|
Gehirn |
164 |
31 |
140 |
48 |
|
Leber |
278 |
n. d. |
2095 |
25 |
|
Niere |
670 |
n. d. |
1547 |
12 |
|
Fettgewebe |
2085 |
n. d. |
3958 |
117 |
Die Tiere wurden einmal oder täglich über 14 Tage mit 100 mg/kg Silexan oral behandelt. Gewebekonzentrationen von Linalool oder Linalylacetat wurden mittels GC-MS bestimmt [36, 37]. Die Zeit bis Cmax (tmax) war fast immer mit 0,25 Stunden sehr kurz, nur beim Fettgewebe für beide Substanzen mit etwa 4 Stunden deutlich länger. n.d.: nicht nachweisbar (not detectable)
Die Pharmakokinetik von Silexan wurde auch am Menschen (männliche und weibliche gesunde Probanden) nach einer oralen Einzeldosierung zwischen 80 und 640 mg bzw. nach 14-tägiger Applikation von 160 bzw. 320 mg untersucht. Die Zeit bis zum Erreichen des Plasma-Peaks (tmax), die maximale Plasmakonzentration (Cmax) und die ermittelten Eliminationshalbwertszeiten (t1/2) sind in Tabelle 2 zusammengefasst. Auch am Menschen ist mit tmax-Werten von etwa einer Stunde die Resorption von Silexan sehr schnell. Mit einer mittleren Eliminationshalbwertszeit von ein bis zwei Stunden im therapeutischen Dosisbereich wird die Substanz auch relativ schnell aus dem Plasma eliminiert. Linalylacetat wurde nach Einmalapplikation so gut wie nicht, nach Mehrfachapplikation nur in relativ niedrigen Konzentrationen am Menschen nachgewiesen, was auch hier für eine schnelle Metabolisierung zu Linalool spricht. Die Pharmakokinetik nach Mehrfachdosierung ist im unteren Bereich (80 bis 160 mg) nicht linear, war dann aber linear mit höheren Dosen. Von besonderer Bedeutung sind die maximalen Plasmakonzentrationen (Cmax-Werte), die nach Einmalgabe von 80 mg (also der therapeutischen Dosierung) Werte von 22 ng/ml und nach Mehrfachdosierung von 160 mg (Dosierung bei einer der beiden GAD-Studien) [27] Werte von 131 ng/ml erreichten. Gehen wir auch hier von ähnlichen Gehirnkonzentrationen (Plasma versus Gehirn) bei Mensch und Ratte aus, kann man in einer ersten groben Abschätzung auch am Menschen unter therapeutischen Bedingungen von Gehirnkonzentrationen von Linalool nach oraler Gabe von 80 bzw. 160 mg von Silexan im Bereich von 150 bis 850 nmol/l bzw. nmol/kg ausgehen.
Tab. 2. Pharmakokinetik von Linalool am Menschen nach oraler Einnahme von Silexan
|
Silexan |
|
|
Dosis (Applikation; |
Cmax [ng/ml] (CV [%]) |
|
80 mg (einmal; n=6) |
22 (131) |
|
160 mg (einmal; n=6) |
97 (38) |
|
320 mg (einmal; n=6) |
241 (124) |
|
480 mg (einmal; n=6) |
406 (47) |
|
640 mg (einmal; n=6) |
481 (104) |
|
160 mg (einmal/14 Tage; n=9) |
82 (71)/131 (58) |
|
320 mg (einmal/14 Tage; n=9) |
182 (77)/231 (66) |
Maximale Plasmaspiegel von Linalool nach oraler Einfach- oder Mehrfachdosierung von Silexan in unterschiedlichen Dosierungen an gesunden Probanden (geometrische Mittelwerte [ng/ml] und Variationskoeffizienten [CV, in %]). Bei der therapeutisch verwendeten Dosierung von 80 mg wurden nach Einmaldosierung tmax-Werte (Zeit bis zum Erreichen der maximalen Konzentration) von etwa einer Stunde und Eliminationshalbwertszeiten von etwa einer Stunde gefunden, bei 160 mg (Dosis bei einer der GAD-Studien) betrug die t1/2 zwei Stunden [13, 14].
Die Suche nach dem Wirkungsmechanismus
Als wir vor einigen Jahren begannen, nach einem Mechanismus der angstlösenden Wirkung von Silexan zu suchen, waren einige Vorgaben zu beachten. Zum einen musste der Wirkungsmechanismus bzw. das Target die anxiolytischen Wirkungen von Silexan erklären und gegebenenfalls auch verdeutlichen können, inwieweit Ähnlichkeiten und Unterschiede zu anderen Anxiolytika bestehen. Darüber hinaus sollten Linalool und Linalylacetat als wesentliche Inhaltsstoffe ähnliche Effekte am Target haben. Dessen ungeachtet sollte, welches Target sich auch immer herauskristallisierte, die Targetaffinität von Linalool und Linalylacetat sehr hoch sein, da Plasma- bzw. Hirnkonzentrationen deutlich unter einem µg/ml bzw. berechnet für Linalool oder Linalylacetat im Bereich unter 500 nmol/l liegen. Die schon vorhandenen Befunde gaben zwar Hinweise auf eine mögliche Beteiligung glutamaterger bzw. GABAerger Mechanismen, konnten aber klar ausgeschlossen werden, da hier Konzentrationen zwischen 100 und 1000 µmol/l eingesetzt wurden, also viel zu hohe Konzentrationen vor dem Hintergrund der bekannten Plasmakonzentrationen. Etwas niedrigere Konzentrationen benötigten gewisse Effekte an GABAergen Strukturen, ohne dass allerdings die beschriebene Targetaffinität überzeugend war. Darüber hinaus fehlten typische Effekte, die man von GABAergen Substanzen erwarten würde, wie ausgeprägte Sedierung und antikonvulsive, gegebenenfalls auch muskelrelaxierende Effekte. Damit fiel von den Wirkungsmechanismen bekannter, in die Therapie eingeführter anxiolytischer Substanzen (Abb. 3) die GABAerge Neurotransmission, wie sie bei den Benzodiazepinen auftritt, weg. Auch die Targets der zur Anxiolyse eingesetzten Antidepressiva bzw. von Buspiron konnten in unseren Vorversuchen ausgeschlossen werden, da Silexan nicht an diese Targets bindet. Auf der anderen Seite war aber auffallend, dass Silexan in klassischen pharmakologischen Angstmodellen, beispielsweise dem „elevated plus maze“, sehr gut wirksam ist, was analog für Benzodiazepine aber auch für Pregabalin gilt. SSRI als wichtige anxiolytische Substanzgruppe sind in diesem Modell eher schlecht wirksam. Wichtige Unterschiede zu den Benzodiazepinen zeigt auch die Untersuchung von Silenieks et al. [49], wo mit Silexan keine Kreuzreaktivität mit Benzodiazepinen in einem Selbstapplikationsparadigma gesehen wurde, ein Hinweis auf fehlende Substitution bei Benzodiazepin-Missbrauch [49].
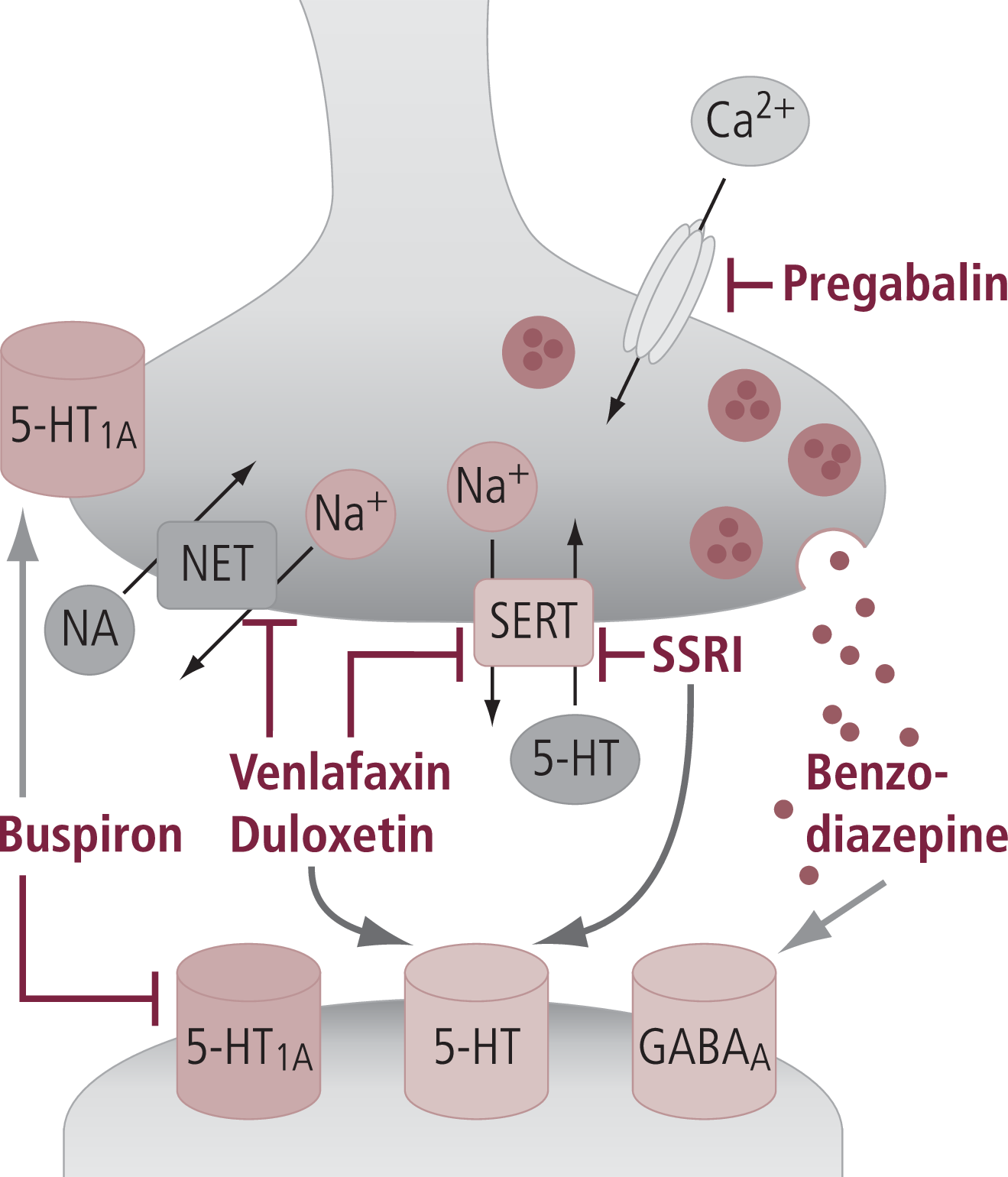
Abb. 3. Schematische Darstellung der molekularen Targets klinisch eingeführter Anxiolytika. Benzodiazepine führen über eine Aktivierung von GABAergen Signalen am GABAA-Rezeptor zu einer postsynaptischen Hyperpolarisation, SSRI blockieren den Serotonintransporter (SERT), Venlafaxin und Duloxetin neben dem SERT auch den Noradrenalintransporter (NET). Buspiron wirkt an 5-HT1A-Rezeptoren und Pregabalin inhibiert präsynaptische Calciumkanäle, die für die Transmitterfreisetzung wichtig sind. GABA: Gamma-Aminobuttersäure; 5-HT: Serotonin; NA: Noradrenalin
Da GABAerge Mechanismen ausgeschlossen werden konnten, haben wir die Frage gestellt, ob im Wirkungsmechanismus von Silexan gegebenenfalls Analogien zu Pregabalin bestehen, wenn auch eine wichtige Zweitwirkung des Pregabalins, die ausgeprägte Sedierung, bei Silexan nicht vorhanden war. Als Modell wurden initial isolierte freie Nervenendigungen (Synaptosomen) des Mausgehirns gewählt und es konnte gezeigt werden, dass Silexan, ähnlich wie Pregabalin, den über eine Depolarisation (Kaliumchlorid) ausgelösten Calciumeinstrom in die Synaptosomen hemmt [45]. Dieser ist wichtig, damit Vesikel mit der Membran fusionieren können und der Neurotransmitter freigesetzt wird. Der Befund einer Hemmung des Depolarisations-induzierten Calcium-Einstroms konnte auch an primären Neuronen (Kortex bzw. Hippocampus) der Ratte für Silexan bestätigt werden, wieder in Analogie zu Pregabalin (Abb. 4). Wichtig war, dass in beiden Fällen Silexan sehr potent war und schon deutliche Effekte in beiden Modellen bei 100 ng/ml gesehen wurden, also in einem Konzentrationsbereich der durchaus kompatibel ist mit den pharmakokinetischen Plasma- bzw. Gewebekonzentrationen (siehe Abschnitt Pharmakokinetik an Ratte und Mensch). Wichtig war auch, dass die beiden primären anxiolytischen Inhaltsstoffe (Linalool und Linalylacetat) diesen Effekt identisch und in nanomolaren Konzentrationen zeigten [45]. Wieder in gewisser Analogie zu Pregabalin, das den Depolarisation-induzierten Calciumeinstrom an Synaptosomen etwa zu 25 bis 30% inhibieren kann, war der Silexan-Effekt im Ausmaß gering und erreichte sogar nur etwa 20 bis 25% Hemmung. Allerdings war der Effekt in den Primärneuronen deutlicher, wieder in Analogie zu Pregabalin (Abb. 4). Nachdem wir initial gewisse Ähnlichkeiten im Wirkungsmechanismus zu Pregabalin sahen, wurde durch unsere folgende Untersuchung sehr schnell klar, dass Silexan keinesfalls ein pflanzliches Pregabalin ist, da das sehr gut charakterisierte molekulare Target von Pregabalin (Bindung an eine extrazelluläre Untereinheit der präsynaptischen Calciumkanäle) nicht involviert war, wie wir es durch fehlende Hemmeffekte von Silexan auf die Bindung von Tritium-markiertem Gabapentin an diese Bindungsstelle (die sogenannte Alpha2-delta-Untereinheit) zeigen konnten. Damit hatten wir zwar funktionell ähnliche Effekte aber keine Übereinstimmung im molekularen Target [45].
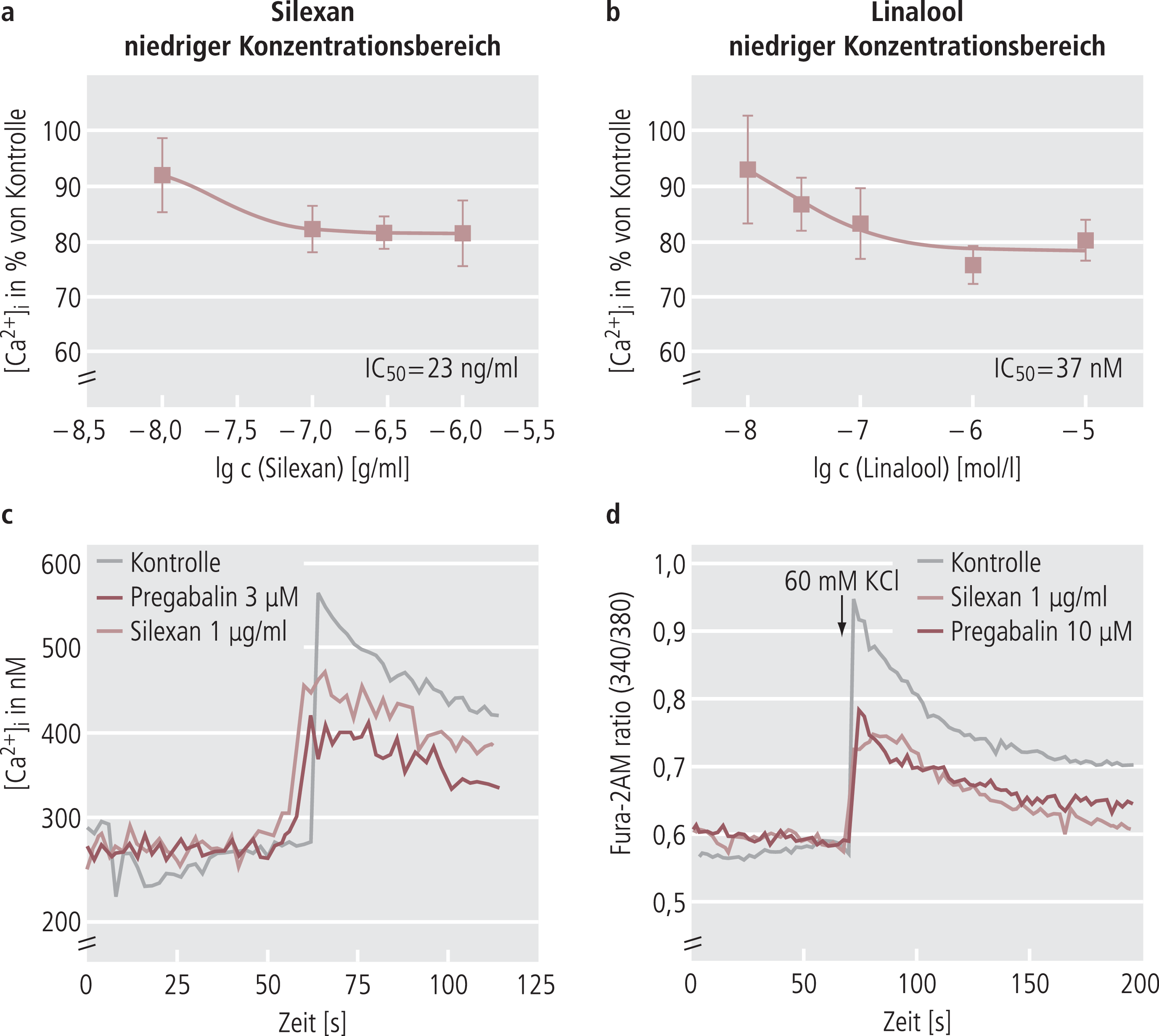
Abb. 4. Elektrophysiologische Charakterisierung der Wirkung von Silexan an neuronalen Strukturen. Effekte von unterschiedlichen Konzentrationen von Silexan (a) und Linalool (b) auf den KCl-induzierten (80 mmol/l) Calciumeinstrom in murinen Synaptosomen. (c) zeigt repräsentative Transienten der intrazellulären Calciumerhöhung (Messung in murinen Synaptosomen). (d) zeigt repräsentative Diagramme der intrazellulären Calciummessung in primären hippocampalen Neuronen, nach KCl-Depolarisation, vorinkubiert entweder mit 1 µg/ml Silexan, 10 µmol/l Pregabalin oder 0,1% DMSO als Kontrolle. Fehlerbalken zeigen SEM (n=10–12). IC50 : geschätzte halbmaximale Konzentration für den wirksamen Bereich [nach 45].
Da Linalool und Linalylacetat sehr lipophile Verbindungen sind, haben wir überprüft, ob möglicherweise unspezifische Membraneffekte die hemmende Wirkung auf die Calciumkanäle auslösen könnten. Das bestätigte sich nicht. Darüber hinaus konnten verschiedene Linalool und Linalylacetat ähnliche, auch sehr lipophile Terpenverbindungen den Effekt auf den Calciumeinstrom nach Depolarisation nicht zeigen [45].
Innerhalb der Klasse der präsynaptischen spannungsabhängigen Calciumkanäle interferiert Pregabalin hauptsächlich mit den P/Q-Kanälen, die besonders die Alpha2-Delta-Untereinheit exprimieren. Um hier zu überprüfen inwieweit Silexan an die Kanäle selbst bindet, haben wir in Zusammenarbeit mit der Gruppe von Prof. Klugbauer in Freiburg den Effekt von Silexan auf spezifisch in verschiedenen Zellmodellen exprimierte präsynaptische Calciumkanäle mithilfe von Patch-Klemm-Experimenten untersucht. Hier konnte gezeigt werden, dass der Effekt von Silexan nicht spezifisch für P/Q-Kanäle ist, sondern gleichermaßen auch an den N- und den T-Kanälen zu finden ist. An jedem dieser Kanaltypen zeigte Silexan in relevanten Konzentrationen etwa 15% Hemmung, was relativ gering ist. In der Summe unterscheidet sich der Effekt nicht so stark von dem des Pregabalins, da vermutlich in der gesamten Hemmwirkung auf die Calciumantwort alle drei Kanäle synergistisch bedient werden. Pregabalin wirkt hauptsächlich über die mit der Alpha2-Delta-Untereinheit assoziierten P/Q-Kanäle. Da eine Reduktion des präsynaptischen depolarisierten Calciumeinstroms klar als anxiolytischer Wirkungsmechanismus (Pregabalin) charakterisiert ist, geben die Befunde eine hohe Plausibilität, dass die analogen Effekte von Silexan wesentlich an den anxiolytischen Effekten beteiligt sind, zumal hier auch die niedrigen Plasma- bzw. Gewebekonzentrationen, wie sie unter therapeutischen Bedingungen erreicht werden, ausreichend zu sein scheinen, um diese Targets zu bedienen. Neben einer gewissen Analogie sind aber doch sehr deutliche Unterschiede zu Pregabalin zu sehen, sodass es durchaus auf der Basis der präklinischen Daten plausibel erscheint, dass von den ausgeprägten anxiolytischen sedierenden und antikonvulsiven Effekten von Pregabalin im Falle des Silexans nur die anxiolytische Komponente dominiert. Wichtige Unterschiede sind hier die Kanalselektivität (primär P/Q bei Pregabalin), aber ähnliche Effekte an P/Q-, N- und T-Kanälen und der Modus der Hemmung, da nur Silexan direkt alle rekombinanten, in Zellen exprimierten Kanäle hemmte, Pregabalin in diesem elektrophysiologischen Experimenten aber nicht wirksam war. Die von Kehr et al. [28] beschriebene Erhöhung der extraneuronalen Serotoninkonzentration unter Silexan im präfrontalen Kortex von Ratten ist sicher keine direkte Wirkung der Reduktion der Aktivität spannungsabhängiger Calciumkanäle, sondern Ausdruck einer indirekten Modulation serotonerger Mechanismen durch Silexan. Präfrontale Konzentrationen von Serotonin und Dopamin unterliegen bekannterweise vielen lokalen, aber auch vielen über Verschaltungsprozesse laufenden Regulationsmechanismen [31]. Auch unterliegen die serotonergen Raphe-Neuronen einer inhibitorischen GABAergen Kontrolle, deren Abschwächung zu einer erhöhten Serotoninfreisetzung führen konnte [8].
Auch antidepressive Eigenschaften?
Silexan bzw. Linalool zeigen noch einen weiteren deutlichen Unterschied zu Pregabalin. Silexan hat deutliche Effekte im forcierten Schwimmtest (Porsolt-Test) [18, 38, 46], ein Effekt, den Pregabalin nicht zeigt [61], wie wir auch in unseren Untersuchungen bestätigen konnten (Abb. 5). Wirksamkeit im Porsolt-Test gilt als prädiktiv für antidepressive Wirkung am Menschen mit nur sehr wenigen falsch-positiven oder falsch-negativen Substanzen. Wenn es auch keine Studie für Silexan bei depressiven Patienten gibt, so zeigt zumindest eine Metaanalyse klinischer Studien an Angstpatienten mit deutlichen depressiven Symptomen, dass eine signifikante stärkere Reduktion der Depressivität unter Silexan als unter Placebo erreicht werden konnte [24].
Damit ist Silexan zunächst einmal kein Antidepressivum, wenngleich Ergebnisse einer älteren Studie an depressiven Patienten mit einer Lavendel-Tinktur darauf hindeuten [1], es scheint aber doch gewisse antidepressive Eigenschaften zu haben. Hier stellt sich die Frage nach einem möglichen Wirkungsmechanismus. Hemmung des präsynaptischen Calciumeinstroms scheidet aus, da das hier wirksame Pregabalin nicht im Porsolt-Test wirksam ist (Abb. 5). Bei praktisch allen klinisch eingesetzten Antidepressiva geht man schon seit Jahren davon aus, dass die unter subchronischen Bedingungen zu sehenden neurotrophen Effekte wahrscheinlich von großer Bedeutung bei der Ausbildung der antidepressiven Effekte am Patienten sind [9, 41]. Nachdem eine Aktivierung der Neurogenese (Neusynthese von Nervenzellen) inzwischen eher kritisch gesehen wird und zumindest nicht als alleinige Erklärung herangezogen werden kann, geht man heute davon aus, dass verbesserte Ausbildung von Neuriten (Nervenendigungen) bzw. von Spines (postsynaptische Strukturen der Synapse) deutlich zur Antidepressiva-Wirkung beitragen [9, 41]. Hier haben wir in jüngerer Zeit eine Reihe von Untersuchungen durchgeführt und konnten tatsächlich bestätigen, dass Silexan wiederum in Konzentrationen deutlich unter 1 µg/ml nicht nur die Neuritogenese, das heißt das Wachstum von Neuriten in entsprechenden Zellmodellen verbessert (Abb. 6), sondern auch eine Zunahme von Spine-Strukturen an Primärneuronen zeigt. Diese Effekte werden zurzeit im Hinblick auf die damit verbundene Signaltransduktion untersucht, scheinen aber in jedem Fall letztlich über eine Aktivierung des Transkriptionsfaktors CREB (cAMP response element-binding protein) zu verlaufen, und zeigen damit wiederum eine große Analogie zu klassischen Antidepressiva [32, 50]. Damit wird über diese Mechanismen erklärbar, warum offensichtlich Silexan auch antidepressive Effekte zeigen kann, ohne dass es als eigentliches Antidepressivum geprüft und positiv bewertet ist. Inwieweit an diesen Effekten auch die Bindung und Beeinflussung von präsynaptischen Calciumkanälen eine Rolle spielt, ist noch nicht geklärt; Pregabalin zeigt in unseren neurotrophen Modellen aber keinen Effekt.
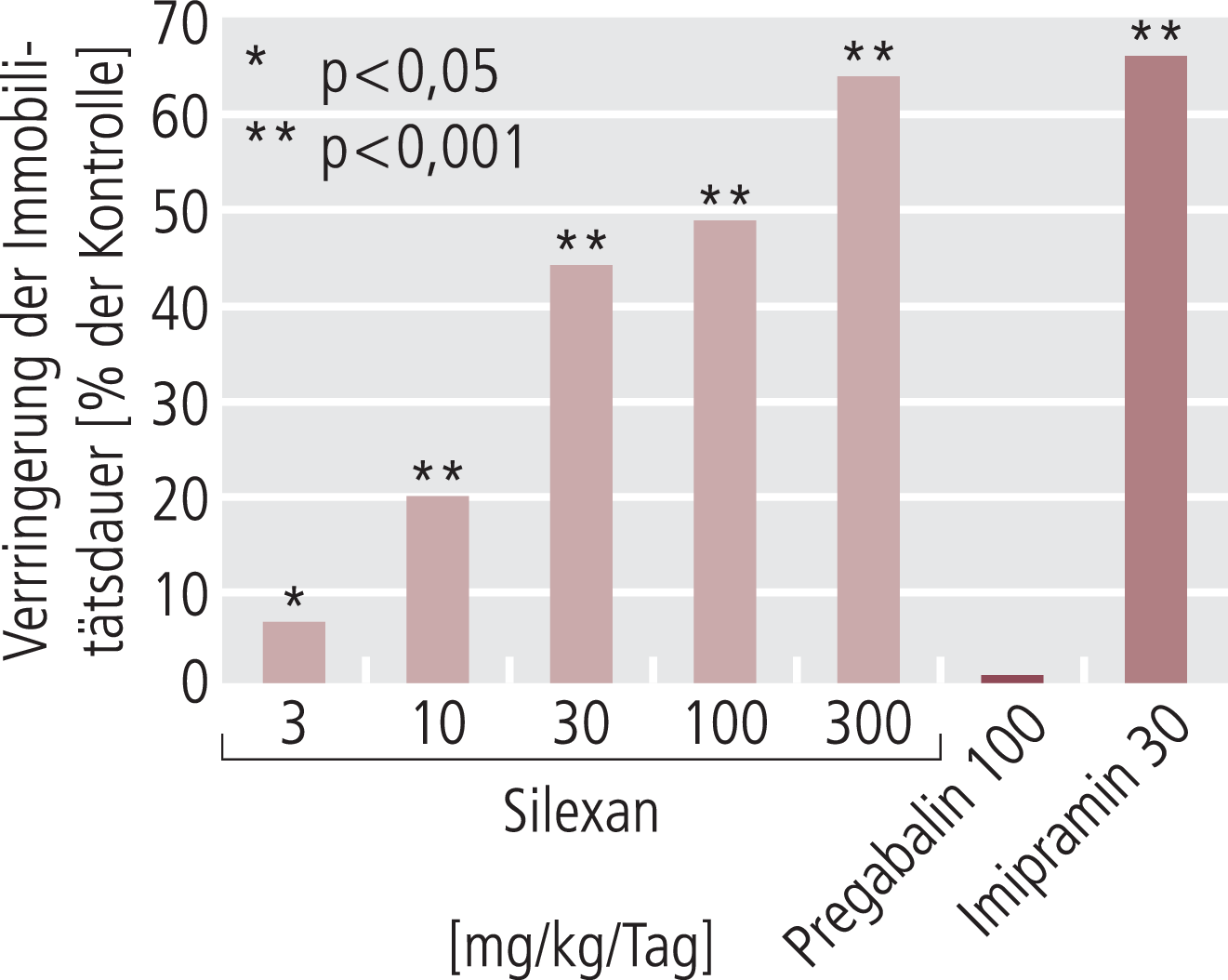
Abb. 5. Wirkung von Silexan und den Vergleichssubstanzen Imipramin und Pregabalin im Forced Swimming Test (Immobilisationstest nach Porsolt) an der Ratte nach 9-tägiger oraler Behandlung [mod. nach 38]
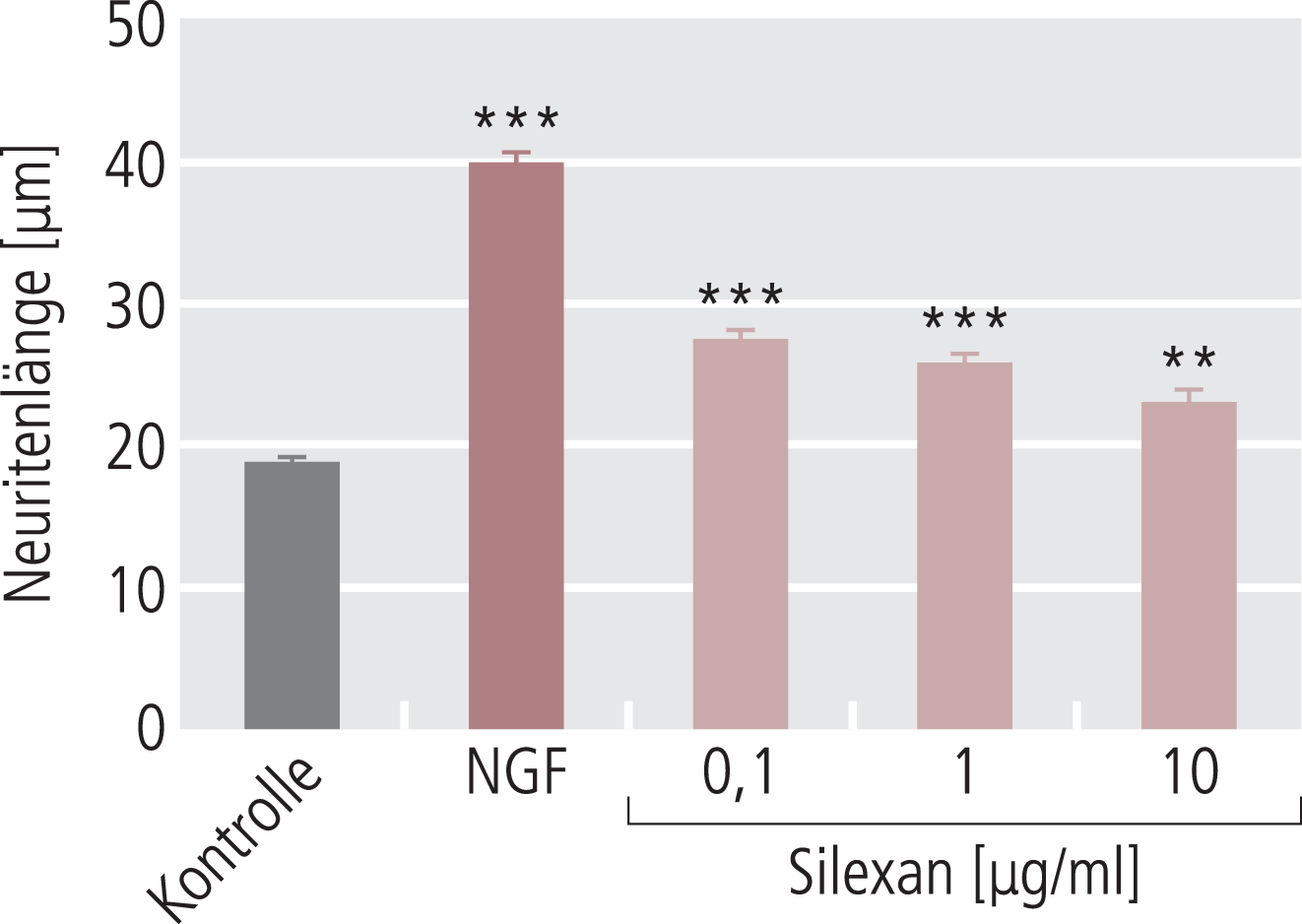
Abb. 6. Silexan stimuliert die Neuritogenese in PC12-Zellen ähnlich wie der Nervenwachstumsfaktor NGF [mod. nach 32 und 50]. Die Effekte sind auch schon bei einer Konzentration von 100 ng/ml maximal. Die Daten sind die Mittelwerte von n ± SEM-Messungen. **p<0,01 im Vergleich zur Kontrolle, ***p<0,001 im Vergleich zur Kontrolle
Fehlendes Interaktionspotenzial
Auch pflanzliche Arzneimittel können mit anderen Arzneimitteln Interaktionen zeigen, wie es beispielsweise für Johanniskraut mit Immunsuppressiva vom Ciclosporintyp sehr gut bekannt ist. Bis zum jetzigen Datum gibt es für Silexan keine klinischen Hinweise auf relevante Interaktionen mit anderen Arzneistoffen. Es hat in einer sogenannten Cocktail-Studie an freiwilligen Probanden keine klinisch relevante Beeinflussung der wichtigsten Arzneimittel-metabolisierenden Cytochrom-P450-Isoenzyme gezeigt [15]. Hier wird Silexan über eine gewisse Zeit verabreicht, wobei gegen Ende der Therapie die Probanden einen Cocktail von Markersubstanzen einnehmen müssen, die spezifisch von einer Unterklasse dieser Enzyme metabolisiert werden. Durch den Plasmaspiegelverlauf dieser Markersubstanzen kann man sehr schnell einen Aufschluss bekommen, ob die zu testende Substanz (Silexan) Interaktionen zeigt, beispielsweise durch Enzymhemmung oder Enzymaktivierung. Dies war für den Fall von Silexan negativ. Ähnlich negative Befunde liegen für orale Kontrazeptiva vor, wo ebenfalls in Untersuchungen an gesunden weiblichen Probanden keinerlei pharmakokinetische oder „funktionelle“ Interaktionen mit den Hormonwirkungen bzw. Hormonspiegeln beobachtet wurden [25].
Linalool war auch kein Substrat bzw. Hemmstoff dess P-Glykoproteins der Blut-Hirn-Schranke [64]. Auch Experimente an der Ratte zeigten keinerlei mögliche Interaktionspotenziale von Linalool im Hinblick auf die Arzneimittelmetabolisierung. Diese Befunde sind besonders wichtig, da In-vitro-Untersuchungen an isolierten menschlichen Metabolisierungssystemen Substrateigenschaften (CYP2D6, CYP2C19) von Linalool bei sehr hohen Konzentrationen beschrieben haben [34]. Die sehr viel weitergehenden, im obigen Teil beschriebenen Humanuntersuchungen zeigen nun, dass unter therapeutischen Bedingungen und bei therapeutischen Plasma- bzw. Gewebekonzentrationen Arzneimittelinteraktionen unter der Anwendung von Silexan nicht zu erwarten sind.
Abschließende Bewertung
Die vorliegenden pharmakologischen Daten von Silexan zeigen sehr klar, dass Silexan in pharmakologischen Modellen wirksam ist, die als indikativ für eine Wirkung bei Angsterkrankungen gelten. Von besonderer Bedeutung ist die Tatsache, dass die in den Tiermodellen notwendigen Dosen (zwischen 1 und 3 mg/kg) erstaunlich deckungsgleich mit den klinischen Dosen von Silexan sind, die in den meisten zurückliegenden Studien 80 mg pro Tag und in einer neueren Studie bei generalisierter Angststörung 160 mg pro Tag betrugen. Darüber hinaus sind die unter diesen Bedingungen erreichten Plasmakonzentrationen beim Tier (Ratte) wie auch beim Menschen erstaunlich übereinstimmend und liegen in dem sehr niedrigen Bereich von deutlich unter einem 1 µg/ml mit Plasmakonzentration entsprechend unter 500 nM. Silexan ist damit eine sehr potente Wirksubstanz, was gewisse Maßstäbe auf der Suche zum biochemischen Wirkungsmechanismus setzte. Hier konnte man in der letzten Zeit zeigen, dass in einer Inhibierung präsynaptischer Calciumkanäle wahrscheinlich der primäre Angriffspunkt von Silexan liegt und die Substanz damit gewisse Analogien zum etablierten Anxiolytikum Pregabalin aufweist, wobei Silexan im Gegensatz zu Pregabalin keine sedierenden Eigenschaften zeigt.
Interessenkonflikterklärung
WEM hat Vortrags- und Beraterhonorare von Dr. Willmar Schwabe GmbH & Co KG (Karlsruhe) und Lundbeck (Hamburg) erhalten sowie Forschungsunterstützung von Dr. Willmar Schwabe GmbH & Co KG (Karlsruhe).
AS hat keine Interessenskonflikte.
MN ist Mitarbeiter von Dr. Willmar Schwabe GmbH & Co.KG (Karlsruhe).
SK hat Forschungsunterstützung erhalten von Eli Lilly, Lundbeck A/S, Bristol-Myers Squibb, Servier, Sepracor, GlaxoSmithKline, Organon, Dr. Willmar Schwabe GmbH & Co. KG sowie Beraterhonorare von AstraZeneca, Austrian Sick Found, Bristol-Myers Squibb, German Research Foundation (DFG), GlaxoSmithKline, Eli Lilly, Lundbeck A/S, Pfizer, Organon, Dr. Willmar Schwabe GmbH & Co. KG, Sepracor, Janssen und Novartis und Vortragshonorare von AstraZeneca, Eli Lilly, Lundbeck A/S, Dr. Willmar Schwabe GmbH & Co.KG, Servier, Sepracor and Janssen.
KF hat Forschungsunterstützung von Dr. Willmar Schwabe GmbH & Co.KG (Karlsruhe) erhalten.
Literatur
1. Akhondzadeh S, Kashani L, Fotouhi A, Jarvandi S, et al. Comparison of Lavandula angustifolia Mill. tincture and imipramine in the treatment of mild to moderate depression: a double-blind, randomized trial. Prog Neuropsychopharmacol Biol Psychiatry 2003;27:123–7.
2. Aoshima H, Hamamoto K. Potentiation of GABAA receptors expressed in Xenopus oocytes by perfume and phytoncid. Biosci Biotechnol Biochem 1999;63:743–8.
3. Baldinger P, Höflich AS, Mitterhauser M, Hahn A, et al. Effects of silexan on the serotonin-A receptor and microstructure of the human brain: a randomized, placebo-controlled, double-blind, cross-over study with molecular and structural neuroimaging. Int J Neuropsychopharmacol 2014 published online October 31, 2014.
4. Basch E, Foppa I, Liebowitz R, Nelson J, et al. Lavender (Lavandula angustifolia Miller). J Herb Pharmacother 2004;4:63–78.
5. Bradley BF, Starkey NJ, Brown SL, Lea RW. Anxiolytic effects of Lavandula angustifolia odour on the Mongolian gerbil elevated plus maze. J Ethnopharmacol 2007;111: 517–25.
6. Bradley BF, Brown SL, Chu S, Lea RW. Effects of orally administered lavender essential oil on responses to anxiety-provoking film clips. Hum Psychopharmacol 2009;24:319–30.
7. Buchbauer G, Jirovetz L, Jäger W. Aromatherapy: Evidence for sedative effects of the essential oil of lavender after inhalation. Z Naturforschung 1991;46c:1067–72.
8. Challis C, Boulden J, Veerakumar A, Espallergues J, et al. Raphe GABAergic neurons mediate the acquisition of avoidance after social defeat. J Neurosci 2013: 33:13978–88.
9. Castrén E, Hen R. Neuronal plasticity and antidepressant actions. Trends Neurosci 2013;36:259–67.
10. Chioca LR, Ferro MM, Baretta IP, Oliveira SM, et al. Anxiolytic-like effect of lavender essential oil inhalation in mice: participation of serotonergic but not GABAA/benzodiazepine neurotransmission. J Ethnopharmacol 2013;147:412–8.
11. Cline M, Taylor JE, Flores J, Bracken S, et al. Investigation of the anxiolytic effects of linalool, a lavender extract, in the male Sprague-Dawley rat. AANA J 2008;76:47–52.
12. Clinical and Biometrical study report (2012). Randomisierte, doppelblinde, Placebo-kontrollierte Phase-II-Studie zur Überprüfung des Wirkprofils und der Sicherheit und Verträglichkeit von Lavendelöl WS® 1265 bei Patienten mit chronischer primärer Insomnie. Dr. Willmar Schwabe GmbH & Co. KG, Karlsruhe.
13. Clinical and Biometrical study report (2010/1a). A single-centre, randomized, placebo-controlled, double-blind study to assess the tolerability and pharmacokinetics of linalool after repeated daily administration of 160 mg and 320 mg of Silexan WS 1265 for two weeks in healthy male and female subjects. Dr. Willmar Schwabe GmbH & Co. KG, Karlsruhe.
14. Clinical trial report (2010/2b). A stepwise sequential dose-rising phase I study to assess the safety and tolerability of single p.o. doses of 80 to 640 mg Silexan WS 1265 in healthy subjects. Dr. Willmar Schwabe GmbH & Co. KG, Karlsruhe.
15. Doroshyenko O, Rokitta D, Zadoyan G, Klement S, et al. Drug cocktail interaction study on the effect of the orally administered lavender oil preparation silexan on cytochrome P450 enzymes in healthy volunteers. Drug Metab Dispos 2013;41:987–93.
16. Elisabetsky E, Marschner J, Souza DO. Effects of linalool on glutamatergic system in the rat cerebral cortex. Neurochem Res 1995;20:461–5.
17. Griebel G, Holmes A. 50 years of hurdles and hope in anxiolytic drug discovery. Nat Rev Drug Discov 2013;12:667–87.
18. Guzmán-Gutiérrez SL, Gómez-Cansino R, García-Zebadúa JC, Jiménez-Pérez NC, et al. Antidepressant activity of Litsea glaucescens essential oil: identification of α-pinene and linalool as active principles. J Ethnopharmacol 2012;143:673–9.
19. Jäger W, Buchbauer G, Jirovetz L, Fritzer M. Percutaneous absorption of lavender oil from a massage oil. J Soc Cosmet Chem 1992;43:49–54.
20. Heuberger E, Redhammer S, Buchbauer G. Transdermal absorption of (-)-linalool induces autonomic deactivation but has no impact on ratings of well-being in humans. Neuropsychopharmacology 2004;29:1925–32.
21. Huang L, Abuhamdah S, Howes MJ, Dixon CL, et al. Pharmacological profile of essential oils derived from Lavandula angustifolia and Melissa officinalis with anti-agitation properties: focus on ligand-gated channels. J Pharm Pharmacol 2008;60:1515–22.
22. Kasper S, Gastpar M, Müller WE, Volz HP, et al. (b) Efficacy and safety of silexan, a new, orally administered lavender oil preparation, in subthreshold anxiety disorder – evidence from clinical trials. Wien Med Wochenschr 2010;160:547–56.
23. Kasper S, Gastpar M, Müller WE, Volz HP, et al. (a) Silexan, an orally administered Lavandula oil preparation, is effective in the treatment of “subsyndromal” anxiety disorder: a randomized, double-blind, placebo controlled trial. Int Clin Psychopharmacol 2010;25:277–87.
24. Kasper S, Dienel A. Wirkungen von Silexan auf begleitende depressive Symptome bei Patienten mit Angsterkrankungen – Metaanalyse. Poster beim DGPPN Kongress, Berlin, 21.–24. November 2012.
25. Kasper S, Dienel A. Effects of Silexan on human cytochrome P450 activity and contraceptive efficacy of a combined oral contraceptive. Poster beim DGPPN Kongress, Berlin, 23.–26. November 2011.
26. Kasper S. An orally administered lavandula oil preparation (Silexan) for anxiety disorder and related conditions: an evidence based review. Int J Psychiatry Clin Pract 2013;17(Suppl 1):15–22.
27. Kasper S, Gastpar M, Müller WE, Volz HP, et al. Lavender oil preparation Silexan is effective in generalized anxiety disorder – a randomized, double-blind comparison to placebo and paroxetine. Int J Neuropsychopharmacol 2014;23:1–11.
28. Kehr J, Yoshitake S, Yoshitake T, Koch E, et al. Silexan, an essential oil from flowers of Lavandula angustifolia, increases the extracellular levels of noradrenaline, dopamine and serotonin in the prefrontal cortex of freely moving rats. Neuroscience 2010, Abstract. San Diego 13.–17.11.2010.
29. Kumar V. Characterization of anxiolytic and neuropharmacological activities of Silexan. Wien Med Wochenschr 2013;163:89–94.
30. Kuroda K, Inoue N, Ito Y, Kubota K, et al. Sedative effects of the jasmine tea odor and (R)-(-)-linalool, one of its major odor components, on autonomic nerve activity and mood states. Eur J Appl Physiol 2005;95:107–14.
31. Leuner K, Müller WE. Dopamine in the prefrontal cortex and its different modulation by conventional and atypical antipsychotics. Pharmacopsychiatry 2007;40(Suppl 1):S17–S26.
32. Leuner K, Sillani G, Ye L, Nöldner M, et al. Preclinical antidepressant activity of lavender oil (Silexan) – roel of neurotrophic effects via CREB phosphorylation. Neuroscience Meeting 2013, Abstract, San Diego 09.–13.11.2013.
33. Linck VM, da Silva AL, Figueiró M, Caramão EB, et al. Effects of inhaled Linalool in anxiety, social interaction and aggressive behavior in mice. Phytomedicine 2010;17:679–83.
34. Meesters RJ, Duisken M, Hollender J. Study on the cytochrome P450-mediated oxidative metabolism of the terpene alcohol linalool: indication of biological epoxidation. Xenobiotica 2007;37:604–17.
35. Nakamura A, Fujiwara S, Ishijima T, Okada S, et al. Neuron differentiation-related genes are up-regulated in the hypothalamus of odorant-inhaling rats subjected to acute restraint stress. J Agric Food Chem 2010;58:7922–9.
36. Nöldner M, Germer S, Koch E. Pharmacokinetics of linalool and linalyl acetate, the two main constituents of silexan, an essential oil from lanandula angustifolia flowers, in rat. Planta Medica 2011;77:1410 (abstract).
37. Nöldner M, Germer S, Koch E. Pharmacokinetics of linalool and linalyl acetate in rats after repeated oral administration of silexan, an essential oil from Lanancula angustifolia flowers. Planta Medica 2013;79:1148 (abstract).
38. Nöldner M, Luderer G. Effects of oral administration of Silexan on behavioural parameters in rats and mice. Planta Medica 2007;73:797–1034 (abstract).
39. Perry N, Perry E. Aromatherapy in the management of psychiatric disorders: clinical and neuropharmacological perspectives. CNS Drugs 2006;20:257–80.
40. Perry R, Terry R, Watson LK, Ernst E. Is lavender an anxiolytic drug? A systematic review of randomised clinical trials. Phytomedicine 2012;19:825–35.
41. Pittenger C, Duman RS. Stress, depression, and neuroplasticity: a convergence of mechanisms. Neuropsychopharmacology 2008;33:88–109.
42. Ruini C, Ottolini F, Rafanelli C, Tossani E, et al. The relationship of psychological well-being to distress and personality. Psychother Psychosom 2003;72:268–75.
43. Ryff CD, Singer B. Psychological well-being: meaning, measurement, and implications for psychotherapy research. Psychother Psychosom 1996;65:14–23.
44. Ryff CD, Dienberg Love G, Urry HL, Muller D, et al. Psychological well-being and ill-being: do they have distinct or mirrored biological correlates? Psychother Psychosom 2006;75:85–95.
45. Schuwald AM, Nöldner M, Wilmes T, Klugbauer N, et al. Lavender oil-potent anxiolytic properties via modulating voltage dependent calcium channels. PLoS One 2013;8:e59998.
46. Seol GH, Shim HS, Kim PJ, Moon HK, et al. Antidepressant-like effect of Salvia sclarea is explained by modulation of dopamine activities in rats. J Ethnopharmacol 2010;130:187–90.
47. Shaw D, Norwood K, Leslie JC. Chlordiazepoxide and lavender oil alter unconditioned anxiety-induced c-fos expression in the rat brain. Behav Brain Res 2011;224:1–7.
48. Shaw D, Annett JM, Doherty B, Leslie JC. Anxiolytic effects of lavender oil inhalation on open-field behaviour in rats. Phytomedicine 2007;14:613–20.
49. Silenieks LB, Koch E, Higgins GA. Silexan, an essential oil from flowers of Lavandula angustifolia, is not recognized as benzodiazepine-like in rats trained to discriminate a diazepam cue. Phytomedicine 2013;20:172–7.
50. Sillani G, Schiller C, Leuner K, Müller WE. The molecular mechanism of silexan. Neurotrophic effects via CREB activation might explain preclinical antidepressant properties. Pharmacopsychiatry 2013;46:233.
51. Silva Brum LF, Emanuelli T, Souza DO, Elisabetsky E. Effects of linalool on glutamate release and uptake in mouse cortical synaptosomes. Neurochem Res 2001;26:191–4.
52. Silva Brum LF, Elisabetsky E, Souza D. Effects of linalool on [(8)H]MK801 and [(3)H] muscimol binding in mouse cortical membranes. Phytother Res 2001;15:422–5.
53. Takahashi M, Satou T, Ohashi M, Hayashi S, et al. Interspecies comparison of chemical composition and anxiolytic-like effects of lavender oils upon inhalation. Nat Prod Commun 2011;6:1769–74.
54. Takahashi M, Yoshino A, Yamanaka A, Asanuma C, et al. Effects of inhaled lavender essential oil on stress-loaded animals: changes in anxiety-related behavior and expression levels of selected mRNAs and proteins. Nat Prod Commun 2012;7:1539–44.
55. Tsang HW, Ho TY. A systematic review on the anxiolytic effects of aromatherapy on rodents under experimentally induced anxiety models. Rev Neurosci 2010;21:141–52.
56. Uehleke B, Schaper S, Dienel A, Schlaefke S, et al. Phase II trial on the effects of Silexan in patients with neurasthenia, post-traumatic stress disorder or somatization disorder. Phytomedicine 2012;19:665–71.
57. Umezu T. Evaluation of the effects of plant-derived essential oils on central nervous system function using discrete shuttle-type conditioned avoidance response in mice. Phytother Res 2012;26:884–91.
58. Umezu T. Behavioral effects of plant-derived essential oils in the geller type conflict test in mice. Jpn J Pharmacol 2000;83:150–3.
59. Umezu T, Nagano K, Ito H, Kosakai K, et al. Anticonflict effects of lavender oil and identification of its active constituents. Pharmacol Biochem Behav 2006;85:713–21.
60. Urry HL, Nitschke JB, Dolski I, Jackson DC, et al. Making a life worth living: neural correlates of well-being. Psychol Sci 2004;15:367–72.
61. Valente MM, Bortolotto V, Cuccurazzu B, Ubezio F, et al. á2ä ligands act as positive modulators of adult hippocampal neurogenesis and prevent depression-like behavior induced by chronic restraint stress. Mol Pharmacol 2012;82:271–80.
62. Woelk H, Schläfke S. A multi-center, double-blind, randomised study of the Lavender oil preparation Silexan in comparison to Lorazepam for generalized anxiety disorder. Phytomedicine 2010;17:94–9.
63. Yamada K, Mimaki Y, Sashida Y. Effects of inhaling the vapor of Lavandula burnatii super-derived essential oil and linalool on plasma adrenocorticotropic hormone (ACTH), catecholamine and gonadotropin levels in experimental menopausal female rats. Biol Pharm Bull 2005;28:378–9.
64. Yoshida N, Takagi A, Kitazawa H, Kawakami J, et al. Inhibition of P-glycoprotein-mediated transport by extracts of and monoterpenoids contained in Zanthoxyli fructus. Toxicol Appl Pharmacol 2005;209:167–73.
1Silexan® ist eine eingetragene Marke der Dr. Willmar Schwabe GmbH & Co. KG
Univ.-Prof. Dr. Walter E. Müller, Höhenstr. 49A, 67550 Worms Herrnsheim, und Pharmakologisches Institut für Naturwissenschaftler, Goethe-Universität, Biozentrum, 60438 Frankfurt/M.
Anita Schuwald, Pharmakologisches Institut für Naturwissenschaftler, Goethe-Universität, Biozentrum, 60438 Frankfurt/M.
Michael Nöldner, Präklinische Forschung, Dr. Willmar Schwabe GmbH & Co. KG, 76227 Karlsruhe O. Univ.-Prof. Dr. Siegfried Kasper, Universitätsklinik für Psychiatrie und Psychotherapie, Medizinische Universität Wien, Währinger Gürtel 18–20, 1090 Wien, Österreich
Prof. Dr. Kristina Friedland, Institut für Molekulare und Klinische Pharmazie, Universität Erlangen, 91058 Erlangen
Pharmacological basis of the therapeutic use of Silexan (Lasea®)
Silexan2 is a patented active substance with an essential oil produced from Lavandula angustifolia flowers by steam distillation and complies with the monograph Lavender oil of the Ph. Eur. It exceeds the quality definition of the Ph. Eur. with respect to items important for efficacy and tolerability. In Germany it is registered as a drug under the brand name Lasea® for the treatment of states of restlessness related to anxious mood. Its clinical efficacy for this indication is well documented by several placebo-controlled double-blind studies.
In pharmacokinetic studies in humans, plasma levels of linalool, one of the main active ingredients, were found in the nanomolar range for doses of 80 – 160 mg. Comparable plasma and brain levels were found in rats for doses between 3 – 10 mg/kg. At these doses, Silexan was active in many behavior models indicative for anxiolytic activity in humans. Silexan had no activity on many targets typical for other anxiolytic drugs like binding sites of benzodiazepines or muscinol at the GABAA receptor complex, the serotonin-, dopamine or noradrenalin transporter or the 5-HT1A receptor. However, with some similarity to the anxiolytic drug Pregabalin it reduces the activity of presynaptic voltage-dependent calcium channels. However, as a major difference to Pregabalin it is nearly completely devoid of sedative properties. Moreover, also contrary to Pregabalin, Silexan shows a preclinical antidepressive profile with neurotrophic properties and activity in the forced swimming test. According to the clinical data available so far it seems to be free of relevant drug interactions and the potential for abuse or dependence.
Key words: Silexan, lavender oil, anxiolytic activity-pharmacokinetics
2Silexan® is a registered proprietary name of Dr. Willmar Schwabe GmbH & Co. KG
Psychopharmakotherapie 2015; 22(01)
