Gerhard Nitz, Berlin, und Jörn P. Sieb, Stralsund
Von einer seltenen Krankheit („orphan disease“; englisch orphan „Waise“, disease „Krankheit“) sind gemäß der in der Europäischen Union (EU) geltenden Definition weniger als 5 pro 10000 Einwohner betroffen. Aufgrund dieser geringen Häufigkeit übersteigen für die pharmazeutische Industrie die zu erwartenden Investitionskosten für die Entwicklung eines Fertigarzneimittels zur Behandlung einer seltenen Erkrankung häufig den damit möglichen Umsatz. Auch deshalb steht für viele seltene Krankheiten keine adäquate Arzneitherapie zur Verfügung, die gemäß den Prinzipien der sogenannten Good Manufacturing Practice (GMP; „Gute Herstellungspraxis“) entwickelt wurde. Unter dem Begriff GMP werden die Richtlinien zur Qualitätssicherung der Produktionsabläufe und -umgebung in der Produktion von Arzneimitteln, Wirkstoffen und Medizinprodukten zusammengefasst. In der pharmazeutischen Herstellung spielt die Qualitätssicherung eine zentrale Rolle, da hier Qualitätsabweichungen fatal die Therapiesicherheit beeinträchtigen können.
Die Europäische Kommission hat im Jahr 2000 für Unternehmen Anreize geschaffen, Medikamente für seltene Erkrankungen zu entwickeln. Der Orphan-Drug-Status wird von der Europäischen Kommission vergeben und bringt für das entwickelnde Unternehmen Vorteile in Form von kostenloser Beratung, ermäßigten Zulassungsgebühren und einer zehnjährigen Marktexklusivität unabhängig vom Patentschutz für das Orphan-Medikament. Die Kriterien für eine Anerkennung als Orphan Drug innerhalb der EU sind in der Verordnung (EG) Nr. 141/2000 festgelegt.
Wir diskutieren am Beispiel des Kaliumkanalblockers Amifampridin (chemisch 3,4-Diaminopyridin, 3,4-DAP) den medizinrechtlichen Rahmen bei der Auswahlentscheidung zwischen einem Rezepturarzneimittel und einer zugelassenen Fertigformulierung. Anlass ist die aktuelle Markteinführung von Amifampridinphosphat (Firdapse®) zur Behandlung des Lambert-Eaton-Syndroms, dessen Einsatz zu einer deutlichen Verteuerung der Therapie führt.
Methoden
Sämtliche in den Datenbanken MEDLINE und EMBASE abrufbaren Veröffentlichungen zum Lambert-Eaton-Syndrom wurden berücksichtigt (Key word: lambert-eaton myasthenic syndrome). Weiterhin standen die Zulassungsdaten von Amifampridin-Phosphat zur Verfügung. Die relevante deutsche Rechtsprechung wurde gesichtet.
Ergebnisse
Lambert-Eaton-Syndrom
Das Lambert-Eaton-Syndrom ist eine seltene Autoimmunerkrankung [24]. Die Häufigkeit wird auf 1:100000 bis 1:450000 geschätzt, so dass in Deutschland maximal 800 Patienten davon betroffen sein dürften. Es beruht auf Antikörpern gegen spannungsgesteuerte Calciumkanäle vom P/Q-Typ. Folge ist eine Störung der Transmitterfreisetzung an cholinergen Synapsen des motorischen und autonomen Nervensystems. Neben dem idiopathischen Lambert-Eaton-Syndrom tritt die Erkrankung in etwa 50% der Fälle paraneoplastisch als immunologische Begleiterkrankung eines kleinzelligen Bronchialkarzinoms auf. Das klinische Bild wird in Tabelle 1 zusammengefasst. Charakteristisch für das Lambert-Eaton-Syndrom ist eine beinbetonte Gliedergürtelschwäche. Die Patienten klagen überwiegend über eine Schwäche bei Ausdauerleistungen mit einer reduzierten maximalen Gehstrecke. Typischerweise beginnt die Erkrankung im Bereich des Hüftgürtels und es kommt später im Krankheitsverlauf zu einer Armschwäche und Hirnnervensymptomen. Manchen Lambert-Eaton-Kranken ist ein freier Gang nicht mehr möglich. Weiterhin treten autonome Störungen auf, wie ein störend trockener Mund, verminderte Schweißbildung und Erektionsstörungen.
Tab. 1. Lambert-Eaton-Syndrom – klinisches Bild [24]
|
Verhältnis Männer : Frauen |
1,4:1 |
|
Durchschnittlicher Erkrankungsbeginn |
50 Jahre (Spannbreite 11–76 Jahre) |
|
Schwäche/verminderte Ausdauerleistung |
Beine (bei 100%) |
|
Hirnnervensymptome (bei 60%, jedoch nicht bei Erkrankungsbeginn) |
Ptose |
|
Autonome Störungen (bei 80%) |
Mundtrockenheit |
|
Paraneoplastisch (bei etwa 50%) |
Kleinzelliges Bronchialkarzinom |
Beim paraneoplastischen Lambert-Eaton-Syndrom kann die neurologische Symptomatik mehrere Jahre der eigentlichen Tumormanifestation vorangehen. Bemerkenswerterweise wird die Überlebenszeit beim kleinzelligen Bronchialkarzinom durch das Bestehen eines Lambert-Eaton-Syndroms günstig beeinflusst. Unklar ist, ob dieser günstige Effekt auf einer früheren Karzinomdiagnose bei Lambert-Eaton-Patienten beruht oder ob er Ausdruck einer immunologischen Tumorabwehr ist, in deren Rahmen das Lambert-Eaton-Syndrom als Autoimmunerkrankung auftritt.
Die für das Lambert-Eaton-Syndrom pathognomonische Störung der neuromuskulären Signalübertragung lässt sich leicht durch elektrophysiologische Routineverfahren sichern, wie in Abbildung 1 dargestellt wird [25]. Bei etwa 90% aller Lambert-Eaton-Patienten finden sich serologisch Autoantikörper gegen spannungsgesteuerte Calciumkanäle vom P/Q-Typ. Nach Diagnosestellung ist eine intensive Tumorsuche unabdingbar.
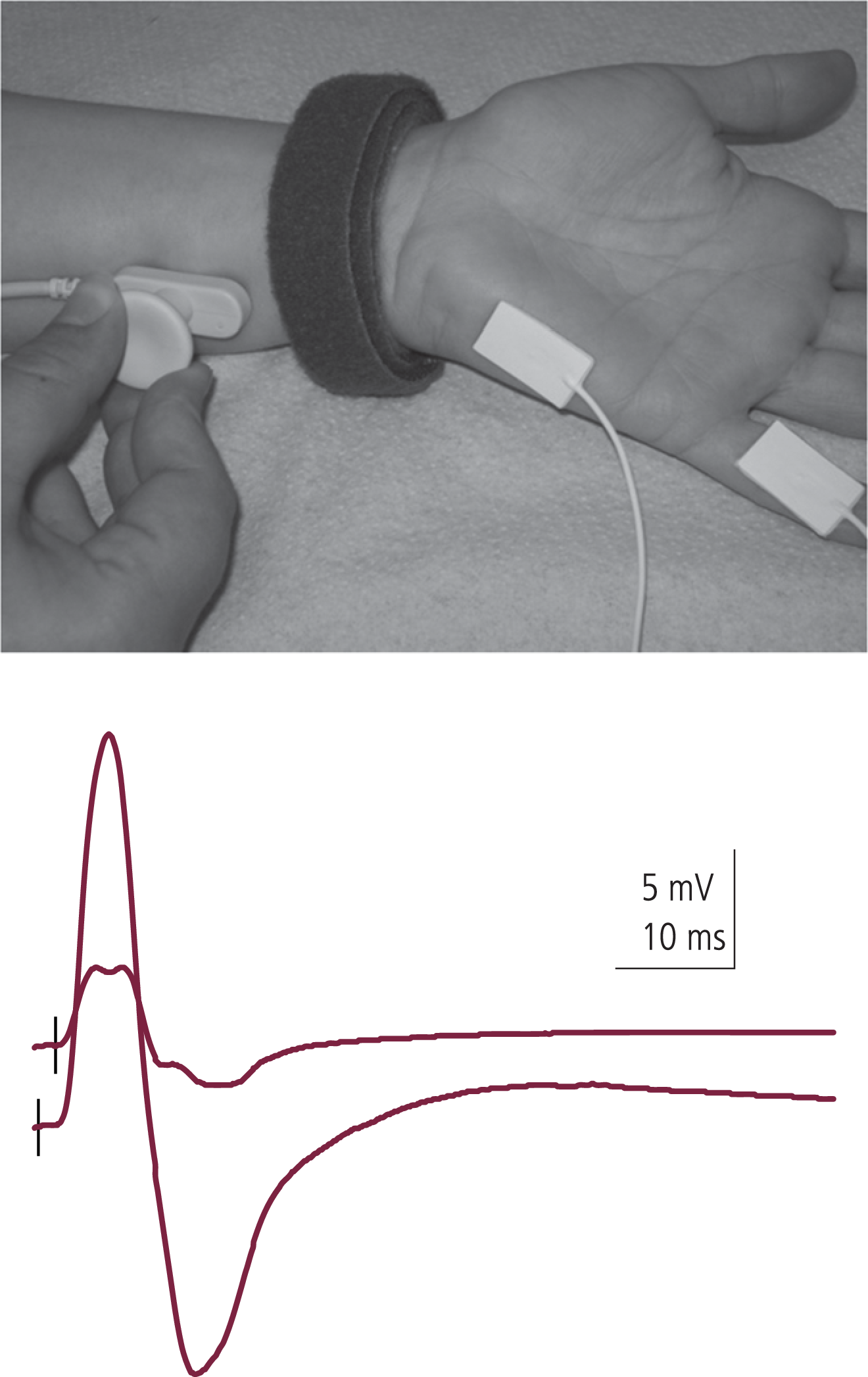
Abb. 1. Das Lambert-Eaton-Syndrom lässt sich leicht neurographisch sichern, wie hier beispielhaft an den Befunden bei einer Patientin mit einem seit 14 Jahren bestehenden idiopathischen Lambert-Eaton-Syndrom gezeigt wird.
Oben: Dargestellt ist die Ulnarisneurographie mit Ableitung vom Hypothenar. Der Nervus ulnaris wird mit supramaximalen Einzelreizen stimuliert.
Unten: Beim Lambert-Eaton-Syndrom finden sich motorische Summenantwortpotenziale von niedriger Amplitude aufgrund der gestörten Transmitterausschüttung. Durch eine kurzeitige (hier 20 Sekunden) maximale Willkürinnervation des Musculus abductor digiti quinti kommt es zu einer pathognomonischen Amplitudenzunahme, einem Inkrement, das hier 400% beträgt. Wie bei etwa 90% aller Fälle von Lambert-Eaton-Syndrom waren auch bei dieser Patientin Autoantikörper gegen spannungsgesteuerte Calciumkanäle vom P/Q-Typ nachweisbar (Titer 608 pmol/l; normal <25).
Therapeutisch gibt es beim Lambert-Eaton-Syndrom drei Optionen gemäß den Leitlinien der European Federation of Neurological Societies (EFNS) und der Deutschen Gesellschaft für Neurologie:
- Beim paraneoplastischen Lambert-Eaton-Syndrom ist die Karzinombehandlung vorrangig, wobei der Autoimmunprozess auch bei einer erfolgreichen onkologischen Therapie fortbestehen kann.
- Eine immunsuppressive Behandlung zur Besserung der Muskelkraft über eine Unterdrückung des Autoimmunprozesses soll gemäß EFNS nur begonnen werden, wenn die symptomatische Behandlung nicht hinreichend wirksam ist.
- Symptomatisch kann die Muskelkraft durch den Einsatz des Kaliumkanalblockers Amifampridin gebessert werden.
Amifampridin beim Lambert-Eaton-Syndrom
Mit Amifampridin als Kaliumkanalblocker kann die beim Lambert-Eaton-Syndrom vorliegende Störung der synaptischen Signalübertragung gezielt behandelt werden. Der elektrophysiologische Wirkungsmechanismus von Amifampridin ist genau bekannt: Durch den beim Lambert-Eaton-Syndrom bestehenden Autoimmunprozess mit Bildung von Antikörpern gegen Calciumkanäle vom P/Q-Typ ist die Acetylcholin-Ausschüttung an der motorischen Endplatte vermindert. Amifampridin als Kaliumkanalblocker bedingt eine Verlängerung der Depolarisationsphase während nervaler Aktionspotenziale, da die Repolarisation am Ende eines Aktionspotenzials auf der Öffnung von Kaliumkanälen beruht. Die Offenzeit spannungsgesteuerter Calciumkanäle an der präsynaptischen Membran wird somit mittelbar verlängert, es strömen deshalb vermehrt Calciumionen in die Nervenendigung ein und die Acetylcholin-Ausschüttung als Calcium-abhängiger Prozess wird erhöht. Dies beeinflusst die neuromuskuläre Signalübertragung günstig und die Muskelkraft nimmt zu.
Amifampridin wird bereits seit mehr als 25 Jahren erfolgreich beim Lambert-Eaton-Syndrom eingesetzt. Insgesamt liegen dazu bislang sechs randomisierte, kontrollierte Studien mit bis zu 25 Patienten vor (Übersicht in [22]). Therapiert wurde mit bis zu 100 mg Amifampridin täglich mit einer guten Wirksamkeit hinsichtlich Muskelkraft und elektrophysiologischen Parametern. Teilweise wurde kombiniert mit dem Acetylcholinesterase-Inhibitor Pyridostigminbromid behandelt, der in Deutschland als Kalymin® und Mestinon® verfügbar ist. Überwiegend lag die in den Therapiestudien eingesetzte Amifampridin-Tagesdosis unter 60 mg. Im höheren Dosisbereich kann es zu Parästhesien perioral sowie im Bereich von Fingern und Zehen kommen. Bei einem Studienpatienten kam es zu einem epileptischen Anfall nach einer Erhöhung der Amifampridin-Tagesdosis auf 100 mg. Insgesamt sind aber nur sehr eingeschränkt Daten zur Arzneimittelsicherheit verfügbar. Bislang wurde über zwei Schwangerschaften unter Amifampridin berichtet, die jeweils unproblematisch verliefen [25]. Allgemein werden Lambert-Eaton-Patientinnen im gebärfähigen Alter dazu angehalten, eine sichere Kontrazeption während einer Amifampridin-Therapie anzuwendens.
Rezepturarzneimittel versus Fertigarzneimittel
Im Jahr 2008 wurde Amifampridin vom Bundesinstitut für Arzneimittel und Medizinprodukte unter die Verschreibungspflicht gestellt. In Deutschland waren bislang keine Fertigarzneimittel mit diesem Stoff zugelassen, er wurde ausschließlich im Rahmen von Individualrezepturen auf ärztliche Verordnung und nach den Angaben im Neuen Rezeptur-Formularium der ABDA (Bundesvereinigung Deutscher Apothekerverbände) verarbeitet (Tab. 2).
Tab. 2. Vergleich 3,4-Diaminopyridin(3,4-DAP)-Base mit der Phosphatsalzformulierung
|
Individualrezeptur mit 3,4-DAP-Base |
Fertigarzneimittel mit 3,4-DAP-Phosphat-Salz |
|
|
Formulierung |
Ad-hoc-Zubereitung (Rezepturarzneimittel); meist Kapseln |
Tablette mit Bruchrillen |
|
Dosis |
Nicht definiert; überwiegend 5, 10, 15 oder 20 mg Base |
Entspricht 10 mg der Base |
|
Stabilität |
Unter Umständen eingeschränkte Stabilität |
Verbesserte Stabilität im Vergleich zur Base |
|
Kennzeichnung |
Keine Packungsbeilage mit Sicherheitsinformationen (Nebenwirkungen, Kontraindikationen); auf dem Behältnis Angabe der Dosierung und der Aufbrauchfrist* |
Stabilität und Sicherheitsinformationen in Fachinformation und der Packungsbeilage |
|
Hersteller |
Individualrezeptur, lokale (Krankenhaus-)Apotheken |
Einzelnes pharmazeutisches Unternehmena |
|
Herstellungsbedingungen |
Keine regelmäßige (wiederholte) Qualitätskontrolle des Rohmaterials; vereinfachte Kontrolle des einheitlichen Inhalts durch Wägung der fertigen Kapseln (Stichprobe)** |
Einhaltung der GMP-Standards |
|
Handhabung erfordert wegen allergischer und reizender Hautreaktionen strikte Vorsichtsmaßnahmen |
||
|
Qualität/Variabilität |
Diverse Produkte aus unterschiedlichen Quellen erhältlich |
Einzelne Formulierungb von einem einzelnen Pharmaunternehmen entwickelt |
|
Abweichungen beim Wirkstoff-Gehalt der i.d.R. kleinen Chargen bzw. Einzelrezepturen möglich Risiko einer versehentlichen/unbemerkten Unter- oder Überdosierung durch Herstellungsfehler |
Einheitliche Qualität durch Herstellung in größeren Chargen mit Inprozess- und Freigabekontrollen Korrekte Dosis garantiert |
|
|
Haftung bei Problemen mit der Arzneimittelsicherheitc |
Hersteller ist nicht leicht zu identifizieren Schadensersatz durch den Hersteller nicht sichergestellt |
Einzelner Hersteller, leicht erreichbar Schadensersatz durch den Hersteller abgesichert |
|
Jahrestherapiekosten |
<10000,– Euro |
Bei 60 mg/Tag >60000,– Euro |
|
Kostenübernahmec |
Nicht sichergestellt |
Auch durch gesetzliche Krankenkassen |
GMP: Good Manufacturing Practice; a: BioMarin Pharmaceutical, Inc, USA; b: Firdapse®; c: Situation in Deutschland
*Die Herstellungsvorschrift 22.3 des Neuen Rezeptur-Formulariums (NRF) schreibt als Kennzeichnung vor: „Anwendung nur nach Vorschrift des Arztes“, „Nicht mehr anwenden nach dem …“ (wobei die Aufbrauchfrist 1 Jahr beträgt) und eine Dosierungsvorschrift. Die NRF-Vorschrift enthält in Analogie zur Fachinformation auch Angaben zur Stabilität sowie zu unerwünschten Wirkungen und Anwendungsbeschränkungen, ist allerdings dem Arzt i.d.R. nicht direkt zugänglich.
**Eine Stabilitätsprüfung des Fertigprodukts kann hier entfallen, da die Rezeptur i.d.R. zum unmittelbaren Gebrauch angefertigt wird
Die individuelle Herstellung von Arzneimitteln ist jedoch keineswegs risikolos. Daten zur Stabilität von Ad-hoc-Zubereitungen fehlen. Schwankungen bei Reinheit und Quantität des zubereiteten Inhalts der Wirksubstanz sind nicht mit Sicherheit auszuschließen. Entsprechende Berichte finden sich in der Literatur. Beispielsweise berichteten kanadische Autoren über lebensbedrohliche Überdosierungen von 4-Aminopyridin aufgrund von Apothekenherstellungsfehlern [19]. 4-Aminopyridin ist ebenfalls ein Kaliumkanalblocker, der symptomatisch unter anderem bei multipler Sklerose eingesetzt wird.
Immer wieder verweigerten gesetzliche Krankenkassen die Kostenübernahme für die Leitlinien-gemäße Therapie mit Amifampridin im Rahmen einer Individualrezeptierung. Beispielsweise verurteilte das Sozialgericht Stuttgart im Juni 2009 eine gesetzliche Krankenkasse nach mehrjähriger Auseinandersetzung zur Erstattung der Kosten einer Amifampridin-Therapie bei einem paraneoplastischen Lambert-Eaton-Syndrom [1].
Amifampridin-Phosphat und 3,4-DAP sind im Wesentlichen bioäquivalent bei einer verbesserten Stabilität [20, 23]. Die Phosphatformulierung erhielt am 18. Dezember 2002 vom Europäischen Ausschuss für seltene Arzneimittel (European Committee for Orphan Medicinal Products, COMP) den Status eines „Orphan Drug“ und vor Kurzem die Marktzulassung aufgrund positiver Empfehlung durch die europäische Arzneimittelbehörde (European Medicines Agency, EMA) als Firdapse®, das im April 2010 auch in Deutschland auf dem Markt eingeführt wurde.
Damit stehen die behandelnden Ärzte nun vor der Entscheidung, die zugelassene und nach GMP-Standards hergestellte Phosphatformulierung einzusetzen oder weiterhin mit in Individualrezeptur durch Apotheken hergestellten Amifampridin-Zubereitungen zu behandeln. Juristisch besteht keine zwingende Vorgabe, ob in dieser Situation Fertigarzneimittel oder Rezepturarzneimittel vorzuziehen sind [2]. Dies bedeutet, dass die Entscheidung darüber letztlich beim behandelnden Arzt liegt (Abb. 2).
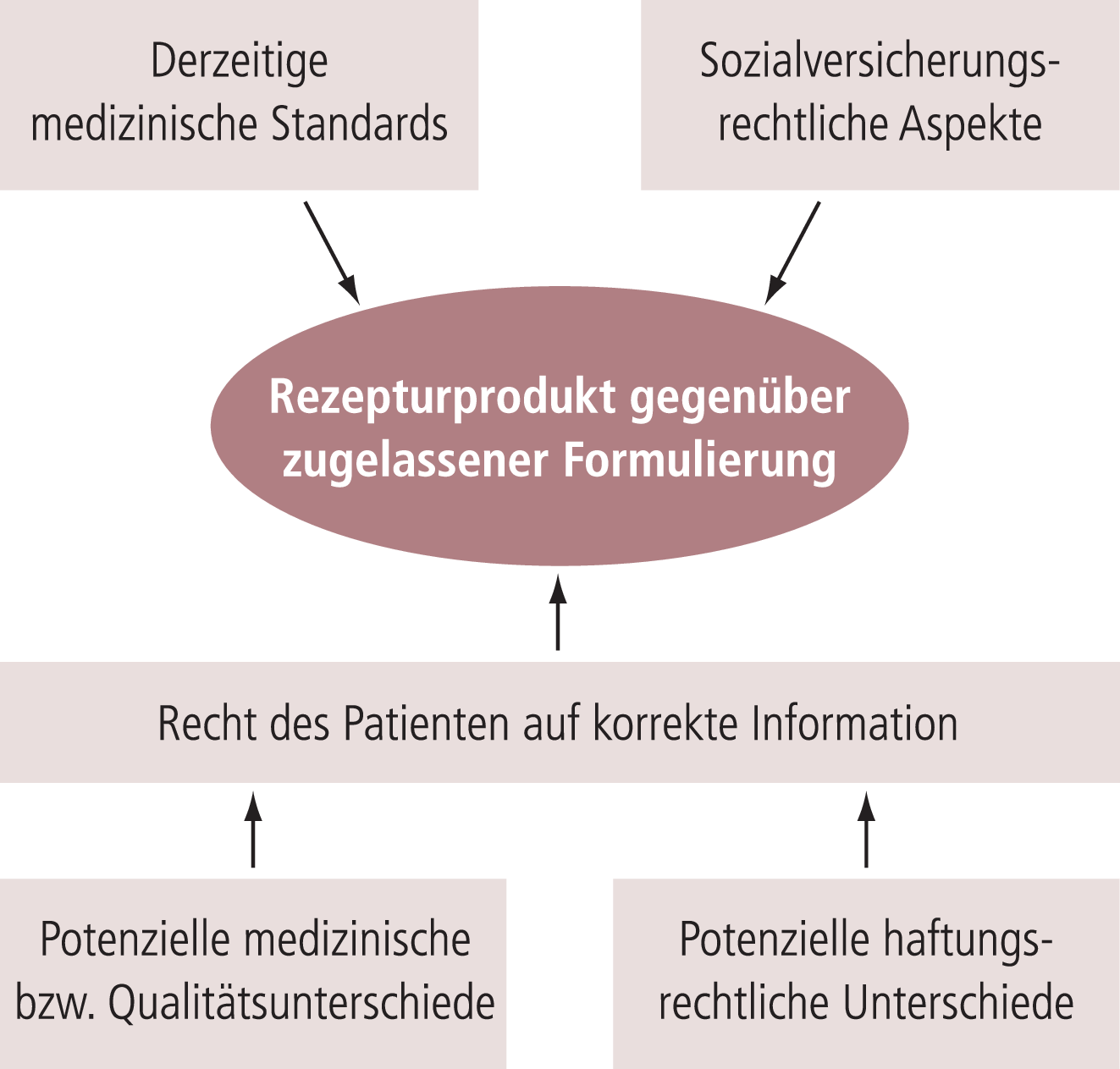
Abb. 2. Faktoren, die die Entscheidung zwischen einem Rezepturarzneimittel und einer lizenzierten Formulierung desselben Arzneimittels für eine Behandlung beeinflussen.
Haftungsrechtliche und ökonomische Aspekte
Bestehen mehrere Therapieoptionen, ist die Wahl der Therapie grundsätzlich Sache des Arztes [7]. Beachten muss der Arzt dabei aber, dass die gewählte Option dem medizinischen Standard entspricht. Standard ist, was im betreffenden Fachgebiet dem gesicherten Stand der medizinischen Wissenschaft entspricht und in der medizinischen Praxis zur Behandlung der jeweiligen gesundheitlichen Störung anerkannt ist [7]. Leitlinien wissenschaftlicher Fachgesellschaften können helfen, diesen Standard zu bestimmen, ihn aber nicht für jeden Einzelfall verbindlich festlegen [8]. Auf das Amifampridin-Beispiel angewandt, bedeutet dies, dass jeder verschreibende Arzt – ausgehend von den verfügbaren Daten – entscheiden muss, ob Amifampridin als Rezeptur und die als Fertigarzneimittel zugelassene Phosphatformulierung die aktuellen medizinischen Standards hinsichtlich Qualität, Wirksamkeit und Sicherheit gleichermaßen erfüllen. Da der Einsatz von Firdapse® zu einer deutlichen Zunahme der Therapiekosten führt, ist ein ökonomischer Druck hin zum Einsatz von Rezepturarzneimitteln jedoch nicht auszuschließen. Die Medikation mit der empfohlenen maximalen Tagesdosis von 60 mg Firdapse® führt zu Jahrestherapiekosten von über 60000,– Euro. Die Kosten für das Rezepturarzneimittel variieren, sie liegen meist im vierstelligen Eurobereich. Die hohen Kosten bei Firdapse® erklären sich unter anderem aus der Verpflichtung, ein europaweites Patientenregister aufzubauen. Rechtlich ist allerdings darauf hinzuweisen, dass eine Unterschreitung des medizinischen Standards aus allein ökonomischen Gründen unzulässig ist [9, 21].
Weiterhin ist das Selbstbestimmungsrecht des Patienten zu berücksichtigen. Differieren nämlich Behandlungsalternativen im Hinblick auf mit ihnen verbundene Risiken, Intensität des Eingriffs, aber auch wirtschaftliche Konsequenzen, so hat der Patient einen Anspruch darauf, darüber unterrichtet zu werden [6]. Vor diesem Hintergrund sehen wir den Arzt verpflichtet, einen Patienten über die Behandlungsoptionen der Wahl eines Amifampridin-Fertigarzneimittels einerseits und der Rezeptur andererseits aufzuklären (Tab. 2).
In wirtschaftlicher Hinsicht sind nicht allein die Arzneimittelkosten relevant, sondern für den Patienten insbesondere auch seine haftungsrechtliche Absicherung im Falle eines Produktfehlers. Wählt der Arzt das Fertigarzneimittel, so haftet das pharmazeutische Unternehmen ohne Rücksicht auf ein etwaiges Verschulden bei bestimmungsgemäßem Gebrauch für Arzneimittel- und Instruktionsfehler [3]. Bei der Wahl eines Rezepturarzneimittels trifft die Produkthaftung den Hersteller und damit zumindest auch den Apotheker [17]. Für den Patienten ist im Regelfall die arzneimittelrechtliche Gefährdungshaftung des pharmazeutischen Unternehmens vorteilhafter. Zum einen hat der Patient gegen den pharmazeutischen Unternehmer einen Auskunftsanspruch, der ihm die Darlegung der haftungsbegründenden Tatsachen erleichtern soll [4]. Zum anderen liegt ein Vorteil für den Patienten darin, dass pharmazeutische Unternehmer einer Haftpflichtversicherungspflicht unterliegen, die die Ansprüche des Patienten finanziell absichert [5]. Demgegenüber sind Apotheker gesetzlich nicht verpflichtet, eine Haftpflichtversicherung abzuschließen. Die meisten Berufsordnungen schreiben eine solche allerdings vor (Tab. 3).
Tab. 3. Regelungen zur Berufshaftpflichtversicherung in den Berufsordnungen der Landesapothekerkammern [gemäß Angaben auf den Websites der Landesapothekerkammern, Stand Juli 2010]
|
Bundesland |
Regelung in der Berufsordnung |
|
Baden-Württemberg |
§16 Abschluss einer Berufshaftpflichtversicherung |
|
Bayern |
§16 Abschluss einer Betriebshaftpflichtversicherung |
|
Berlin |
Keine Regelung |
|
Brandenburg |
Keine Regelung |
|
Bremen |
Keine Regelung |
|
Hamburg |
§11 Mindest-Versicherungssumme gegen Haftpflichtgefahren |
|
Hessen |
§11 Haftungsabsicherung |
|
Mecklenburg-Vorpommern |
§15 Abschluss einer Haftpflichtversicherung |
|
Niedersachsen |
§7 Haftpflichtversicherung |
|
Nordrhein-Westfalen |
Nordrhein Westfalen-Lippe |
|
Rheinland-Pfalz |
§17 Abschluss einer Betriebshaftpflichtversicherung |
|
Saarland |
§15 (Abschluss einer Betriebshaftpflichtversicherung) |
|
Sachsen |
Keine Regelung |
|
Sachsen-Anhalt |
§17 Haftpflichtversicherung |
|
Schleswig-Holstein |
Keine Regelung |
|
Thüringen |
Keine Regelung |
Sozialversicherungsrechtliche Aspekte
Für 90% der deutschen Bevölkerung, die Mitglied der gesetzlichen Krankenversicherung sind, wird die Auswahlentscheidung auch vom Leistungsumfang der Gesetzlichen Krankenversicherung bestimmt, der im Sozialgesetzbuch V (SGB V) geregelt ist. Im SGB V findet sich keine explizite Regelung zum Verhältnis von Fertigarznei- und Rezepturarzneimitteln. Maßgeblich ist vielmehr, welche Behandlung für die Erfüllung des allgemein anerkannten Standes der medizinischen Erkenntnisse ausreichend, zweckmäßig und wirtschaftlich ist, ohne das Maß des Notwendigen zu überschreiten [16, 18].
Nach der Rechtsprechung des Bundessozialgerichts ist mit einer positiven Zulassungsentscheidung auch für die gesetzlichen Krankenkassen verbindlich entschieden, dass Qualität, Wirksamkeit und Unbedenklichkeit des Arzneimittels gewährleistet sind. Mit der arzneimittelrechtlichen Zulassung fällt ein Fertigarzneimittel also in den Kreis prinzipiell erstattungsfähiger Therapien [10].
An die Stelle des die Qualitätsstandards sichernden behördlichen Zulassungsverfahrens tritt bei Rezepturarzneimitteln wie bei jeder neuen Behandlungsmethode eine positive Empfehlung des Gemeinsamen Bundesausschusses [12]. Da sich der Gemeinsame Bundesausschuss mit der Behandlung des Lambert-Eaton-Syndroms mit Amifampridin bislang nicht befasst hat, sind die Voraussetzungen für eine Leistungspflicht der gesetzlichen Krankenversicherung im Falle der Verordnung als Rezeptur also zumindest zweifelhaft. Demgegenüber besteht eine Leistungspflicht der gesetzlichen Krankenversicherung für das zugelassene Fertigarzneimittel Firdapse®.
Allerdings können in Einzelfällen Ausnahmen von dieser Regel gemacht werden: Im Falle von äußerst seltenen Krankheiten [11] oder bei akut lebensbedrohlicher Krankheitssituation [15] müssen die gesetzlichen Krankenkassen Rezepturarzneimittel erstatten, die nicht vom Gemeinsamen Bundesausschuss empfohlen wurden, wenn es keine arzneimittelrechtlich zugelassenen oder vom Gemeinsamen Bundesausschuss empfohlenen therapeutischen Alternativen gibt [12, 14].
Wendet man diese Vorgaben auf unser Beispiel an, so lassen sich folgende Schlussfolgerungen ziehen: In der Vergangenheit wurden individuell rezeptierte Amifampridin-Ausgangsprodukte von den gesetzlichen Krankenkassen erstattet beziehungsweise hätten erstattet werden sollen, obwohl es keine Empfehlung vom Gemeinsamen Bundesausschuss gab [1], da aufgrund der Seltenheit des Lambert-Eaton-Syndroms und wegen des Fehlens zugelassener Alternativen eine Ausnahme von den Rechtsprechungsgrundsätzen gegeben war. Mit der Verfügbarkeit von Amifampridin-Phosphat als zugelassenem Fertigarzneimittel ist diese Ausnahme jedoch nicht mehr gegeben. Folglich müssen von nun an die gesetzlichen Krankenkassen nur die zugelassenen Firdapse®-Tabletten erstatten, während die Erstattung von Wirkstoffen als Rezeptur nicht länger verpflichtend ist. Wirtschaftliche Überlegungen sind hier nicht relevant [13].
Schlussfolgerung
Bis zum Frühjahr 2010 musste Amifampridin von Apotheken zubereitet werden. Die nunmehr europaweit unter dem Orphan-Drug-Status zugelassenen Amifampridin-Phosphat-Tabletten (Firdapse®) werden demgegenüber stets unter GMP-Bedingungen hergestellt. Die Firdapse®-Medikation ist jedoch mit einer deutlichen Zunahme der Therapiekosten verbunden. Dennoch müssen die gesetzlichen Krankenversicherungen die Kosten für die zugelassenen Amifampridin-Phosphat-Tabletten im Rahmen der Therapie eines Lambert-Eaton-Syndroms übernehmen, während dies für die individuell rezeptierten Ausgangsprodukte nicht mehr der Fall ist.
Erklärung finanzieller und anderer Beziehungen
Prof. Dr. med. Jörn Peter Sieb hat Vortrags-, Autoren- und Beraterhonorare von diversen pharmazeutischen Unternehmen (darunter BioMarin, Meda Pharma und Temmler) erhalten und war auch als Sachverständiger im Rahmen der Arzneimittelzulassung tätig. Weiterhin ist er Mitglied im Ärztlichen Beirat der Deutschen Myasthenie Gesellschaft.
Dr. iur. Gerhard Nitz hat verschiedene rechtliche Gutachten für diverse Pharma- und Medizinprodukteunternehmen (darunter BioMarin) sowie für Ärzte erstellt und in ihrem Auftrag verschiedene Prozesse geführt.
Danksagungen
Dieser Artikel wurde durch einen ‚unrestricted grant‘ (Zuschuss ohne Auflagen) von BioMarin Europe Ltd. unterstützt. Die Autoren bedanken sich bei Ismar Healthcare NV (Lier, Belgien) für die Sekretariatshilfe bei der Manuskripterstellung.
Literatur
1. Sozialgericht Stuttgart; 30.06.2009 – S KR 2844/06.
2. Arzneimittelgesetz §4 Para. 1.
3. Arzneimittelgesetz §84 Para. 1.
4. Arzneimittelgesetz §84a.
5. Arzneimittelgesetz §94.
6. Bundesgerichtshof; 22. Februar 2000 – VI ZR 100/99.
7. Bundesgerichtshof; 22. September 1987 – VI ZR 238/86.
8. Bundesgerichtshof; 28. März 2008 – VI ZR 57/07.
9. Bundesgerichtshof; 5. Oktober 1993 – VI ZR 237/92.
10. Bundessozialgericht; 19. März 2002 – B 1 KR 37/00 R.
11. Bundessozialgericht; 19. Oktober 2004 – B 1 KR 27/02 R.
12. Bundessozialgericht; 23. Juli 1998 – B 1 KR 19/96 R.
13. Bundessozialgericht; 26. September 2006 – B 1 KR 1/06 R.
14. Bundessozialgericht; 27. März 2007 – B 1 KR 30/06 R.
15. Bundessozialgericht; 4. April 2006 – B 1 KR 7/05 R.
16. Bundessozialgericht; 8. März 1995 – 1 RK 8/94.
17. Produkthaftungsgesetz §1.
18. Sozialgesetzbuch V §§2 Para. 1 Cl. 3, 12 Para. 1.
19. Burton JM, Bell CM, Walker SE, O’Connor PW. 4-aminopyridine toxicity with unintentional overdose in four patients with multiple sclerosis. Neurology 2008;71:1833–4.
20. Demolis JL, Strabach S, Vacheron F, Funck-Brentano C. Assessment of the effect of a single oral dose of telithromycin on sotalol-induced QT interval prolongation in healthy women. Br J Clin Pharmacol 2005;60:120–7.
21. Kullmann HJ. Übereinstimmungen und Unterschiede im medizinischen, haftungsrechtlichen und sozialversicherungsrechtlichen Begriff des medizinischen Standards. Versicherungsrecht 1997:529–32.
22. Quartel A, Turbeville S, Lounsbury D. Current therapy for Lambert-Eaton myasthenic syndrome: development of 3,4-diaminopyridine phosphate salt as first-line symptomatic treatment. Curr Med Res Opin 2010;26:1363–75.
23. Raust JA, Goulay-Dufay S, Le Hoang MD, Pradeau D, et al. Stability studies of ionised and non-ionised 3,4-diaminopyridine: hypothesis of degradation pathways and chemical structure of degradation products. J Pharm Biomed Anal 2007;43:83–8.
24. Sieb JP, Schrank B. Neuromuskuläre Erkrankungen. Stuttgart: Kohlhammer, 2009.
25. Sieb JP, Veauthier C. Lambert-Eaton-Syndrom – Aktuelles zu Diagnose und Therapie. Klin Neurophysiol 2008;39:208–18.
Prof. Dr. Jörn P. Sieb, Chefarzt der Klinik für Neurologie, Geriatrie und Palliativmedizin, Hanse-Klinikum, Große Parower Straße 47–53, 18410 Stralsund, E-Mail: j.sieb@klinikum-hst.de Dr. jur. Gerhard Nitz, Dierks + Bohle Rechtsanwälte, Walter-Benjamin-Platz 6, 10629 Berlin
Medicolegal problems arising from the treatment of rare disorders: Use of amifampridine in Lambert-Eaton myasthenic syndrome
Background: Lambert-Eaton myasthenic syndrome (LEMS) is a rare autoimmune disease with disturbed neuromuscular transmission. Amifampridine (3,4-diaminopyridine [3,4-DAP]) is according to the guidelines a recommended treatment, which up till now was only clinically available as recipe medicine prepared in individual pharmacies. Recently, a new phosphate salt formulation has been approved as finished medicine. This review discusses the medicolegal framework when choosing between a recipe medicine and an approved finished medicine, with amifampridine as example.
Method: MEDLINE and EMBASE retrieved publications, data submitted to obtain approval of amifampridine phosphate and German legislation were reviewed.
Results: Although treatment with amifampridine is in line with guidelines, before the approval of the finished medicine, social health insurance companies frequently refused to refund the costs of amifampridine. When prepared as individual recipe, the costs of amifampridine are considerably lower but this is also associated with distinctive risks. The advantages of the finished medicines are uniform drug quality, a solvent debtor in case of product defects and the liability of the social health insurance company. Patients should be informed about these aspects.
Conclusion: There exists no legal obligation to prescribe finished medicines. The choice between amifampridine prepared in individual pharmacies and the licensed amifampridine phosphate tablets stays finally with the treating physician and his patient based on the described medicolegal and economical aspects.
Key words: 3,4-diaminopyridine, drug compounding, drug therapy, Lambert-Eaton myasthenic syndrome, legal liability, social security
Psychopharmakotherapie 2010; 17(05)
