Dr. Tanja Saußele, Stuttgart
In Deutschland leiden etwa 130000 Menschen an multipler Sklerose. Davon sind etwa zwei Drittel Frauen. Bei der multiplen Sklerose handelt es sich um eine T-Zell-vermittelte Autoimmunerkrankung.
Oft verläuft die Erkrankung in den ersten sieben bis zehn Jahren schubförmig remittierend, bevor ein sekundär progredienter Verlauf eintritt.
Zu den Standardtherapeutika bei der schubförmig remittierenden multiplen Sklerose gehören Interferon-beta-Präparate (z. B. Avonex®) und Glatirameracetat (Copaxone®).
Bei Patienten mit einer hohen Krankheitsaktivität, trotz einer Interferon-beta-Therapie, oder einem rasch fortschreitenden schubförmig rezidivierenden Verlauf stellen Mitoxantron (Ralenova®) und Natalizumab (Tysabri®) eine wirksame Option dar.
Die multiple Sklerose bleibt jedoch weiterhin eine große therapeutische Herausforderung und neue Therapieansätze, die ebenfalls in die Pathophysiologie der Erkrankung eingreifen, sind notwendig. Denn zum einen tritt mit den verschiedenen Medikamenten nicht bei allen Patienten eine Remission ein und zum anderen kann die parenterale Verabreichung dieser Medikamente mit Nebenwirkungen wie lokalen Reaktionen an der Einstichstelle und einer verminderten Compliance verbunden sein.
Fumarsäureester
Bereits seit 1994 werden Fumarsäureester (Fumaderm®) bei der Behandlung der Psoriasis eingesetzt. Für den Fumarsäureester Dimethylfumarat (DMF) wurde eine immunsupprimierende Wirkung nachgewiesen. In klinischen Studien zeigte sich eine Abnahme der peripheren Blutleukozyten durch DMF, die vermutlich durch Apoptose-Induktion in T-Zellen ausgelöst wird.
In Zellkulturmodellen konnte gezeigt werden, dass DMF (BG-12) über eine Translokation des Transkriptionsfaktors Nrf2 vom Zytoplasma in den Zellkern die Transkriptionsaktivierung und die Synthese verschiedener Proteine induziert (Abb. 1). Die Induktion der Hämoxigenase-1-Synthese führt beispielsweise zu einer Verringerung der proinflammatorischen Zytokine Tumornekrosefaktor alpha (TNF-a), Interleukin(IL)-12 und Interferon gamma (IFN-g). In Rattengliazellen konnte ein neuroprotektiver Effekt über eine verstärkte Expression der NAD(P)H-Chinonreduktase (NQO-1) und eine Verringerung der TNF-a, IL-1β- und IL-6-Expression nachgewiesen werden.
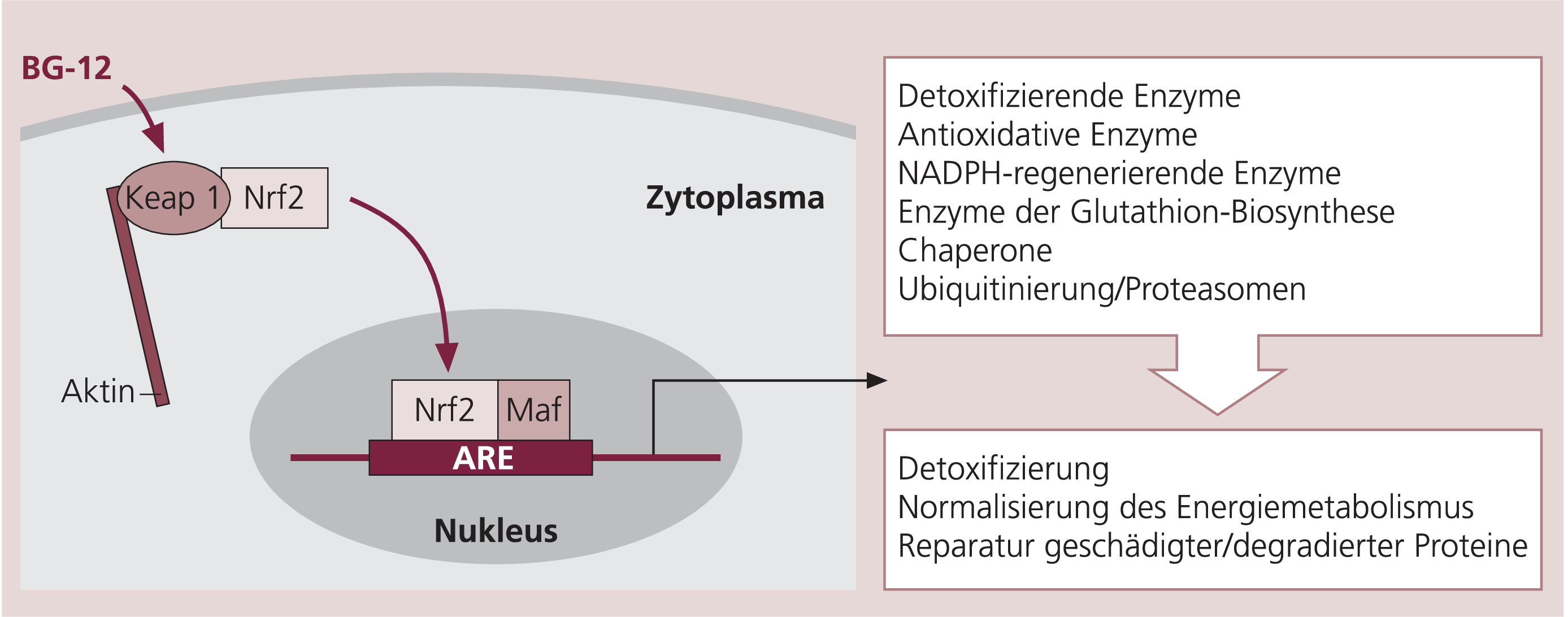
Abb. 1. Aktivierung des Nrf2-Signalwegs durch BG-12.
Im Zytoplasma wird der Transkriptionsfaktor Nrf2 (NF-E2 related factor 2) durch die Bindung an Keap 1 (Kelch-like ECH associating protein 1) am Zytoskelett festgehalten. Durch die Bindung von BG-12 an Keap1 wandert der Transkriptionsfaktor Nrf2 in den Zellkern. Dort findet eine Dimerisierung mit beispielsweise Proteinen der Maf(musculoaponeurotic fibrosarcoma)-Familie statt und es kommt zur Bindung an das ARE (antioxidant response element) im Promotor der DNS. Dadurch wird die Transkription verschiedener Gene induziert.
Der Zusammenhang von Nrf2 und multipler Sklerose konnte an Knock-out-Mäusen gezeigt werden. Nrf2-Knock-out-Mäuse sind durch eine Degeneration der weißen Substanz im ZNS gekennzeichnet.
Studien
In einer doppelblinden und Plazebo- kontrollierten Phase-II-Studie mit 257 Patienten mit einer schubförmig remittierenden multiplen Sklerose wurde die Wirksamkeit von BG-12 untersucht. Die Patienten wurden für 24 Wochen wie folgt behandelt:
- 120 mg 1x/d (n=59)
- 120 mg 3x/d (n=56)
- 240 mg 3x/d (n=54)
- Plazebo (n=54)
Nach dieser Behandlungsphase wurden die Patienten 24 Wochen verblindet weiterbehandelt, wobei die Patienten der Plazebo-Gruppe mit der höchsten Dosis von 720 mg BG-12 täglich behandelt wurden. Der primäre Endpunkt war die Anzahl der mit Gadolinium(Gd)-angereicherten Läsionen in 4-wöchentlichen MRT-Untersuchungen.
Die Abnahme der Gd-positiven Läsionen war dosisabhängig. Die Patienten in der Gruppe mit der höchsten Dosierung (720 mg/d) hatten nach 24 Wochen eine 69%ige Reduktion der Gd-positiven Herde im Vergleich zu Plazebo (p<0,001).
Häufige unerwünschte Wirkungen waren Kopfschmerzen, gastrointestinale Beschwerden und Flush. Bei BG-12 handelt es sich, im Gegensatz zu dem Fumarsäureester-Gemisch Fumaderm®, ausschließlich um den Dimethylester der Fumarsäure. Dadurch und durch den magensaftresistenten Überzug kommt es seltener zu gastrointestinalen Beschwerden als bei der Psoriasis-Therapie. Bei einer Hochdosis-Therapie wurde bei Ratten eine Nierentoxizität beobachtet. Bislang gibt es bei den Humanstudien keine Hinweise darauf; die Nierenfunktion wird dennoch überwacht.
Aufgrund der positiven Ergebnisse für die Wirksamkeit von BG-12 werden derzeit zwei multizentrische Phase-III-Studien durchgeführt. In der DEFINE-Studie (Determination of efficacy and safety of oral fumarate in relapsing-remitting MS) und der CONFIRM-Studie (Comparator and an oral fumarate in relapsing-remitting MS) werden unterschiedliche Dosierungen von BG-12 bei neu erkrankten Patienten mit multipler Sklerose und solchen, die eine Interferon-beta-Therapie abgebrochen haben, für eine Dauer von 2 Jahren untersucht. In der CONFIRM-Studie wird zusätzlich in einem Arm die Therapie mit Glatirameracetat verglichen.
Fazit
Fumarsäureester werden bereits erfolgreich in der Psoriasis-Therapie eingesetzt. Die Reduktion der Gd-positiven Herde durch den oral applizierbaren Wirkstoff BG-12 bei Patienten mit einem schubförmigen Verlauf der multiplen Skerose konnte in einer Phase-II-Studie belegt werden. Die nun beginnenden Phase-III-Studien sollen die Wirksamkeit dieser Substanz, auch im Vergleich zu einer Standardtherapie mit Glatirameracetat, zeigen. Eine Therapie mit BG-12 könnte aufgrund des alternativen Wirkungsmechanismus das Therapiespektrum, gerade auch für eine Kombinationstherapie, erweitern und durch seine orale Applizierbarkeit die Compliance der Patienten erhöhen. Dies ist insbesondere vor dem Hintergrund, dass etwa 20 bis 30% der Patienten bereits in den ersten sechs Monaten die Therapie abbrechen, interessant.
Quellen
Prof. Dr. Alfred Sandrock, Cambridge, USA, Prof. Dr. Ralf Gold, Bochum. Pressegespräch „Zukunft der multiple Sklerose-Therapie: orales Fumarsäureester BG-12 aus der Biogen Idec Pipeline “, Frankfurt, 4. April 2008, veranstaltet von Biogen Idec GmbH.
Stangel M, et al. Fumarat in der Behandlung der multiplen Sklerose. Nervenarzt 2008;79: 212–7.
Psychopharmakotherapie 2008; 15(05)
