Astrid Gendolla und Hans Christoph Diener, Essen
Indikation der Migräneprophylaxe
Die Indikation zur Migräneprophylaxe ergibt sich aus der Einschränkung der Lebensqualität der Betroffenen, dem Verlust von Arbeitszeit oder der Zeit, häuslichen Verpflichtungen oder Freizeitaktivitäten nachzugehen. Tabelle 1 zeigt die Empfehlungen der Deutschen Gesellschaft für Neurologie zur Migräneprophylaxe [4].
Tab. 1. Indikationen zur Migräneprophylaxe [4]
|
3 oder mehr Migräneattacken pro Monat |
|
Migräneattacken, die regelmäßig länger als 72 Stunden andauern |
|
Attacken, die auf eine Therapie entsprechend den Empfehlungen der Deutschen Gesellschaft für Neurologie und Deutsche Migräne- und Kopfschmerzgesellschaft nicht ansprechen und/oder wenn Nebenwirkungen der Akuttherapie nicht toleriert werden |
|
Bei Zunahme der Attackenfrequenz und Einnahme von Schmerzmitteln an mehr als 10 Tagen pro Monat |
|
Bei komplizierten Migräneattacken mit lang anhaltenden Auren |
Ziel der medikamentösen Prophylaxe ist die Reduktion der Häufigkeit, Schwere und Dauer der Migräneattacken sowie die Prophylaxe des medikamenteninduzierten Dauerkopfschmerzes. Nach Kriterien der internationalen Kopfschmerzgesellschaft ist eine Prophylaxe wirksam, wenn die Attackenhäufigkeit oder die Zahl der Tage mit Migräne um mindestens 50% reduziert wird [22]. Patienten sollten realistisch über die Möglichkeiten einer Prophylaxe aufgeklärt und dazu angehalten werden ein Kopfschmerztagebuch zu führen, um den Erfolg oder ausbleibenden Erfolg der Prophylaxe zu dokumentieren. Üblicherweise ist eine Prophylaxe nach sechs bis acht Wochen wirksam. Patienten sollten über diese Zeitverzögerung nach Einnahme aufgeklärt werden. Bei Nichtansprechen auf prophylaktische Therapie kommt neben einer falschen Diagnose oder zu niedriger Dosierung auch ein anhaltend hoher Medikamentenkonsum im Rahmen der Akuttherapie infrage.
Optionen in der Migräneprophylaxe
Die meisten klinischen Studien zur Prophylaxe der Migräne liegen für Betablocker und den Calciumkanalblocker Flunarizin vor [4]. Der Wirkungsmechanismus beider Substanzen ist weitgehend unklar. 1995 wurden die ersten Studien zu Membranstabilisatoren (Valproinsäure) durchgeführt, mittlerweile ist deren Wirksamkeit in Plazebo-kontrollierten Studien belegt worden [8, 10, 11, 14, 17]. Vergleichsstudien zu anderen Migräneprophylaktika gibt es nicht. Valproinsäure ist in Deutschland zur Migräneprophylaxe nicht zugelassen.
Frühe Studien zur Migräneprophylaxe mit Topiramat
In einer ersten, Plazebo-kontrollierten, doppelblinden Phase-II-Studie wurden 40 Patienten zwischen 19 und 62 Jahren integriert [21]. Nach einer vierwöchigen Baseline-Phase wurde Topiramat in einer Dosis von 25 mg/d eingesetzt und bis zu einer Maximaldosis von 200 mg/d auftitriert beziehungsweise bei der Dosis stabil gehalten, die vom Patienten in Bezug auf Nebenwirkungen toleriert wurde. Dieser Phase schloss sich eine Erhaltungsphase von acht Wochen an. Primärer Zielparameter war die Reduktion der Migränehäufigkeit bezogen auf 28 Tage. In der Verum-Gruppe traten in der Baseline-Phase 5,14 Migräneattacken auf, in der Behandlungsphase wurde die Häufigkeit auf 3,31 Tage reduziert. Im Vergleich dazu lag in der Plazebo-Gruppe die initiale Häufigkeit der Migräneattacken bei 4,37 und wurde auf 3,83 verringert. Dieser Unterschied war statistisch signifikant. 26% der Patienten waren Responder unter Topiramat, 9,5% unter Plazebo. In dieser Studie wurde bereits das Ansprechkriterium einer 50%iger Reduktion der Migränehäufigkeit benutzt. Die mittlere Tagesdosis von Topiramat in dieser Studie betrug 125 mg. Zwei Patienten brachen die Studie wegen Nebenwirkungen ab. Trotz methodischer Mängel (kleine Patientenzahl, monozentrisch, andere Prophylaxe parallel erlaubt) erbrachte die Studie einen Hinweis darauf, dass Topiramat in der Migräneprophylaxe wirksam ist.
In einer offenen Studie wurden die Kopfschmerztagebücher von 74 Migränepatienten, die über sechs Wochen mit Topiramat behandelt wurden, untersucht [24]. 50 Patienten dieser Gruppe hatten an mehr als der Hälfte der Tage eines Monats Migräneattacken. Auch hier lag die Anfangsdosis bei 25 mg/d, die mittlere Enddosis bei 200 mg/d. Die mittlere Zahl der Kopfschmerztage ging von 20,6 Tage auf 3,6 Tage zurück, die Anprechrate betrug in dieser Studie 44,6% (episodische Migräne: 58,3%; chronische Migräne: 38%). Die mittlere Abnahme des Körpergewichts betrug durchschnittlich 3,1 kg, 58% aller Patienten dieser Studie klagten über Nebenwirkungen, davon 25% über Parästhesien und 14% über kognitive Störungen.
Phase-III-Studien
In drei großen, Plazebo-kontrollierten, randomisierten, doppelblinden Studien wurde die Wirksamkeit von Topiramat in der Migräneprophylaxe kontrolliert untersucht. Allen Studien gemeinsam war eine große Patientenzahl, eine Eindosierungsphase sowie eine lange Beobachtungszeit. Die erste Studie wurde an 49 Zentren in den USA durchgeführt [18]. Patienten zwischen 12 und 65 Jahren mit 3 bis 12 Migränetagen pro Monat wurden in diese Studie integriert. Nach einer Baseline-Phase von 28 Tagen wurden die Patienten von einer Initialdosis von 25 mg/d in Dosisschritten à 25 mg pro Woche auf eine Zieldosis von maximal 200 mg Topiramat pro Tag oder Plazebo aufdosiert und dann über acht Wochen weiter verfolgt (Abb. 1). Primäres Zielkriterium war die Reduktion der monatlichen Migränehäufigkeit über sechs Monate. Sekundäre Endpunkte waren die Ansprechrate (Abnahme der monatlichen Migränefrequenz um mehr als 50%, Zeit bis zum Wirkungseintritt, mittlere Änderung der Häufigkeit der Migränetage pro Monat sowie die Einnahme von Akutmedikation). In dieser Studie wurden 778 Patienten randomisiert, 496 Patienten gingen in die Intention-to-treat-Analyse ein. Bei den Zieldosisgruppen 100 mg/d und 200 mg/d Topiramat kam es zu einer statistisch signifikanten Abnahme der monatlichen Migränehäufigkeit von 5,4 auf 3,3 beziehungsweise 5,6 auf 3,3 (p<0,01). Die Attackenfrequenz unter Plazebo nahm von 5,6 auf 4,6 ab. Die Wirkung der 50-mg-Dosierung war nicht statistisch signifikant gegenüber Plazebo. Der Wirkungseintritt der Substanz wurde bereits nach dem ersten Behandlungsmonat verzeichnet. Die Ansprechrate für 50 mg Topiramat lag bei 35,9%, für 100 mg bei 54% und für 200 mg bei 52,3%. In der Dosierung 100 bzw. 200 mg/d waren Parästhesien (47%), Müdigkeit (11–18%), Übelkeit (14–16%), Appetitlosigkeit (13–14%), Geschmacksstörungen (10–14%), Gedächtnisstörungen (2–12%) sowie Gewichtsverlust (9–12%) auffällig. In dieser Studie wurde belegt, dass in der 200-mg-Zieldosisgruppe ein ungünstiges Verhältnis von Wirkung und Nebenwirkung auftrat.
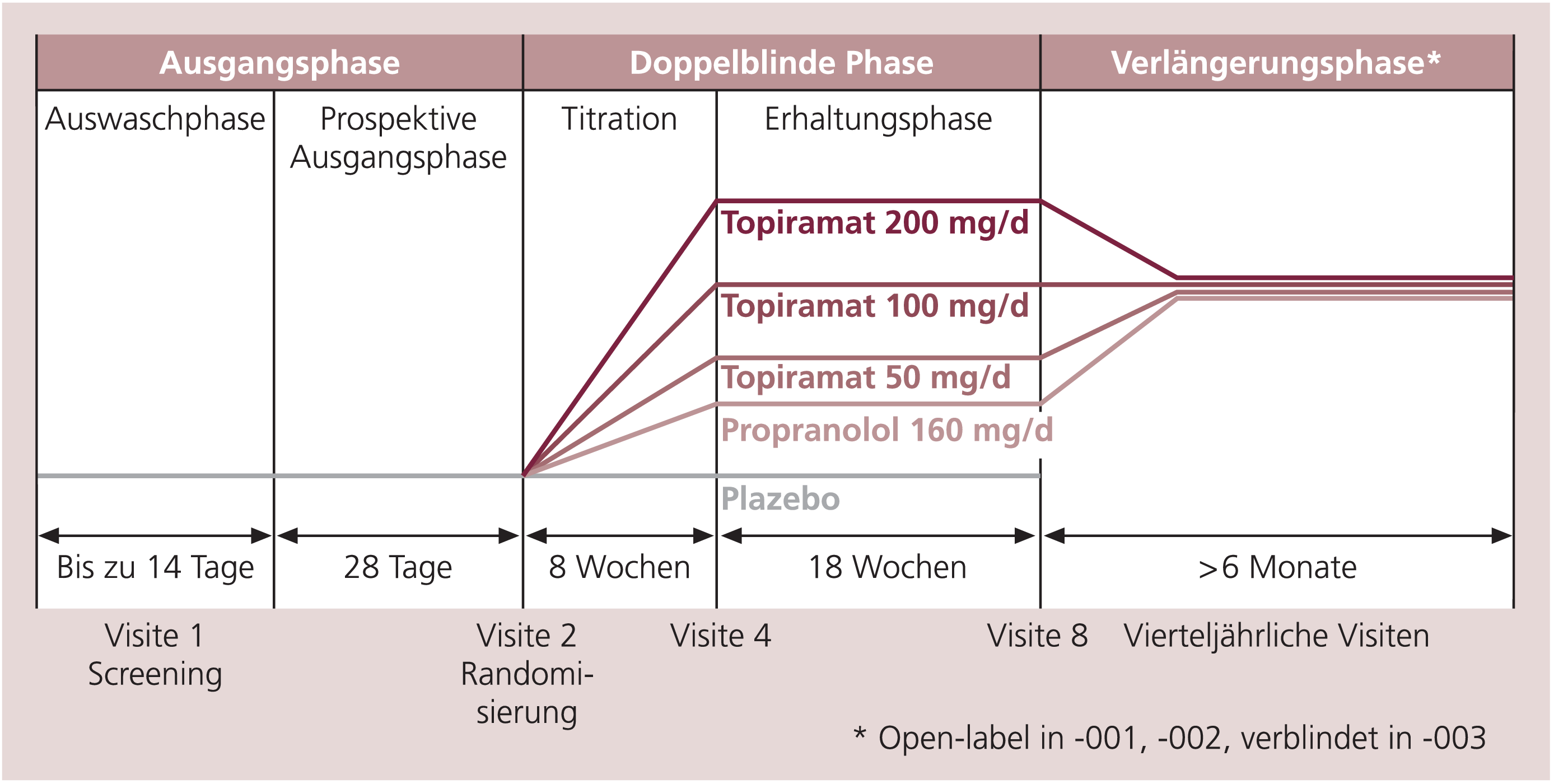
Abb. 1. Darstellung des Studiendesigns in den drei Phase-III-Studien (MIGR-001, -002, -003) zur Wirksamkeit von Topiramat in der Migräneprophylaxe
In der zweiten Studie wurden ebenfalls Patienten zwischen 12 und 65 Jahren integriert, diese mussten seit sechs Monaten an Migräne leiden und durften zwischen 3 und 12 Migränetage pro Monat haben [2]. Auch hier wurde zunächst die Häufigkeit in einer 28-tägigen Baseline-Periode erfasst, die Eindosierungsphase über acht Wochen verlief wie in Studie 1. Die angestrebten Zieldosen betrugen 50, 100 und 200 mg Topiramat oder Plazebo pro Tag. Nach der 18-wöchigen Behandlungsphase folgte eine sechsmonatige, offene Nachfolgestudie. Die Patienten dokumentierten die Zahl der Migränetage über den gesamten Zeitraum. Primäres Zielkriterium dieser Studie war die Reduktion der Migränehäufigkeit in der gesamten Behandlungsphase verglichen mit der 28-tägigen Baseline-Phase. In die Studie wurden 483 Patienten aufgenommen, von 468 Patienten konnten die Daten ausgewertet werden.
In dieser Studie war die Dosis 50 mg Topiramat wirksamer als Plazebo, was sich jedoch nicht als statistisch signifikant widerspiegelte. 100 und 200 mg Topiramat waren statistisch signifikant Plazebo überlegen. 100 mg Topiramat führte zu einer Reduktion von 2,1 Migräneattacken pro Monat, Topiramat 200 mg zu 2,4 Migräneattacken weniger. Plazebo reduzierte die Migräne um 1,1 Attacken. Auch in dieser Studie war der Wirkungseintritt von Topiramat gegen Ende des ersten Behandlungsmonats auffällig. Die Anprechrate betrug 39% für 50 mg Topiramat, 49% für 100 mg und 47% für 200 mg, der Plazeboeffekt lag bei 23%. Für das Zielkriterium Ansprechrate waren alle Dosierungen von Topiramat statistisch signifikant Plazebo überlegen. Die sekundären Zielkriterien (Reduktion der Migränetage und der eingenommen Akutmedikation) waren auch statistisch signifikant Plazebo überlegen für die Dosierung 100 und 200 mg pro Tag. Die auch hier beschriebenen Nebenwirkungen waren Parästhesien, Müdigkeit, Appetitlosigkeit, Durchfall und Gedächtnisstörungen sowie Übelkeit und Geschmacksstörungen.
Diener et al. präsentierten beim diesjährigen Kongress der European Headache Federation (EHF) als Poster die Ergebnisse der offenen Langzeitbehandlung mit Topiramat zur Migräneprophylaxe. 567 Patienten der ersten beiden Studien wurden in die offene Verlängerungsphase aufgenommen und konnten sich bis zu acht Monate lang weiter mit der Medikation behandeln (insgesamt 14 Monate). In dieser Population konnte überzeugend dargelegt werden, dass die andauernde Reduktion der Migränehäufigkeit auch nach der sechsmonatigen Erhaltungsphase im weiteren Verlauf bestehen bleibt. Dies ist die erste prospektive Studie zu einer Migräneprophylaxe im Langzeitverlauf. Die Autoren beschreiben, dass Nebenwirkungen gering und gut von Patienten toleriert waren [6].
Die dritte Studie integrierte Prüfzentren in Europa und wurde mit einer aktiven Vergleichssubstanz durchgeführt [5]. 575 Patienten bekamen Plazebo, 100 mg Topiramat, 200 mg Topiramat oder 160 mg Propranolol als Vergleichssubstanz. Die Studie verlief über sechs Monate. Das Aufdosierungsschema erfolgte analog den beiden anderen Studien. Die Reduktion der Migräneattacken unter 100 mg Topiramat war signifikant Plazebo überlegen, die Reduktion der Migräneattacken unter 200 mg verfehlte jedoch das Signifikanzniveau. Der Grund hierfür liegt in der hohen Anzahl von Patienten, die wegen Nebenwirkungen dieser Dosis die Studie abbrachen. Propranolol war ebenfalls Plazebo signifikant überlegen. Die Ansprechrate betrug für Plazebo 22%, für Topiramat 37% (100 mg) und 35% (200 mg) sowie 43% für Propranolol 160 mg. Die Autoren dieser Studie folgern, dass die Effektivität von Topiramat der von Propranolol vergleichbar ist.
Metaanalysen
In einer Metaanalyse wurden die Dosierungsgruppen mit 100 mg Topiramat aus den drei Phase-III-Studien zusammengefasst [19]. Ausgewertet wurden die Daten von 384 Patientinnen und Patienten (86% Frauen, mittleres Alter 40 Jahre), die mit 372 Patientinnen und Patienten aus den Plazebo-Gruppen verglichen werden konnten. Für die Dosis 100 mg zeigte sich eine signifikante Reduktion der Attackenfrequenz pro Monat um 1,7 Attacken im Vergleich zu Plazebo (0,8 Attacken, Abb. 2). Prozentual reduziert Topiramat 100 mg die monatliche Attackenfrequenz um 48%, während Plazebo in dieser Metaanalyse die Attackenfrequenz um 24,3% reduzierte. Die Ansprechrate (50%ige Reduktion der Migränehäufigkeit) betrug in dieser Metaanalyse 48,8% für Topiramat versus 24,9% für Plazebo. Der Nachteil dieser Metaanalyse liegt darin, dass Patienten in diesen Studien bei Nebenwirkungen auch niedrige Dosen einnehmen konnten und somit die effektiv eingenommenen Dosen von Topiramat niedriger waren als ursprünglich vorgesehen. Diesem Umstand trägt eine zweite Metaanalyse Rechnung, in der die tatsächlichen Dosierungen ausgewertet wurden. In der Dosierung 50 mg lag die Ansprechrate bei 40%, für 50 bis 75 mg pro Tag bei 45%, für 75 bis 100 mg pro Tag bei 44% und für Dosierungen über 125 mg pro Tag bei 46%.
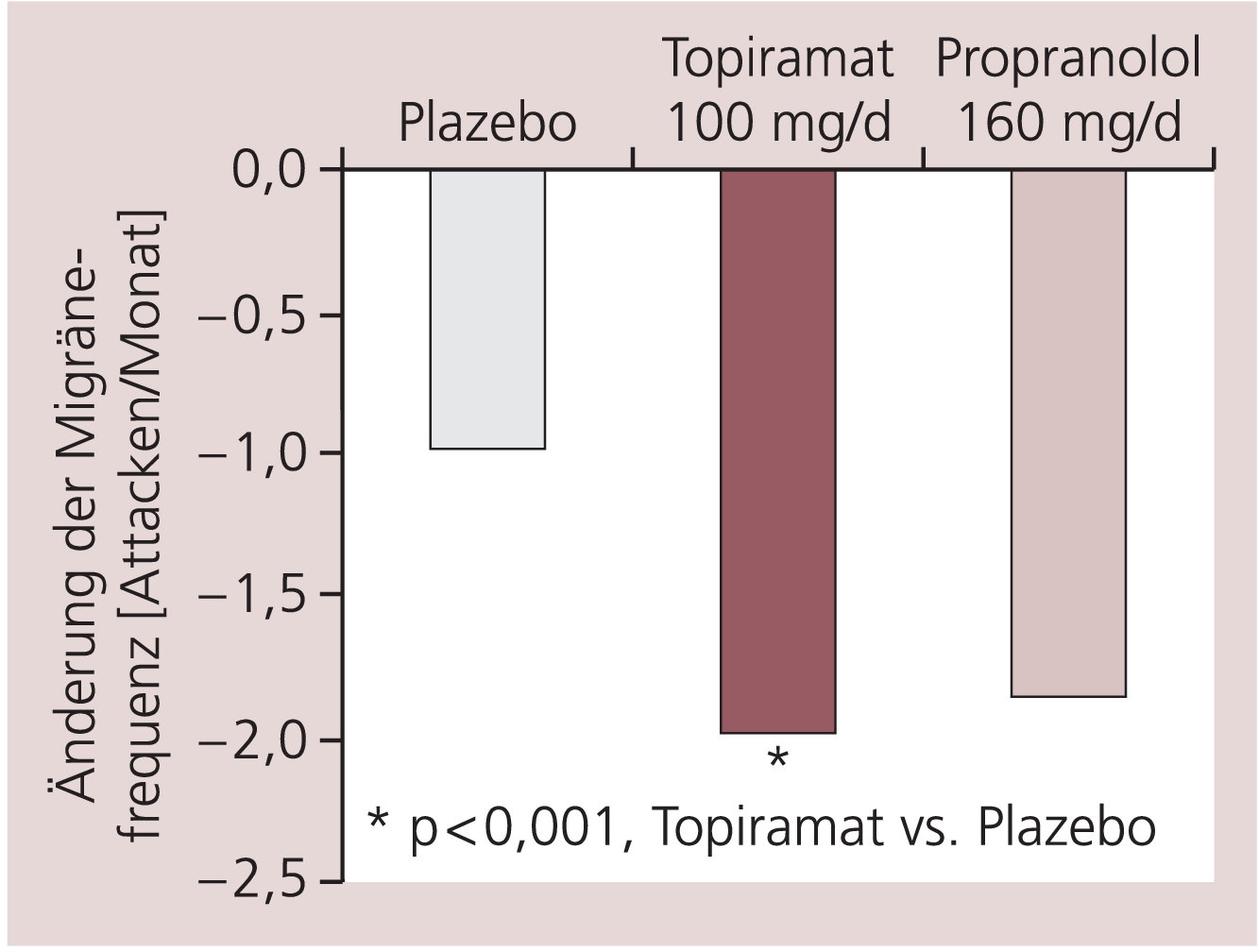
Abb. 2. Reduktion der monatlichen Migränefrequenz (Mittelwerte). Gepoolte Analyse aus den drei Phase-III-Studien für Plazebo, Topiramat 100 mg/d und Propranolol [mod. nach 2, 5, 15]
In einer weiteren Metaanalyse [9] wurde die Geschwindigkeit des Wirkungseintritts von Topiramat untersucht. Hier konnte gezeigt werden, dass in den (jeweils aufgrund der Titrationsphase kombinierten) 50- und 100-mg-Gruppen bereits in den ersten vier Wochen nach Behandlungsbeginn ein Unterschied im Vergleich zu Plazebo in der prozentualen Abnahme der errechneten, wöchentlichen Migränefrequenzen auftrat; dieser Trend setzte sich im weiteren Verlauf fort (Abb. 3). Eine auffällige Beobachtung war, dass bei einer Prophylaxe mit Topiramat möglicherweise eine Akuttherapie besser wirksam sein könnte, dies wurde von Dodick [7] vorgestellt. Patienten, die sich im Verlauf einer Topiramat-Behandlung mit Serotonin-1B/1D-Agonisten („Triptanen“) behandelten, konnten durch diese Akuttherapie die Schwere, Dauer und Intensität der Begleitsymptome der Migräne deutlich besser als in der Plazebo-Gruppe behandeln.
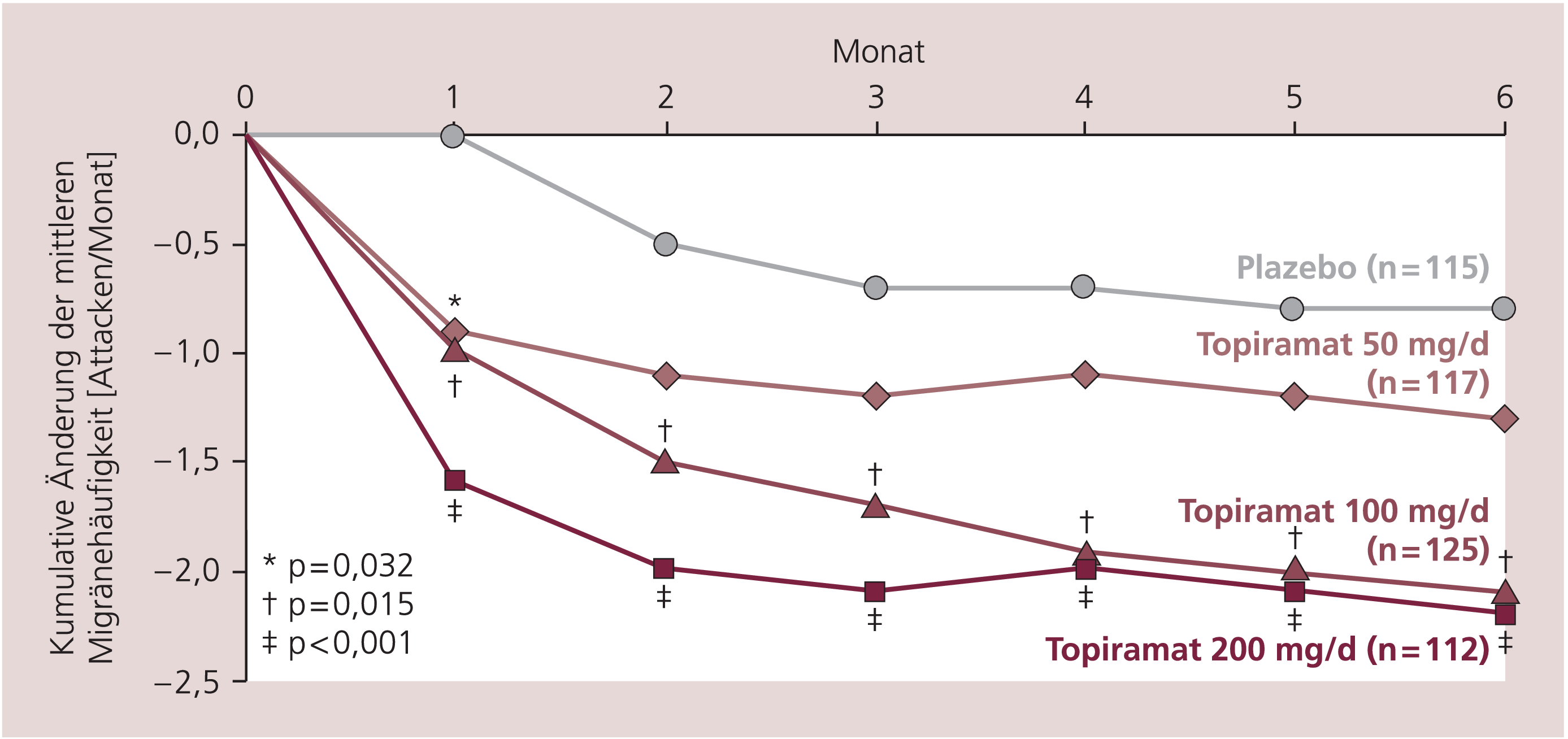
Abb. 3. Zeitpunkt des Wirkungseintritts von Topiramat. Gepoolte Daten aus den beiden nordamerikanischen Studien [nach 2, 15]
Topiramat bei Kindern und Jugendlichen (off label)
Die Daten zu Wirksamkeit und Verträglichkeit von Topiramat bei 162 Kindern im Alter von 6 bis 15 Jahren wurden in einer randomisierten, Plazebo-kontrollierten Studie ausgewertet. Bei 32% aller Patienten der Topiramat-Behandlungsgruppe konnte die monatliche Anzahl der Migräneattacken um ≥75% verbessert werden. Im Vergleich dazu lag der Wert der Plazebo-Gruppe bei 14% (p=0,02) [23].
In einer Post-hoc-Analyse der drei randomisierten, doppelblinden, Plazebo-kontrollierten Parallelgruppenstudien wurden die Daten von 55 Patienten im Alter zwischen 12 und 18 Jahren ausgewertet, wobei sich in der 100-mg/d-Topiramat-Gruppe eine statistisch signifikante Reduktion des monatlichen Medikamentengebrauchs, der monatlichen Migränehäufigkeit sowie der Migränetage darstellen ließ. Parästhesien, Infektionen der oberen Atemwege und Gewichtsverlust waren die häufigsten, therapiebedingten unerwünschten Ereignisse.
Die Autoren dieser Publikation, deren Daten auch in mehreren Postern vorgestellt wurden, schlussfolgern, dass Topiramat von Kindern und Jugendlichen gut vertragen wird und effektiv ist. Diese Feststellung sollte jedoch unter dem Kriterium des Off-Label-Use gesehen werden. Es stehen noch weitere Studien zur Wirksamkeit und Verträglichkeit dieser Substanz bei Jugendlichen aus.
Topiramat bei chronischer Migräne
Die Internationale Kopfschmerzgesellschaft klassifiziert eine chronische Migräne bei mehr als 15 Migränetagen pro Monat. Silvestrini et al. [20] untersuchten die Wirksamkeit von Topiramat bei Patienten mit chronischer Migräne. 28 Patienten mit dieser Diagnose wurden in eine doppelblinde, randomisierte, Plazebo-kontrollierte Studie aufgenommen. Die Baseline-Phase dauerte acht Wochen, anschließend wurden 14 Patienten in die Verum-Gruppe aufgenommen; Topiramat wurde in 25-mg-Schritten binnen einer Woche zu einer Zieldosis von 50 mg/d aufdosiert, dann wurde diese Dosis für weitere acht Wochen belassen. Die Anzahl der Kopfschmerztage pro Monat wurde als Zielvariable festgelegt. Patienten der Topiramat-Gruppe hatten initial 20,9±3,2 Kopfschmerztage pro Monat. Patienten der Plazebo-Gruppe 20,8±3,2 Kopfschmerztage pro Monat. Die Wirksamkeit von Topiramat wurde in den letzten vier Wochen erhoben, hier zeigte sich in der Verum-Gruppe eine niedrigere Kopfschmerzfrequenz von 8,1±8,1 Kopfschmerztage pro Monat. Plazebo-Patienten berichteten dagegen über eine unveränderte Kopfschmerzfrequenz.
Das mangelnde Ansprechen auf Plazebo mag ein Hinweis auf ein methodisches Problem dieser Studie sein, derzeit befinden sich jedoch zwei große, randomisierte Studien an Patienten mit chronischer Migräne in der Auswertung. In einem Arm dieser Studie wurde auch die Wirksamkeit von Topiramat bei Patienten mit medikamenteninduziertem Kopfschmerz, bei dem üblicherweise prophylaktische Medikation nicht hilfreich ist, untersucht. Die Ergebnisse der ersten 100 ausgewerteten Patienten der PROMT-Studie (Prolonged migraine prevention with topiramate) wurden in einem Poster auf dem EFNS (European Federation of Neurological Societies)-Kongress in Athen 2005 vorgestellt. Die Ergebnisse legen nahe, dass die empfohlene Dosis 100 mg Topiramat pro Tag beträgt. In der offenen Behandlungsphase wurde eine Verminderung der Migränehäufigkeit festgestellt und ging einher mit einer Verbesserung der Migräne-assoziierten Lebensqualität, gemessen mit MIDAS(Migraine disability assessment score)- und HIT6(Headache impact test)-Fragebögen.
Häufige Nebenwirkungen waren Kribbelparästhesien, wobei diese nur für 4% der Studienabbrüche ursächlich waren [1].
Klinische Besonderheiten von Topiramat
Die Ansprechrate von Topiramat entspricht laut Studienlage den anderen, gut wirksamen Migräneprophylaktika (Betablocker, Flunarizin). Ein wesentlicher Vorteil von Topiramat ist jedoch, dass diese Substanz nicht zu einer Gewichtszunahme führt (Abb. 4) und im Gegensatz zu den anderen als Therapie der ersten Wahl empfohlenen Medikamenten einen raschen Wirkungseintritt bereits gegen Ende des ersten Behandlungsmonats zeigt. Dies entspricht häufig den Wünschen von betroffenen Patienten. Nachteilig an Topiramat ist sein multiples Nebenwirkungsspektrum (Tab. 2 bis 4). Nebenwirkungen lassen sich prinzipiell aufteilen in häufige, leichte Nebenwirkungen, die im Verlauf der Behandlung reversibel sind, wie Parästhesien und Geschmacksveränderungen. Diese können bei Bedarf durch die Substitution von Kaliumionen oder Ernährungsumstellung behandelt werden. Problematisch sind Gedächtnis- und Merkfähigkeitsstörungen, die vereinzelt auftreten können und immer zum Abbruch der Behandlung führen sollten.
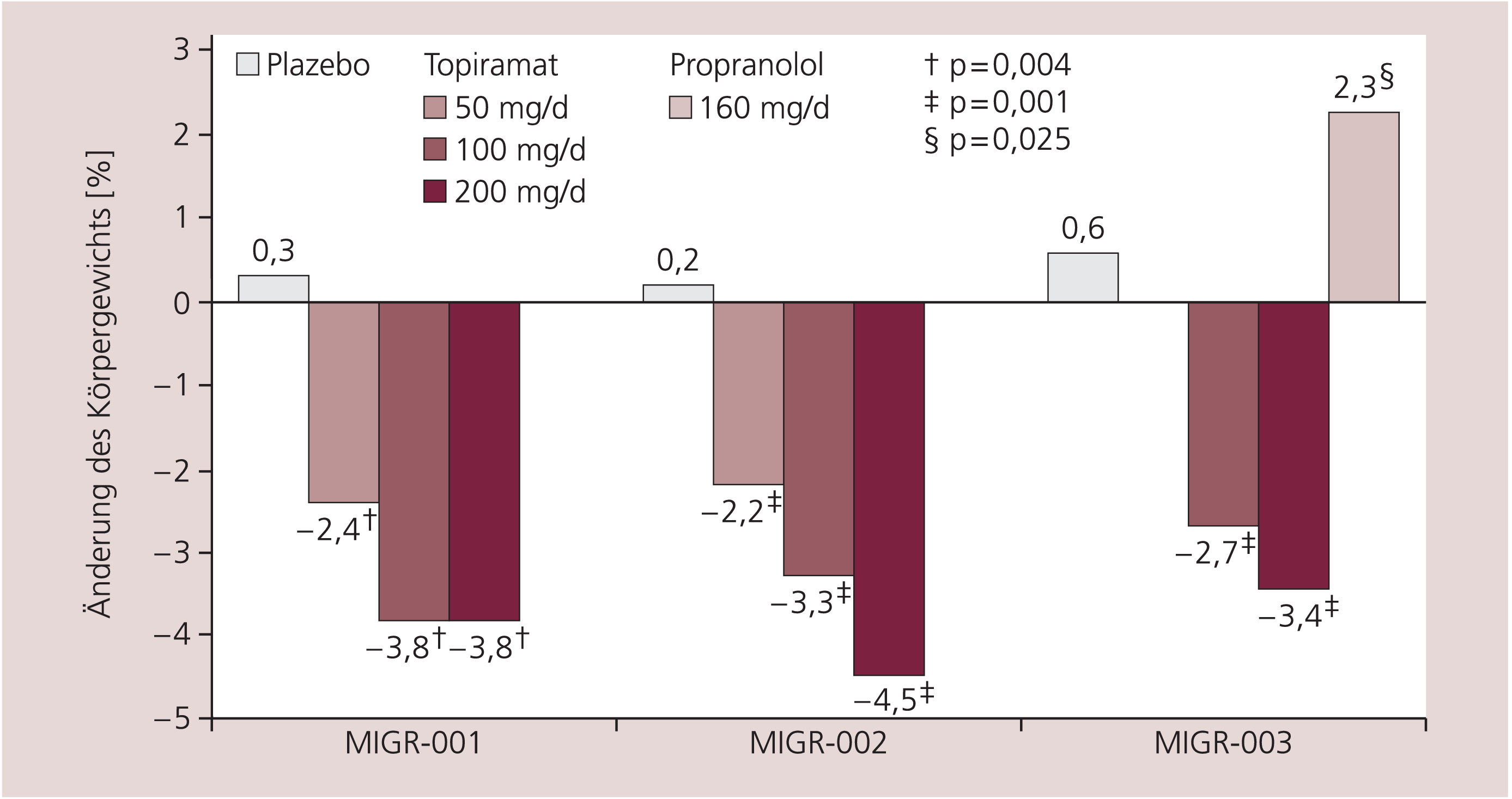
Abb. 4. Prozentuale Änderung des Körpergewichts unter Plazebo, Topiramat und Propranolol. Gepoolte Daten aus den Studien MIGR-001/-002/-003 und der CAPSS-155-Studie [mod. nach 2, 5, 15]
Tab. 2. Die häufigsten aufgetretenen unerwünschten Ereignisse [%]* mit Ausnahme des ZNS (gepoolte Analyse von Daten, die in den Studien MIGR-001/-002/-003 und der CAPPSS-55-Studie beobachtet wurden) [mod. nach 2, 5, 15]
|
Plazebo |
Topiramat |
|||
|
|
50 mg/d |
100 mg/d |
200 mg/d |
|
|
Parästhesien |
6 |
35 |
51 |
49 |
|
Müdigkeit |
11 |
14 |
15 |
19 |
|
Appetitverlust |
6 |
9 |
15 |
14 |
|
Übelkeit |
8 |
9 |
13 |
14 |
|
Diarrhö |
4 |
9 |
11 |
11 |
|
Gewichtsabnahme |
1 |
6 |
9 |
11 |
|
Geschmacksveränderung |
1 |
15 |
8 |
12 |
|
Hypästhesie |
2 |
6 |
7 |
8 |
|
Bauchschmerzen |
5 |
6 |
6 |
7 |
* Angegeben sind die unerwünschten Ereignisse, die bei >5% in der Gruppe mit 100 mg oder/und in den Gruppen mit 100 mg und 200 mg öfter als mit Plazebo auftraten
Tab. 3. Die häufigsten unerwünschten Ereignisse [%]* im Bereich des ZNS (gepoolte Analyse von Daten, die in den Studien MIGR-001/-002/-003 und der CAPPSS-55-Studie beobachtet wurden) [mod. nach 2, 5, 15]
|
Plazebo |
Topiramat |
|||
|
|
50 mg/d |
100 mg/d |
200 mg/d |
|
|
Schläfrigkeit |
5 |
8 |
7 |
10 |
|
Schlaflosigkeit |
5 |
6 |
7 |
6 |
|
Gedächtnisschwierigkeiten |
2 |
7 |
7 |
11 |
|
Sprachschwierigkeiten |
2 |
7 |
6 |
7 |
|
Konzentrationsschwierigkeiten |
2 |
3 |
6 |
10 |
|
Stimmungsschwankungen |
2 |
3 |
6 |
5 |
|
Angst |
3 |
4 |
5 |
6 |
* Angegeben sind die unerwünschten Ereignisse, die bei >5% in der Gruppe mit 100 mg oder/und in den Gruppen mit 100 mg und 200 mg öfter als mit Plazebo auftraten
Tab. 4. Die häufigsten unerwünschten Ereignisse, die zum Studienabbruch führten [%]* (gepoolte Analyse von Daten, die in den Studien MIGR-001/-002/-003 und der CAPPSS-55-Studie beobachtet wurden) [mod. nach 2, 5, 15]
|
Plazebo |
Topiramat |
|||
|
|
50 mg/d |
100 mg/d |
200 mg/d |
|
|
Parästhesien |
1 |
3 |
8 |
7 |
|
Müdigkeit |
1 |
3 |
5 |
5 |
|
Gedächtnisschwierigkeiten |
1 |
1 |
3 |
2 |
|
Schlaflosigkeit |
1 |
2 |
3 |
3 |
|
Konzentrationsschwierigkeiten |
<1 |
<1 |
2 |
5 |
|
Übelkeit |
1 |
3 |
2 |
6 |
|
Sprachschwierigkeiten |
<1 |
2 |
2 |
2 |
|
Nervosität |
<1 |
2 |
2 |
1 |
|
Diarrhö |
<1 |
1 |
2 |
2 |
|
Appetitverlust |
<1 |
1 |
2 |
3 |
|
Angst |
<1 |
1 |
2 |
2 |
|
Schwäche |
<1 |
0 |
2 |
1 |
|
Verwirrtheit |
<1 |
<1 |
2 |
1 |
|
Hypästhesie |
<1 |
<1 |
2 |
2 |
* Unerwünschte Ereignisse, die bei >2% in der Gruppe mit 100 mg und öfter als mit Plazebo auftraten. Pro Patient kann mehr als ein behandlungslimitierendes unerwünschtes Ereignis aufgetreten sein.
Als seltene und schwere Nebenwirkungen sind aus den Topiramat-Studien in erster Linie Nierensteine zu nennen; in den klinischen Studien entwickelten elf von über 2000 Patienten Nierensteine. In dem Epilepsieprogramm, das seit 1995 durchgeführt wird und in dem mittlerweile über 3 Mio. Patienten mit Topiramat behandelt worden sind, kam es zu 140 Schwangerschaften, in der Monotherapie mit Topiramat kam es zu keiner erhöhten Missbildungsrate. Eine sehr seltene Nebenwirkung von Topiramat ist die akute Myopie mit raschem Anstieg des intraokulären Drucks und Sehstörung. Seit 2001 wurde diese seltene Nebenwirkung bei sechs Patienten beobachtet, die Topiramat wegen Migräne einnahmen. Eine metabolische Azidose kann sehr selten auftreten, wobei die Nebenwirkung dosisabhängig ist. Eine extrem seltene Nebenwirkung, die nur bei Kindern und alten Menschen auftritt, ist eine Oligohydrosis mit Fieber. Dann muss die Topiramat-Gabe sofort gestoppt werden.
Topiramat zur Prophylaxe bei Migräneaura
In einer Pilotstudie [12] wurde die Wirksamkeit von Topiramat bei Patienten mit Migräne mit Aura untersucht. 12 Patienten wurden über sechs Monate offen mit Topiramat behandelt, wobei die Dosis 100 mg/d betrug. Die Frequenz oder die Dauer der Aura wurde durch dieses Behandlungsregime nicht beeinflusst, wohl aber die Reduktion der Frequenz, Intensität und Dauer der Kopfschmerzattacken. Die Nebenwirkungen, die auftraten führten nie zum Therapieabbruch. Spekulativ ist, ob eine höhere Dosis als 100 mg/d für die Reduktion von Aura sinnvoll ist. Andere Membranstabilisatoren wie Lamotrigin [13] hatten einen positiven Effekt auf die Aura. Somit wäre die Behandlungsrationale der Autoren plausibel, die eine prä- und postsynaptische Inhibierung von Glutamat postulieren und sich damit auf das Konzept der Cortical Spreading Depression, durch temporär unkontrollierte Freisetzung von Glutamat entstehend, stützen.
Aus der Datenanalyse der ersten drei Plazebo-kontrollierten Studien wurde in einer Post-hoc-Analyse die Effektivität von Topiramat 100 mg/d bei Patienten mit Migräne mit Aura analysiert. In dieser 26-wöchigen randomisierten, doppelblinden, Plazebo-kontrollierten Untersuchung zeigte sich, dass Topiramat 100 mg signifikant die durchschnittliche Migränehäufigkeit bei Patienten mit Migräne mit Aura (p=0,034 vs. Plazebo) und Patienten mit Migräne ohne Aura (p<0,001 vs. Plazebo) reduzierte. Die Autoren schlussfolgern aus dieser Studie, dass Topiramat 100 mg signifikant auch die durchschnittliche Anzahl der Aura-Episoden pro Monat reduziert [16].
Lebensqualität
Von Gesundheitsbehörden wird zunehmend gefordert, in der Migräneprophylaxe auch Lebensqualität der Patienten zu untersuchen. Dahlöf et al. präsentierten auf dem EFNS-Kongress in Athen die Daten zur Lebensqualität aus den gepoolten Studien [3]. Zusammenfassend verbessert sich die Lebensqualität, gemessen mit Messinstrumenten wie HRQOL (Health-related quality of life), signifikant bei Patienten, die mit 100 mg/d Topiramat über sechs Monate behandelt werden. Der gleiche Effekt spiegelt sich auch in veränderten Werten des SF-36 als Depressionsfragebogen wider [15].
Schlussfolgerung
Das umfangreiche Studienprogramm zu Topiramat zeigt, dass Topiramat in einer Dosierung zwischen 50 und 100 mg/d eine wirksame und überwiegend nebenwirkungsarme Behandlungsoption für die Migräneprophylaxe darstellt. In Vergleichsstudien wirkte Topiramat ähnlich auf Attackenfrequenz und -schwere wie Propranolol. Vorteilhaft ist der frühe Wirkungseintritt von Topiramat, was nicht nur die Reduktion der Frequenz der Attacken, sondern auch die Schwere der einzelnen Attacken angeht. Der unterschiedliche pharmakologische Ansatz von Topiramat im Vergleich zu anderen verfügbaren Substanzen erlaubt den Einsatz bei Patienten mit Asthma bronchiale und Gewichtsproblemen. Problematisch für einzelne Patienten ist das Auftreten von Merkfähigkeitsstörungen und Wortfindungsstörungen, also kognitiven Nebenwirkungen, die jeweils zum Therapieabbruch führen sollten. Andere Nebenwirkungen wie Parästhesien oder Geschmacksveränderungen können häufig durch ein verändertes Aufdosierungsschema vermieden oder gemindert werden. Dazu empfiehlt sich das übliche Schema einer wöchentlichen Dosissteigerung um je 25 mg bis zum Erreichen einer Zieldosis von 100 mg/d, wobei die Dosis auf zwei Einheiten pro Tag aufgeteilt werden sollte. Ein langsameres Schema beginnt mit 12,5 mg/d mit Dosissteigerung um je 12,5 mg pro Woche. Kurzfristige Rückmeldungen des Patienten an den behandelnden Arzt erleichtern die Compliance und die Verträglichkeit.
Literatur
1. Agosti R, Joop O, Nilsson J, Schwalen S. PROlonged Migraine Prevention with Topiramate (PROMT): first results of the initial 6-month dose optimisation and maintenance open-label phase. Poster, EFNS, Athen 2005.
2. Brandes J, Saper J, Diamond M, Couch J, et al. Topiramate for migraine prevention: a randomized controlled trial. JAMA 2004;291:965–73.
3. Dahlöf C, Diamond M, Mao L, Rupnow M, et al. Analysis of quality of life indicators from 3 placebo-controlled trials of topiramate for migraine prevention. Poster, EFNS, Athen 2005.
4. Diener H, Limmroth V, Fritsche G, Brune K, et al. Therapie der Migräneattacke und Migräneprophylaxe. Leitlinie der Deutschen Gesellschaft für Neurologie und der Deutschen Migräne- und Kopfschmerzgesellschaft. In: Diener HC für die Kommission Leitlinien der DGN (Hrsg.). Leitlinien für Diagnostik und Therapie in der Neurologie. 3. Auflage. Stuttgart: Thieme, 2005.
5. Diener H, Tfelt-Hansen P, Dahlöf C, Lainez JM, et al., on behalf of the MIGR-003 Study Group. Topiramate in migraine prophylaxis: results from a placebo-controlled trial with propranolol as an active control. J Neurol 2004;251:943–50.
6. Diener HC, Rapoport A, Mauskop A, Schwalen S, et al. Long-term effectiveness of topiramate for migraine prevention: Analyses of open-label extension-phase data from two pivotal studies. Poster, EFNS, Athen 2005.
7. Dodick D, Hulihan J, Wu S-C. Do migraine preventive medications enhance the efficacy of triptans? Analyses from topiramate migraine trials. Migraine Trust International Symposium, London, 2004.
8. Freitag F, Collins S, Carlson H, Goldstein J, et al. A randomized trial of divalproex sodium extended-release tablets in migraine prophylaxis. Neurology 2002;58:1652–9.
9. Freitag FG, Hulihan J, Wu S-C. Early onset of response observed for topiramate when used as a migraine preventive agent. Annual Meeting of the American Headache Society, Vancouver, June 10–13, 2004.
10. Kaniecki RG. A comparison of divalproex with propranolol and placebo for the prophylaxis of migraine without aura. Arch Neurol 1997;54:1141–5.
11. Klapper J on behalf of the Divalproex Sodium in Migraine Prophylaxis Study Group. Divalproex sodium in migraine prophylaxis: a dose-controlled study. Cephalalgia 1997;17:103–8.
12. Lampl C, Bonelli S, Ransmayr G. Efficacy of topiramate in migraine aura prophylaxis: preliminary results of 12 patients. Headache 2004;44:174–7.
13. Lampl C, Buzath A, Klinger D, Neumann K. Lamotrigine in the prophylactic treatment of migraine aura – a pilot study. Cephalalgia 1999;19:58–63.
14. Leniger T, Diener HC. Die Antikonvulsiva Valproinsäure, Gabapentin, Topiramat und Lamotrigin in der Migränetherapie. Akt Neurol 2000;27:475–9.
15. Mathew N, et al. Topiramate in migraine prevention (MIGR-001): effect on migraine frequency [Abstract]. Neurology 2003;60(Suppl 1):A336.
16. Pascual J, Silberstein S, Mao l, Greenberg S. Efficacy of topiramate for the prevention of migraine in patients reporting symptoms of aura or migraine without aura. Poster, EFNS, Athen 2005.
17. Silberstein SD, Collins SD, Carlson H, the Depakote ER Migraine Study Group. Safety an efficacy of once-daily, extended-release divalproex sodium monotherapy for the prophylaxis of migraine headaches. Cephalalgia 2000;20:269.
18. Silberstein SD, Neto W, Schmitt J, Jacobs D, MIGR-001 Study Group. Topiramate in migraine prevention: results of large controlled trial. Arch Neurol 2004;61:490–5.
19. Silberstein SD, Neto W, Schmitt J, Jacobs D, MIGR-001 Study Group. Topiramate in migraine prevention: results of a large controlled trial. Arch Neurol 2004;61:490–5.
20. Silvestrini M, Bartolini M, Coccia M, Baruffaldi R, et al. Topiramate in the treatment of chronic migraine. Cephalalgia 2003;23:820–4.
21. Storey JR, Calder CS, Hart DE, Potter DL. Topiramate in migraine prevention: a double-blind, placebo-controlled study. Headache 2001;41:968–75.
22. Tfelt-Hansen P, Block G, Dahlöf C, Diener HC, et al. Guidelines for controlled trials of drugs in migraine: second edition. Cephalalgia 2000;20:765–86.
23. Winner P, Pearlman E, Linder S, Jordan D, et al. Topiramate for migraine prevention in children: A randomized, double-blind, placebo-controlled trial. Headache 2005;45:1304–12.
24. Young WB, Hopkins MM, Shechter AL, Silberstein SD. Topiramate: a case series study in migraine prophylaxis. Cephalalgia 2002;22:659–63.
Dr. Astrid Gendolla, Prof. Dr. Hans Christoph Diener, Universitätsklinik für Neurologie, Westdeutsches Kopfschmerzzentrum, Hufelandstr. 26, 45122 Essen, E-Mail: a.gendolla@uni-essen.de
Migraine prophylaxis with topiramate
Topiramate is approved in Germany for the prophylaxis of migraine. Patients with frequent migraine attacks do need prophylactic treatment. Migraine prophylaxis with topiramate has been shown to be effective in three placebo-controlled, randomized trials for preventive migraine therapy. Effective doses range between 15 and 100 mg per day, doses above 100 mg lead to more side effects. Adverse events include paresthesia, loss of appetite, dizziness, insomnia, anxiety and difficulties finding words. Topiramate might be also effective in the treatment of chronic migraine with or without medication overuse.
Keywords: Migraine, prophylaxis, topiramate
Psychopharmakotherapie 2006; 13(05)
